牡丹雄蕊对慢性非细菌性前列腺炎大鼠模型的影响
程丹丹,高德民,王岱杰,梁 栋,庞志勇,徐亚振,王惠敏,袁文鹏,
(1.齐鲁工业大学(山东省科学院),山东省科学院菏泽分院,山东省生物工程技术创新中心,山东菏泽 274000;2.山东中医药大学药学院,山东济南 250355;3.菏泽牡丹产业技术研究院,山东菏泽 274000)
牡丹(Paeonia suffruticosaAndr.)是毛茛科植物,主要分布在山东、河南、陕西、安徽等地。近年来牡丹产业发展迅速,牡丹系列深加工产品研发和生产得到大力发展,牡丹根皮、牡丹籽得到了深入开发应用。牡丹的雄蕊部分营养极为丰富,富含多种活性成分如活性多糖、蛋白质、芍药苷、α-亚麻酸、儿茶素等[1-2],另外含有多种矿物质元素、维生素、氨基酸等[3-4],是一种极佳的天然保健食品原料。目前,对于牡丹花蕊的研究主要集中在牡丹花蕊的化学成分、营养价值和抗氧化活性方向[5],关于牡丹花蕊功能性评价方面的研究较少,由于缺少基础理论支撑,市场上主要将牡丹雄蕊经过传统方式制成牡丹花蕊茶等一般食品被食用,造成了牡丹雄蕊没有得到充分的开发应用,从而造成了大量的资源浪费。
慢性非细菌性前列腺炎是指由于非细菌感染因素导致的患者长期、反复的骨盆区域疼痛或不适、排尿异常(可表现为尿急、尿频、尿痛和夜尿增多等)等症状的疾病[6-7]。由于慢性疼痛久治不愈,患者生活质量下降,并可能有性功能障碍、焦虑、抑郁、失眠、记忆力下降等[8-9]。慢性非细菌性前列腺炎目前以抗生素类药物治疗为主,植物提取物制剂在慢性非细菌性前列腺的应用中逐渐得到重视,疗效评价主要以缓解疼痛、改善排尿症状等为主[10-11]。但是,目前效果明显的植物制剂较少。
通过初步对经常饮用牡丹花蕊茶的人群(约50 例)开展调查,发现长期饮用牡丹花蕊茶能明显缓解尿急、尿频、尿痛和夜尿增多等症状,特别是对中老年人效果更佳显著。为了探究牡丹雄蕊在治疗前列腺炎方面的功效价值,实验采用去势+皮下注射激素(苯甲酸雌二醇)诱导的慢性非细菌性前列腺炎大鼠模型,开展体内药效学实验,评价牡丹雄蕊提取物治疗慢性非细菌性前列腺炎的药效作用。以期为其作为新型功能性食品,以及药用价值的开发提供理论依据。
1 材料与方法
1.1 材料与仪器
SD 大鼠 雄性,50 只,体重为(220±10)g,周龄为(6±1)周,采购于济南朋悦实验动物繁育有限公司,生产许可证号SCXK(鲁)20180007,饲养于烟台拉斐尔生物科技有限公司SPF 级动物房,实验动物使用许可证号SCXK(鲁)20170026。实验动物饲养管理的环境条件为室温20~26 ℃,相对湿度40%~70%,12/12 h 明暗交替。动物饲养于标准的大鼠塑料盒中,每笼5 只。观察动物的活动、饮食等表现进行检疫检查,检疫合格的动物方可用于试验。检疫期及实验期间,大鼠自由摄食、饮水;饲料 为SPF 级大鼠生长繁育饲料,采购于江苏省协同医药生物工程有限责任公司,生产许可证号苏饲证(2019)01008;苯甲酸雌二醇 索莱宝有限公司;塞来昔布 菏泽联众医药连锁药店;牡丹雄蕊 采自菏泽市牡丹区刘集村油用牡丹种植基地(35°22' 19"N;115°33' 28"E);苏木精染色液 无锡市江原实业技贸总公司;伊红染液(醇溶性)珠海贝索生物技术有限公司;中性树胶中国上海懿洋仪器有限公司;血栓素B2 ELISA 试剂盒、6-酮-前列腺素F1αELISA 试剂盒、肿瘤坏死因子-α(TNF-α)、PGE2、白细胞介素-8(IL-8)ELISA试剂盒等 山东沃恩生物科技有限公司。
YP5001 电子天平 上海佑科仪器仪表有限公司;TG20-WS 冷冻离心机 长沙湘智离心机仪器有限公司;DHJ-9240A 电热恒温鼓风干燥箱 上海新苗医疗器械制造有限公司;RSJ-1A 组织染色机、ZKPJ-1A 摊烤片机、BMJ-1B 包埋仪 天津爱华医疗器械有限公司;Axio Scope 生物显微镜 上海佑科仪器仪表有限公司;HVS-1300-U 超净工作台 苏州净化设备有限公司;Histocore Biocut 切片机 德国Leica 公司;Versa Max 酶标仪 美谷分子仪器有限公司。
1.2 实验方法
1.2.1 造模 随机选取42 只大鼠腹腔注射10%水合氯醛进行麻醉,无菌条件下进行去势手术,然后全层缝合,消毒包扎。行去势手术的大鼠于第3 d 每日背部皮下注射苯甲酸雌二醇(0.25 mg·kg-1),连续30 d,造模后抽取2 只大鼠进行病理学检查,分析慢性非细菌性前列腺炎的模型情况[12-13]。实验方案经山东省科学院菏泽分院实验动物伦理委员会审查批准。
1.2.2 分组及给药 将造模成功的SD 大鼠随机分成5 组,每组8 只,给药剂量及次数根据中药药理学等效剂量系数折算法换算[14-15],即模型组,阳性组(塞来昔布组250 mg·kg-1),牡丹雄蕊冻干粉低、中、高剂量组(100、200、400 mg·kg-1),1 次/d,连续30 d,另外8 只未经造模的大鼠作为空白对照组,空白组和模型组给予等量生理盐水[13]。
1.2.3 前列腺病理检查 大鼠末次给药1 h 后,摘取眼球取血后处死大鼠,迅速解剖。大鼠解剖后迅速取出新鲜的前列腺组织,各组随机选取一部分前列腺组织用4%的甲醛固定,二甲苯脱水,常规石蜡包埋,切片,HE 染色,制备病理组织切片。观察大鼠前列腺间质增生、炎细胞浸润及腺体、腺腔数量与形态学变化情况[16]。
1.2.4 大鼠前列腺指数及卵磷脂小体密度检测 用电子分析天平精密称重前列腺,并计算前列腺指数(mg·g-1)[13]。将剩余部分前列腺组织迅速按摩,取出15 μL 前列腺液于显微镜下计数白细胞,另取15 μL前列腺液涂片,于显微镜下观察卵磷脂小体密度并按以下临床检验标准记录。标准分为4 级(满视野为4 级,3/4 视野为3 级,1/2 视野为2 级,1/4 视野为1 级)。
1.2.5 血液及组织中生化指标检测 眼球取血,2 h后离心,离心时间为10 min,转速为3000 r/min,然后将移吸管吸出分离的血清,置于4 ℃冰箱保存备用。测定血清中血栓素B2(TXB2)以及6-酮-前列腺素F1α(6-K-PGF1α)的含量;将大鼠前列腺组织匀浆,制成0.5 g/mL 浓度[17],按试剂盒说明操作,ELISA 法测定大鼠前列腺组织中ICAM-1、INF-γ、TNF-α、PGE2、IL-8 和MCP-1 的含量,并采用比色法测定大鼠前列腺组织NO 含量。
1.2.6 免疫组织化学检测各组大鼠前列腺组织NFκB 表达 将石蜡包埋的大鼠前列腺组织切片脱蜡后与3%的过氧化氢孵育10 min,然后加入0.01 mol/L的柠檬酸盐缓冲液后,用山羊血清封闭。室温下孵育15 min,然后加入抗NF-κB/P65 抗体,4 ℃孵育12 h 后加入IgG,37 ℃温育15 min。用DAB 染色,苏木精复染,1%盐酸盐和乙醇进行分色,洗涤25 min后进行检测分析,根据阳性表达强度进行分级,不表达为0,弱表达为1,中度表达为2,强表达为3,计算平均值(n=3)[18-19]。
1.3 数据处理
实验所有的数据均用SPSS16.0 统计软件进行处理,数据用均值±标准差来表示,组间差异按照t检验法进行检验,结果以P<0.05 时有统计学意义。
2 结果与分析
2.1 大鼠模型的建立
对造模后大鼠前列腺腺体观察,发现大鼠前列腺腺体发生肿大,腺体质地坚硬,与周围组织粘连。与空白对照组比较,模型组大鼠腺体中的炎症细胞浸润现象严重。以上观察提示,去势联合注射苯甲酸雌二醇成功诱导了大鼠非细菌性前列腺炎模型。
2.2 牡丹雄蕊对前列腺病理组织的影响
由图1 可知,前列腺病理检查发现模型组腺泡上皮细胞变性;大部分腺泡扩张,腔内见大量混合有炎性细胞的分泌物,并见细胞坏死;间质内见单核细胞浸润。阳性药物组仅见部分腺泡扩张,腔内分泌物增多;但腺泡腔未见明显的炎性细胞浸润。低剂量组见腺泡上皮细胞变性;大部分腺泡扩张,腔内见大量分泌物,混合有少量炎性细胞;间质内见与模型组相似的单核细胞浸润。中剂量组见腺泡上皮细胞变性;腺泡扩张不明显,腔内仅见少量分泌物,少量炎性细胞;间质内见与模型组相似的单核细胞浸润。高剂量组见腺泡上皮未见明显异常,腺泡扩张不明显;间质内见与模型组相似的单核细胞浸润。

图1 各组大鼠前列腺组织病理切片(HE 染色)Fig.1 Pathological sections of prostate tissue of rats in each group (HE staining)
2.3 牡丹雄蕊对大鼠卵磷脂小体密度的影响
由表1 可知,模型组大鼠的卵磷脂小体密度显著低于空白组(P<0.01),表明模型组中巨噬细胞吞噬了大量脂类。与模型组比较,牡丹雄蕊各剂量组能显著提高卵磷脂小体密度(P<0.01,P<0.05),表明牡丹雄蕊各剂量组中巨噬细胞减少。牡丹雄蕊各剂量组卵磷脂小体密度均低于阳性组,牡丹雄蕊各剂量中高剂量组卵磷脂小体密度最高,表明牡丹雄蕊可以缓解前列腺炎的症状,且缓解效果与牡丹雄蕊的剂量有关。
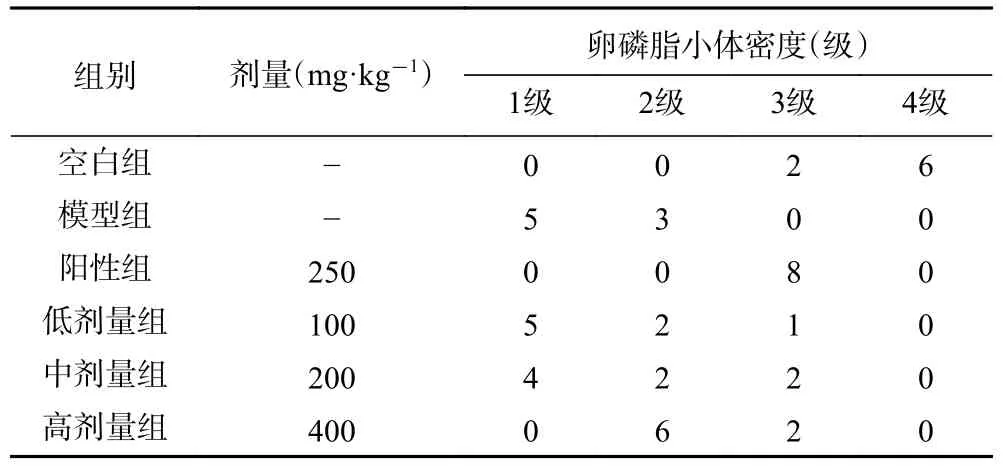
表1 牡丹花蕊对大鼠卵磷脂小体密度的影响Table 1 Effect of peony stamen on lecithin corpuscle density in rats
2.4 牡丹雄蕊对大鼠前列腺重、前列腺指数及白细胞数的影响
表2 可知,与空白组比较,模型组白细胞数、前列腺重和前列腺指数均显著或极显著提高(P<0.01,P<0.05);阳性组及各给药组与模型组比较,均能显著或极显著降低大鼠前列腺液中白细胞数、前列腺重和前列腺指数(P<0.01,P<0.05),牡丹雄蕊高剂量组降低效果最明显,表明牡丹雄蕊能降低前列腺炎大鼠前列腺液中白细胞数,缓解前列腺肿胀度,且作用效果与牡丹雄蕊的剂量有关。
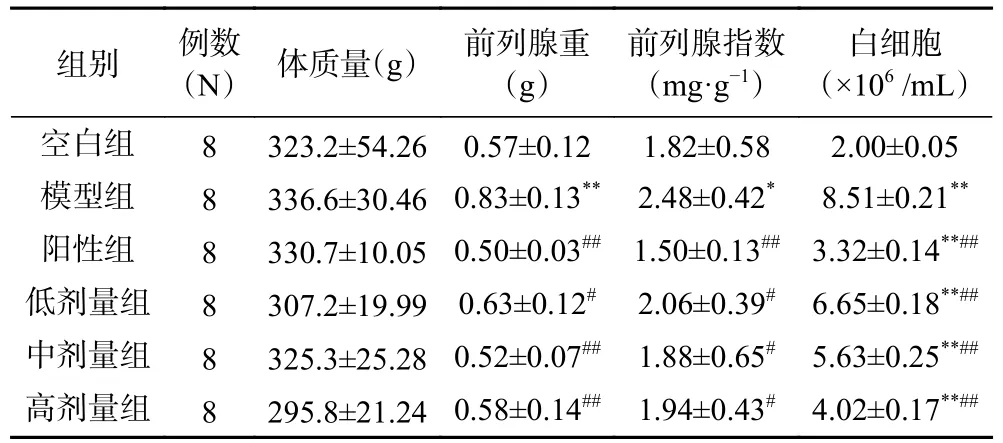
表2 各组大鼠体质量、腺体质量、前列腺指数及白细胞数Table 2 Body mass,gland mass,prostatic index and white blood cell count in rats in each group
2.5 牡丹雄蕊对前列腺组织中细胞因子含量的影响
由表3 可知,与空白组比较,模型组前列腺组织中ICAM-1、PGE2、TNF-α、IL-8 及MCP-1 的表达均极显著升高(P<0.01),INF-γ的含量略升高但差异无统计学意义(P>0.05)。与模型组比较,各给药组PGE2 表达极显著降低(P<0.01);ICAM-1、INF-γ、TNF-α和MCP-1 的表达也均显著降低(P<0.05),但中剂量组和低剂量组降低不明显,仅高剂量组有显著性差异(P<0.05);各给药组IL-8 的表达也均有下降,高剂量组降低极显著(P<0.01)。结果表明,牡丹雄蕊能降低PGE2、TNF-α、IL-8、MCP-1 的表达,且有明显的量效关系。
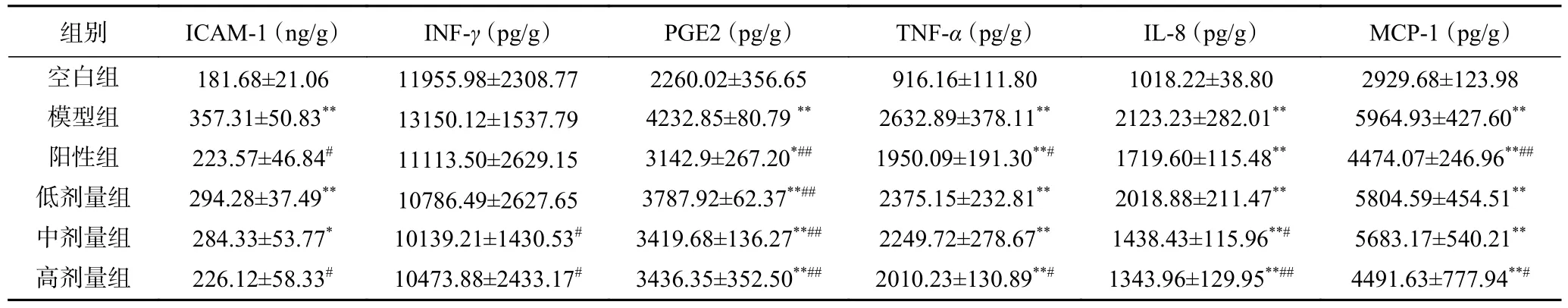
表3 各组大鼠前列腺组织中ICAM-1、INF-γ、PGE2、TNF-α、IL-8 及MCP-1 的含量Table 3 Contents of ICAM-1,INF-γ,PGE2,TNF-α,IL-8 and MCP-1 in prostate tissue of rats in each group
2.6 牡丹雄蕊对前列腺组织中NO 含量的影响
由图2 可知,与空白组比较,模型组大鼠前列腺组织中NO含量极显著降低(P<0.01),其余各组也有所降低,但低剂量组和中剂量组有显著性差异(P<0.05);与模型组比较,各给药组NO 含量均升高,其中高剂量组中NO 含量升高极显著(P<0.01),略高于阳性对照组。

图2 各组大鼠前列腺组织NO 的含量Fig.2 NO contents in prostate tissue of rats in each group
2.7 牡丹雄蕊对血液中TXB2 和6-K-PGF1α 的表达的影响
表4 可知,与空白组比较,各组血液中TXB2 表达极显著升高,各给药组与模型组比较TXB2 表达显著极降低(P<0.01),且有显著量效关系;与空白组比较,各组血液中6-K-PGF1α表达显著极降低(P<0.01),各给药组与模型组比较6-K-PGF1α表达均明显升高,其中,高剂量组6-K-PGF1α表达升高较显著,接近阳性对照组。
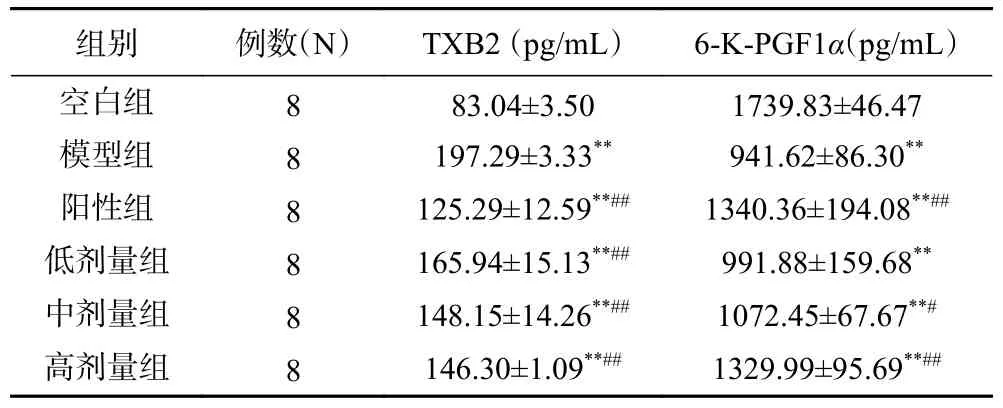
表4 各组大鼠血液中TXB2 和6-K-PGF1α 表达水平Table 4 TXB2 and 6-K-PGF1α expression levels in blood of rats in each group
2.8 牡丹雄蕊对大鼠前列腺组织NF-κB 表达的影响
由图3 可知,与空白组比较,牡丹雄蕊各剂量组NF-κB 阳性表达增强,均有显著性差异(P<0.01),与模型组比较,牡丹花蕊各剂量组NF-κB 阳性表达减弱,且有显著性差异(P<0.01,P<0.05),牡丹花蕊高剂量组阳性表达水平与阳性组接近,牡丹花蕊中剂量组与低剂量组阳性表达未显示出表达水平与治疗剂量的相关性。

图3 各组大鼠前列腺组织NF-κB 的表达水平(IHC)Fig.3 NF-κB expression in prostate tissue of rats in each group (IHC)
3 讨论与结论
从各组前列腺的病理组织学观察可知,模型组腺泡上皮细胞变性、分泌物增加并伴有炎性细胞渗出等,间质以炎性细胞浸润为主。与模型组比较,腺泡上皮细胞变性的严重程度和腺泡腔内的分泌物量及其伴有炎性细胞渗出数量降低;与阳性组比较,各剂量牡丹雄蕊组腺泡上皮细胞变性的严重程度和腺泡腔内的分泌物量及其伴有炎性细胞渗出数量均较明显;各剂量组之间比较,细胞变性严重程度和腺泡腔内分泌物量:低剂量>中剂量>高剂量。
ICAM-1 是一种重要的细胞表面黏附分子,它介导的细胞黏附是机体正常防御系统得以存在和维持功能的重要基础,但组织细胞ICAM-1 的持久或增强表达又可导致组织器官的炎症免疫损伤[20]。INF-γ主要由活化T 细胞和NK 细胞产生,有广泛的免疫调节作用。MCP-1 对单核/巨噬细胞有很强的趋化活性,在介导炎症的发生和发展中起关键作用,可提高单核细胞和内皮细胞之间的黏附,并介导单核细胞的趋化和活化,促进单核细胞穿过内皮屏障,分泌多种生物活性物质引起组织的损伤[21]。TNF-α是非常重要的促炎性细胞因子,在多种炎性反应中都起着至关重要的作用,可调节机体免疫反应、炎症反应、内毒素调节。PGE2 可以使机体扩大炎症疼痛,造成局部水肿[22]。TNF-α、IL-8 参与MMP-9 的表达调节,进而降解细胞外基质,使粒细胞更快地到达间质中参与炎症反应,加重非细菌性前列腺炎的症状[23]。正常情况下内皮源性NO 具有抑制炎症反应的作用,病理情况下诱导型NO 合成酶合成大量的NO 则有细胞毒作用加重炎症反应[24]。实验表明牡丹雄蕊可通过降低前列腺组织异常升高的ICAM-1、MCP-1 水平,降低NO 含量,降低TNF-α、PGE2 和IL-8 因子水平,抑制炎性细胞的迁移、黏附,阻止其穿越血管内皮细胞,减轻炎性细胞对前列腺组织的浸润,最终减少炎性介质在前列腺组织的释放,减轻前列腺组织的炎症免疫损伤[18-21]。揭示牡丹雄蕊可缓解前列腺组织炎症,减轻疼痛及前列腺组织的损伤。
TXB2 是前列腺素中的一种,主要作用为促进血小板聚集和收缩血管,当其水平增高会使血小板大量聚集形成瘀血[25]。6-keto-PGF1α是由血管内皮细胞产生的PGI2 代谢出来,在正常的生理状态下,TXB2和PGI2 的水平处于相对平衡状态。当有生物活性物质刺激血小板时,花生四烯酸代谢合成大量TXB2,并产生大量能抑制PGI2 合成酶活性的自由基脂质过氧化物,使PGI2 合成相应减少,导致血中PGI2/TXB2 的平衡失调[7,26]。与空白对照组相比,模型组的大鼠血浆中TXB2 水平显著升高以及6-keto-PGF1α水平显著降低。说明前列腺遭到一定程度的破坏,致使TXB2 大量释放,6-keto-PGF1α分泌减少,出现了失衡状态。与模型组相比,各剂量牡丹雄蕊组均能降低TXB2 水平,升高6-keto-PGF1α水平,尤其牡丹雄蕊高剂量效果较显著。揭示牡丹雄蕊对慢性非细菌性前列腺炎大鼠模型的血液循环障碍有缓解作用。NF-κB 因子作为调节炎症反应和免疫反应的关键核转录因子,在多种炎症信号通路中发挥着重要作用[27]。NF-κB 的激活导致前列腺炎组织中TNF-α和IL-1β表达升高[28]。
综上所述,牡丹雄蕊可减轻模型组前列腺炎大鼠前列腺的肿胀度,对血液及前列腺组织中炎症因子有调节作用,可显著降低促炎性细胞因子水平,抑制前列腺组织中的炎症反应,改善前列腺组织病理状态,对慢性非细菌性前列腺炎具有较好的功效,本实验对牡丹雄蕊在功能性食品,甚至药品方向的开发应用提供了理论依据。

