固态发酵刺梨果渣改性膳食纤维工艺优化及结构特性分析
何兰兰,马四补,姜 特,梁文娟,晋海军,张丽艳
(贵州中医药大学,贵州贵阳 550025)
刺梨(Rosa roxburghiiTratt.)学名缫丝花,又称送春归,为蔷薇科蔷薇属植物[1],主要分布于我国贵州、云南,海拔500~2500 m 的向阳山坡、沟谷、灌木丛的热带及亚热带地区[2]。刺梨为贵州省的优势资源,据2021 年报道,全省人工种植面积约156 万亩,年产鲜果50 万吨,产值达100 亿元[3]。目前,刺梨相关产品的开发主要以刺梨汁为原料,榨汁后可产生大量果渣副产物,保守估计贵州省每年产刺梨果渣超过2 万吨[4]。刺梨果渣易发霉、腐烂,不易保存,会造成环境污染。
刺梨果渣中含有较多的功能性成分,如膳食纤维(dietary fiber,DF)、维生素C 和黄酮类等,其中膳食纤维的含量高达70%以上[4]。膳食纤维是继糖类、脂类、蛋白质、矿物质、维生素和水之后的“第七大营养物质”,据其溶解度不同,分为不溶性膳食纤维(insoluble dietary fiber,IDF)和可溶性膳食纤维(soluble dietary fiber,SDF)。IDF 可减少排泄物在肠道的驻留时间,具有促进润肠排便的功效[5];SDF 具有降低血脂水平,降低血压,改善血糖控制,减轻体重,改善免疫功能和减少炎症等作用[6]。前人对刺梨果渣中膳食纤维提取工艺做过一些研究,但大多以SDF 为评价指标,而刺梨果渣中IDF 和SDF对人体均具有一定的有益功效,对植物材料中膳食纤维科学的评价指标应为SDF/IDF。郭京京等[7]和Zhang 等[8]均以SDF/IDF 为评价指标,分别对沙棘渣、银耳中膳食纤维做出科学评价。本课题组前期研究发现刺梨果渣中SDF 含量较低,不利于其果渣资源的二次开发利用[3]。营养学家认为,提高SDF 在DF 中的比例,可增强膳食纤维的功效[9]。根据膳食纤维的功能和结构特点,采用化学法、酶解法、化学-酶结合法、微生物发酵法等方法可提高SDF 含量。其中微生物发酵法具有反应条件温和、污染少、易处理等优点,其又可分为液态发酵与固态发酵,发酵刺梨果渣大多采用微生物液态发酵法,未见固态发酵[2]。微生物固态发酵相较于液态发酵具有水分活度低、易生长、酶活力高、发酵过程无需严格无菌、成本低、易操作、可产生特殊风味、提高营养价值等优点[10]。
本文以SDF/IDF 为响应值,筛选刺梨果渣微生物固态发酵发酵优势菌种,采用响应面法对发酵工艺进行优化,以期获得最佳发酵工艺;通过持水性、持油性及膨胀力,分析发酵前后DF 理化性质的改变;利用扫描电镜、傅里叶红外光谱及X-射线分析发酵前后DF 结构变化。本文旨在提高刺梨果渣SDF/IDF,改善DF 理化性质及结构特性,为今后开发刺梨果渣副产品,提高其资源的利用率,减少资源浪费提供技术资料。
1 材料与方法
1.1 材料与仪器
新鲜刺梨果渣 国药集团同济堂(贵州)制药有限公司提供;发酵菌种(枯草芽孢杆菌、绿色木霉、米曲霉、黑曲霉、植物乳杆菌、嗜热链球菌、平菇、灵芝)中国工业微生物菌种保藏管理中心;耐高温α-淀粉酶(酶活力≥4×104U/g)、糖苷酶(酶活力≥1.0×105U/g)北京索莱宝科技有限公司;酸洗硅藻土上海麦克林生化科技股份有限公司;其它试剂均为国产分析纯。
XS205 型电子天平 瑞士梅特勒公司;L-600 型离心机 湘仪离心机有限公司;UV2510PC 型紫外分光光度 岛津企业管理(中国)有限公司;D8 Advance 粉末X 射线衍射仪 布鲁克(北京)科技有限公司;Nicolet iS50 FT-IR 傅里叶红外光谱仪 美国Thermo Fisher 公司;日本高分辨冷场发射扫描电镜日本日立公司。
1.2 实验方法
1.2.1 刺梨果渣固态发酵菌种筛选
1.2.1.1 培养基的配制 MRS 培养基、PDA 培养基、麦芽汁琼脂培养基、乳酸菌培养基、查氏琼脂培养基等均按照菌种说明书配制。
1.2.1.2 菌种的活化及扩大培养 将从中国工业菌种保藏管理中心购买的菌株枯草芽孢杆菌、绿色木霉、米曲霉、黑曲霉、植物乳杆菌、嗜热链球菌、平菇、灵芝按照相关说明进行活化处理,然后将活化的菌种转接至2~3 代恢复活力。
1.2.1.3 种子液的制备 将恢复活力后的菌株接种于液体摇瓶培养基中,按菌种说明书条件下培养,使其产生大量菌体,作为种子液。
1.2.1.4 刺梨果渣固态发酵菌种筛选 新鲜刺梨果渣:刺梨经国药集团同济堂(贵州)制药有限公司榨汁后得到的废弃物。
以新鲜刺梨果渣为培养基,选取食品发酵常用菌种枯草芽孢杆菌、绿色木霉、米曲霉、黑曲霉、植物乳杆菌、嗜热链球菌、平菇、灵芝分别进行单菌发酵,对比发酵后SDF/IDF,选取最优发酵菌种。
1.2.1.5 膳食纤维得率测定 参照郑佳欣[11]的酶-重量法,根据公式(1)~(4)测定膳食纤维(DF)、不溶性膳食纤维(IDF)、可溶性膳食纤维(SDF)得率。取干燥至恒重刺梨果渣1 g(m0),加入0.05 mol/L MESTRIS 缓冲液,磁力搅拌器使混合均匀。先后加入热稳定α-淀粉酶、蛋白酶及淀粉葡萄糖苷酶酶解,过滤,将沉淀先后经70 ℃热水、78 %乙醇、95 %乙醇和丙酮洗涤2 次,烘干,即得m1(IDF);上清液,加入4 倍体积95 %乙醇溶液(提前预热至60 ℃),室温下静置12 h,离心,收集沉淀,烘干,即得m2(SDF)。
1.2.2 刺梨果渣固态发酵工艺优化
1.2.2.1 单因素实验 接菌量对SDF/IDF 的影响:每个发酵瓶中加入刺梨果渣20 g,121℃灭菌30 min,发酵温度40 ℃,发酵时间4 d,考察发酵菌种接种量3%,6%,9%,12%,15%对SDF/IDF 的影响。
发酵温度对SDF/IDF 的影响:每个发酵瓶中加入刺梨果渣20 g,121 ℃灭菌30 min,发酵接菌量6%,发酵时间4 d,分别考察发酵温度25、30、35、40、45 ℃对SDF/IDF 的影响。
发酵时间对SDF/IDF 的影响:每个发酵瓶中加入刺梨果渣20 g,121 ℃灭菌30 min,发酵接菌量6%,发酵温度40 ℃,分别考察发酵时间2、3、4、5、6 d 对SDF/IDF 的影响。
1.2.2.2 响应面试验优化发酵工艺 在单因素实验基础上,利用软件Design-Expert 8.0.6 进行Box-Behnken 试验,设计三因素三水平试验,以发酵时间(A)、发酵温度(B)、接菌量(C)为自变量,SDF/IDF 为响应值,优化发酵工艺,设计因素与水平见表1。
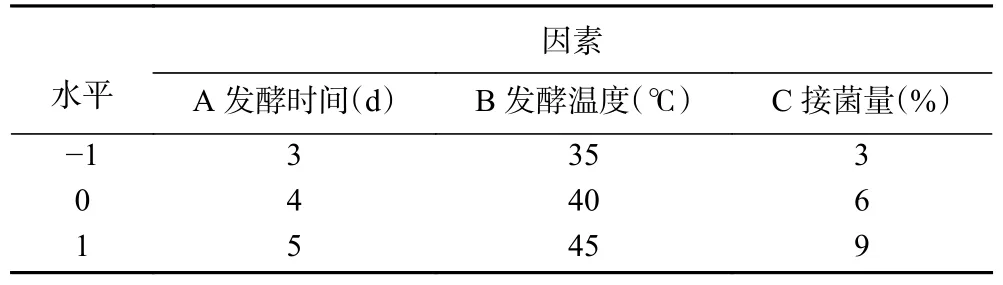
表1 Box-Behnken 试验因素水平Table 1 Factor levels of Box-Behnken experimental
1.2.3 膳食纤维理化性质分析
1.2.3.1 持水力的测定 取0.2 g 干燥DF,于15 mL离心管中,称其质量为m0,加入10 mL 蒸馏水,振荡摇匀,静置24 h,8000 r/min 离心10 min,弃掉上清液,称其质量为m1,根据下式计算持水力[12]:
1.2.3.2 膨胀力的测定 取0.25 g 干燥DF,于15 mL 试管中,记录体积为V0,加入10 mL 蒸馏水,振荡摇匀,静置24 h,记录其膨胀后体积V1,根据下式计算膨胀力[12]:
1.2.3.3 持油力的测定 取0.2 g 干燥DF,于离心管中,加入适量植物油,静置24 h,过滤,称湿质量(m1),根据下式计算持油力[12]:
1.2.4 膳食纤维的结构表征
1.2.4.1 电镜检测(SEM)将发酵前和发酵后的DF 干燥至质量恒定,取适量DF 于扫描电镜下观察其超微结构[9]。
1.2.4.2 傅里叶红外光谱分析(FT-IR)取适量DF 于研钵中,加入溴化钾,充分研磨,装入模具,制成薄片,放入仪器,分析扫描,扫描次数:32 次,分辨率:4 cm-1,扫描范围:500~4000 cm-1[13]。
1.2.4.3 X-射线衍射分析(XRD)取适量DF 于样品槽,用玻璃板压实样品,使表面平整,将载样板插入仪器测试底座,测试条件:加载电压40 kV,步宽0.02°,扫描速率4°/min,扫描角度10°~45°[14]。
1.3 数据处理
所有实验数据均平行测定3 次,采用SPSS 26.0 进行单因素方差分析,P<0.05 表示具有统计学意义、Design Expert 8.0.6、Jade 进行数据处理与分析,采用Origin 2021 b 进行作图。
2 结果与分析
2.1 固态发酵菌种对刺梨果渣SDF/IDF 的影响
由图1 可知,除黑曲霉外,其余菌种发酵刺梨果渣后均可使SDF/IDF 的比值升高,其中经枯草芽孢杆菌、米曲霉发酵后,SDF/IDF 显著增加(P<0.05 或P<0.01),说明枯草芽孢杆菌、米曲霉对刺梨果渣膳食纤维有较好的改性作用,且枯草芽孢杆菌的作用效果最显著,因此本研究选取枯草芽孢杆菌为固态发酵菌种。枯草芽孢杆菌具有生长温度范围宽、发酵时间短、菌体自身可合成纤维素酶等优势。张智等[15]采用甘蔗渣制备膳食纤维时,也以枯草芽孢杆菌为发酵菌种,提高了可溶性膳食纤维的得率,同时改善了膳食纤维的结构及理化性质。

图1 不同菌种对刺梨果渣SDF/IDF 的影响Fig.1 Effect of different bacterial strains on SDF/IDF of Rosa roxburghii pomace
2.2 单因素实验结果
2.2.1 接菌量对SDF/IDF 的影响 由图2 可知,SDF/IDF 随着接种量的增加呈先上升后下降趋势,下降后趋于平缓。当接菌量为6%时,SDF/IDF 达到最高为14.71%。当接菌量低于6%时,可能由于菌种量较少导致发酵不彻底,不能将植物细胞壁的致密结构完全破坏,使得SDF 的积累量较少;当接菌量高于6%时,SDF/IDF 呈下降趋势,可能是因为接种量过大,使得菌种生长繁殖旺盛,导致底物营养物质供应不足,开始逐渐消耗积累的SDF,造成SDF/IDF 下降[16-17]。

图2 接菌量对刺梨果渣SDF/IDF 的影响Fig.2 Effect of bacterial inoculation on SDF/IDFof Rosa roxburghii pomace
2.2.2 发酵温度对SDF/IDF 的影响 由图3 可知,随发酵温度的增加SDF/IDF 呈先上升后下降趋势。发酵温度为40 °C时,SDF/IDF 达14.58%。当发酵温度低于40 °C时,可能是因为环境温度达不到菌种适宜生长温度,生长代谢较慢,产生纤维素酶较少,导致SDF 积累量少,使得SDF/IDF 降低;当发酵温度超过40 ℃时,可能培养基中水分挥发较快,水分减少,影响菌种的生长,或者由于超过菌种适宜的生长温度,在一定程度上抑制菌种的生长以及纤维素酶的活性[18],使得SDF/IDF 降低,故最佳发酵温度为40 ℃。
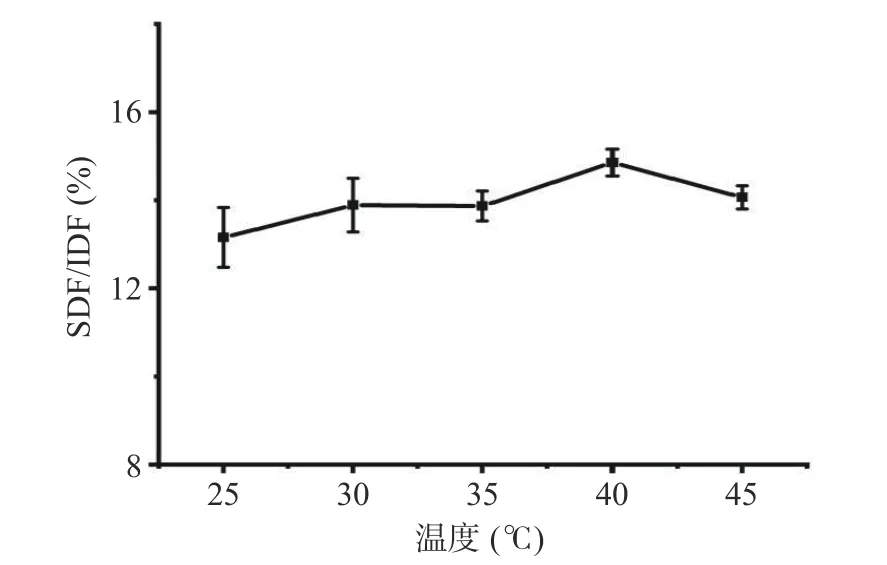
图3 温度对刺梨果渣SDF/IDF 的影响Fig.3 Effect of temperature on SDF/IDF of Rosa roxburghii pomace
2.2.3 发酵时间对SDF/IDF 的影响 由图4 可知,随着发酵时间的延长,SDF/IDF 先上升后下降。发
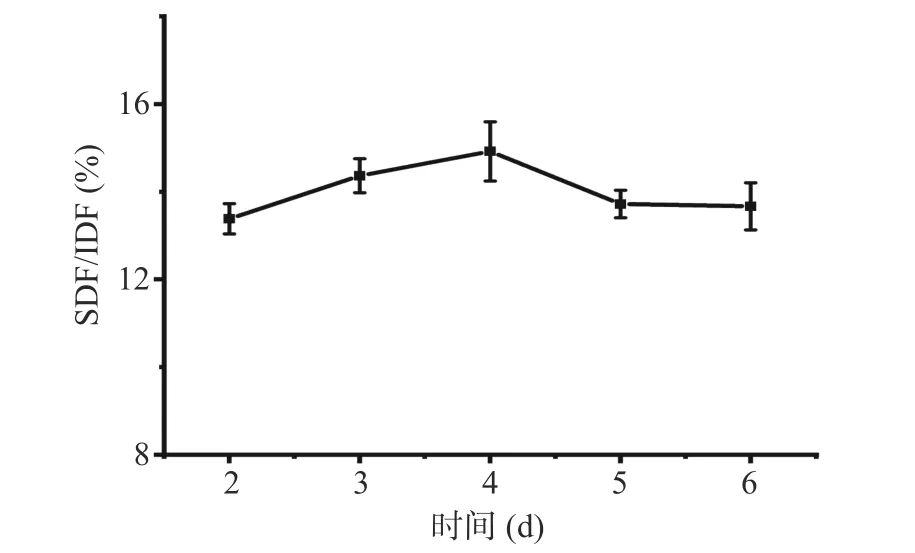
图4 发酵时间对刺梨果渣SDF/IDF 的影响Fig.4 Effect of fermentation time on SDF/IDF of Rosa roxburghii pomace
酵时间为4 d 时SDF/IDF 达14.92%。当发酵时间小于4 d 时,可能是因为发酵时间过短,菌种数量较少,发酵不完全,也可能是因为发酵时间过短不利于纤维素酶的合成;当发酵时间高于4 d 时,可能是因为生成了一些不利于菌体生长的物质,致使菌种活性降低,产生酶减少,也可能是生长到一定阶段后,基质被消耗,培养基中的养分不足以维持其生长,生成的SDF 被分解成糖类[19],进而使其SDF/IDF 降低,故最佳发酵时间选择为4 d。
2.3 响应面试验结果
2.3.1 响应面试验设计与结果 在单因素实验的基础上,运用Box-Behnken 试验设计原理,以接种量、发酵温度、发酵时间为自变量,以SDF/IDF 为响应值,进行三因素三水平试验,结果见表2。以Design Expert 8.0.6 对数据进行分析,得到A、B、C 与Y 二次回归方程:Y=14.32+0.005A+0.46B+0.33C-0.31AB+0.66AC-0.81BC-1.25A2-1.37B2-0.41C2。由 表3 可知,P=0.0033<0.01,说明模型极显著。失拟项P=0.0767>0.05,失拟项不显著,表明该模型拟合度较好。模型的决定系数R2=0.9261,调整决定系数R2adj=0.8310,表明该模型试验值与预测值间相关性较高,有83.10%实际数据能用于模型解释;F值越大,反映因素对响应值的影响越大,由此可知各因素对刺梨果渣中SDF 与IDF 的比值影响大小次序为发酵温度(B)>接种量(C)>时间(A);一次项B 差异显著(P=0.0411<0.05),A(P=0.9791)和C(P=0.1181)差异不显著(P>0.05);交互项AB(P=0.2773>0.05)差异不显著、AC(P=0.0399)、BC(P=0.0172)均差异显著(P<0.05);二次项A2(P=0.0017)和B2(P=0.001)差异极显著(P<0.01),C2(P=0.1481>0.05)差异不显著。
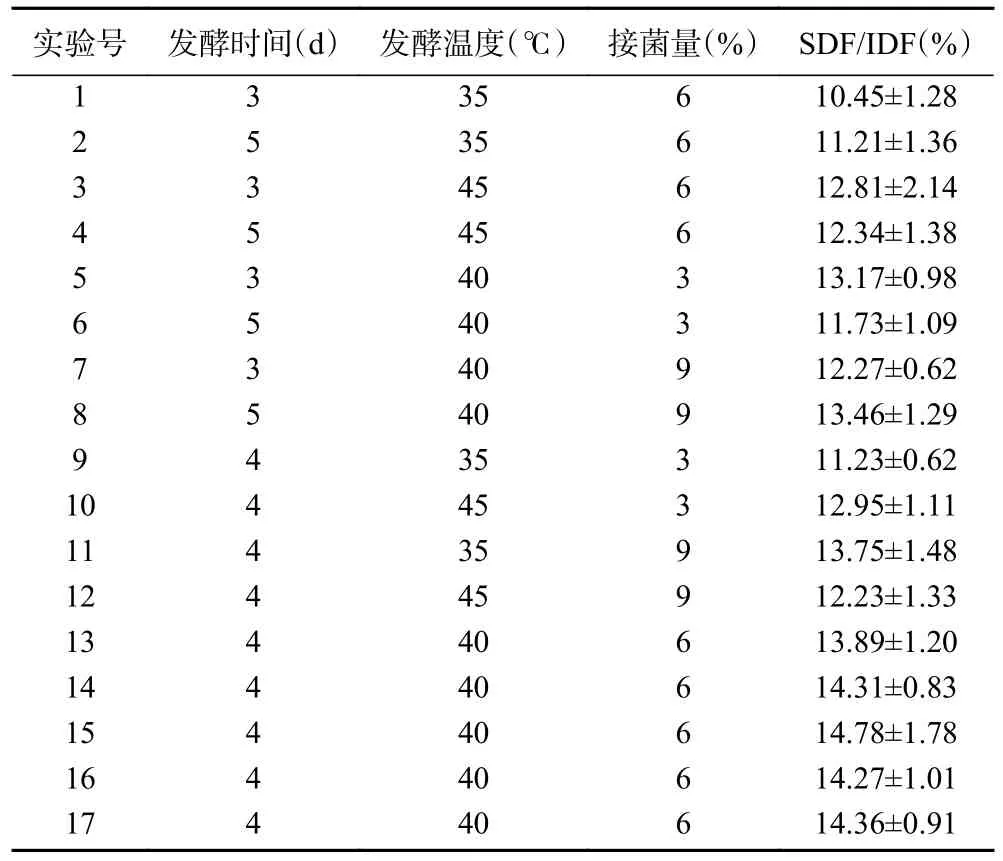
表2 Box-Behnken 试验与响应值结果Table 2 Results of Box-Behnken test and response values

表3 方差分析表Table 3 Analysis of variance
2.3.2 响应曲面分析 表3 显示,FAB<FAC<FBC,根据F值可知发酵时间与温度的交互作用对刺梨果渣SDF/IDF 的干扰最小,而接菌量与温度的交互作用对刺梨果渣SDF/IDF 的干扰最大。在响应面图中,等高线的形状为圆形时表示各因素之间的交互作用不显著,若为椭圆形则表示交互作用显著[20]。图5是各因素之间交互作用的三维响应面图和等高线图,AB 等高线形状为圆形,应曲面坡度不大,说明两因素间交互作用对刺梨果渣中SDF/IDF 的影响显著性不大;从AC 等高线图得知,等高线为椭圆形,表明两者的交互作用显著,沿发酵时间轴向等高线的变化密集,沿接菌量轴向等高线的变化稀疏,说明时间比接菌量更能影响刺梨果渣SDF/IDF;BC 等高线图近似椭圆形表明两者的交互作用显著,从等高线图得知,沿接菌量轴向等高线的变化密集,沿发酵温度轴向等高线的变化稀疏,说明接菌量比发酵温度更能影响SDF/IDF。

图5 各因素交互作用对刺梨果渣 SDF/IDF 影响的响应面图Fig.5 Response surface graph of the interaction of various factors on SDF/IDF of Rosa roxburghii pomace
2.4 最佳提取条件的预测和验证
经Design-Expert 8.0.6 软件分析,最佳发酵工艺为:发酵时间4.13 d,发酵温度40.03 ℃,接菌量7.48%。从实际操作角度考虑,对最佳发酵条件调整为:发酵时间4 d,发酵温度40 ℃,接菌量7.5%。验证试验测得刺梨果渣SDF/IDF 为14.21%±0.42%;说明此响应面法优化得到的刺梨果渣发酵工艺准确可靠。
2.5 刺梨果渣发酵前后膳食纤维理化性质分析
由表4 可知,发酵后刺梨果渣的膳食纤维持水力、持油力及膨胀力均高于未发酵组,表明发酵后刺梨果渣膳食纤维的理化性质发生了改变,在持水、持油及膨胀性方面都有所提升。此结果与Wang 等[13]的报道相似,这可能与膳食纤维结构改善有关,发酵后膳食纤维结构变得疏松,比表面积增大,使得纤维素与半纤维素中暴露出更多的亲水基团,产生SDF比例增多,持水性增强,同时改善其膨胀性[21-22]。

表4 发酵前后刺梨果渣DF 理化分析Table 4 DF physicochemical analysis of Rosa roxburghii pomace before and after fermentation
2.6 刺梨果渣发酵前后膳食纤维结构表征
2.6.1 扫描电子显微镜分析 如图6 所示,在相同倍率下对比刺梨果渣发酵前后显微图,UF-DF 表面光滑,有少量褶皱,呈现致密、规则结构;F-DF 表面出现裂纹,比表面积增大,有颗粒物附着且结构较疏松,呈片状可能是由于发酵产生了纤维素酶并对纤维素进行了降解,改善了微观结构,疏松的结构有利于膳食纤维样品的水化和提高其吸附性能,因此,推测FDF 结构的改变,是导致其持水力、持油力和膨胀力增加的主要原因[23-26]。

图6 刺梨果渣膳食纤维扫描电子显微镜图Fig.6 Scanning electron microscopy images of dietary fiber from Rosa roxburghii pomace
2.6.2 傅立叶红外光谱分析 由图7 可知,发酵前后DF 在吸收峰上没有明显变化,仅在吸收强度上存在微小差异,3423 cm-1处出现的吸收峰,可能是由于半纤维素和纤维素-OH 基团的振动引起,氢键在分子间形成,F-DF 在此处吸收强度比UF-DF 强,说明经过发酵处理DF 糖苷键断裂,合成氢键的羟基增多,导致内部缔合的氢键较多[6]。2922 cm-1出现较弱吸收峰,表明-CH 和-CH2基团存在,是纤维素的典型结构[27]。1739 cm-1处出现的峰可能是醛或酯中C=O 的特征峰,半纤维素的乙酰基和糖醛酸酯基的伸展。1603 cm-1处出现的峰可能是羰基吸收峰,由C=O 键伸缩振动引起,表明其中可能存在糖醛酸[28]。1246~1427 cm-1处的峰与C-H 的变角振动有关,说明样品中可能含有木质素,发酵后DF 吸收强度减小,这表明可能发酵后DF 中木质素含量减少[29]。1035 cm-1的峰是C-O 的伸缩振动,通常报道为阿拉伯糖和木聚糖[13]。综上,F-DF 的红外谱图相较于UF-DF 都有特征吸收峰,仅有部分波长对应吸收强度的差异,表明官能团基本相似,并未产生新的官能团,它们的亲水性基团和其他活性基团在发酵过程中没有发生变化。
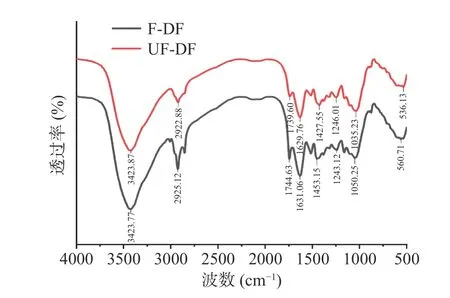
图7 发酵前(UF-DF)和发酵后(F-DF)刺梨果渣膳食纤维傅里叶红外光谱图Fig.7 Fourier transform infrared spectroscopy of dietary fiber before fermentation (UF-DF) and after fermentation (F-DF) ofRosa roxburghii pomace
2.6.3 X 射线衍射分析 纤维素晶体结构分为纤维素I-V 5 种结晶构型[30]。图8 为刺梨果渣 DF 发酵前后的XRD 图,可以看出2θ在15.34°和22.09°时有明显的结晶衍射峰,且在34.65°处有一个较弱的衍射峰,是纤维素I 的典型晶体构型[31],发酵前后膳食纤维衍射峰的位置没有改变,只有衍射强度差异,这表明发酵并未使膳食纤维的结晶构型发生显著性改变。经Jade 7.0 软件拟合后发现,F-DF 相对结晶度为28.25%,UF-DF 相对结晶度为36.83%,相对结晶度降低了8.58%,说明发酵处理使纤维素和半纤维素发生降解,破坏了晶体结构,导致结晶度减小[32];聚合力降低,使这些结构组分溶出或转化为水溶性成分溶出,导致刺梨果渣DF 的功能特性的变化[16]。
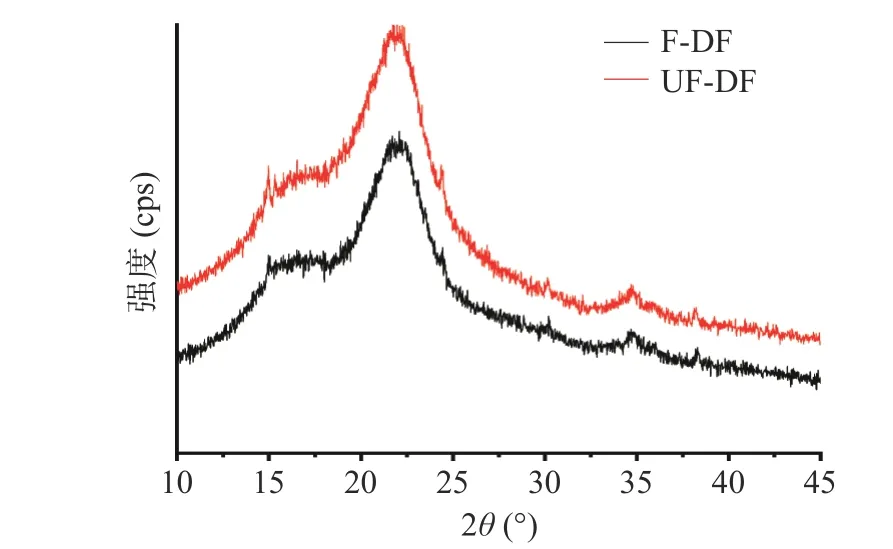
图8 发酵前(UF-DF)和发酵后(F-DF)刺梨果渣膳食纤维X-射线衍射光谱Fig.8 X-ray diffraction spectra of dietary fiber before fermentation (UF-DF) and after fermentation (F-DF) ofRosa roxburghii pomace
3 结论
本研究以刺梨果渣为原料,以枯草芽孢杆菌为菌种进行固态发酵改性膳食纤维,设计单因素实验与响应面法优化发酵工艺,研究发酵时间、温度及接菌量对SDF 与IDF 的比值影响,得出刺梨果渣最佳发酵工艺为:发酵时间4 d,发酵温度40 ℃,接菌量为7.5%,该条件下SDF 与IDF 的比值为14.21%±0.42%;分析发酵前后膳食纤维理化性质,发现刺梨果渣发酵后膳食纤维持水力、持油力及膨胀力有所提高;对发酵前后膳食纤维进行扫描电镜、红外光谱及X-射线衍射分析,电子扫描电镜结果显示,发酵后DF 结构疏松,表面有颗粒附着,比表面积增大,呈片状,表明发酵处理使刺梨果渣膳食纤维结构发生改变;在发酵前后FT-IR 谱图中没有出现新的峰,也没有出现明显峰的位置与数目变化,这表明并未产生新的化学基团,谱图中只存在强度的微小差异,说明是分子内基团数目有所变化,其中1427 cm-1处吸收强度减弱,因此,推测发酵使得刺梨果渣中木质素减少;XRD 测定发现,发酵并未改变刺梨果渣I 型纤维素的晶体特征,但相比发酵前相对结晶度减弱,这可能是原料中纤维素发生降解,纤维的结晶区和非结晶区被破坏所导致。因此,刺梨果渣经枯草芽孢杆菌固态发酵后,可使SDF/IDF 升高,且改善了膳食纤维的理化性质及结构特性。
发酵后刺梨果渣膳食纤维持水力、持油力、膨胀力增强,饱腹感增加;结构疏松,入口更加柔软,促进肠道蠕动,使其成为优质膳食纤维的制备原料,可提高刺梨果渣的利用率,为刺梨果渣的有效利用提供了依据,减少了资源浪费。本研究用单一菌种枯草芽孢杆菌发酵刺梨果渣来改性膳食纤维,但并未研究多菌种混合发酵,有待进一步研究混合菌种发酵对SDF/IDF 的影响;除研究刺梨果渣发酵后膳食纤维变化情况外,今后还应对维生素C、黄酮、SOD 等成分的变化进行分析,以期对发酵后的刺梨果渣资源进行科学评价。

