超声辅助提取芒果核中芒果苷的工艺优化
朱芙蓉,王霜秀,毛德源,韦 澳,刘韦清
(南宁学院食品与质量工程学院,广西南宁 541699)
芒果(Mangifera indicaL.)是漆树科的“水果之王”,在热带地区广受欢迎,由于其特有的营养、经济、药用和植物化学特性,被广泛生产。中国是世界第七大芒果种植国,年产量约106.18 万吨,种植面积13.31 万公顷[1]。芒果核占果实的15%~30%,是芒果加工的主要副产物之一。在食品加工业中,芒果核通常被丢弃或用作饲料,造成极大的浪费和环境污染。研究发现芒果中富含芒果苷物质、类黄酮、酚酸等生物活性化合物,可用于功能性食品生产[2]。从芒果副产物中提取芒果苷类化合物,对提高芒果附加值,资源再生具有重要意义。
芒果苷(mangiferin,MG)是一种在芒果中发现的天然葡萄糖基氧杂蒽酮,其结构由氧杂蒽酮的苷元和1 个葡萄糖以糖苷键的形式相连而成。由于其强大的药理活性,包括保肝、抗癌、抗糖尿病以及抗单纯疱疹病毒和脊髓灰质炎病毒的抗病毒作用,受到研究人员的广泛关注[3-5]。作为芒果中的主要活性化合物之一,芒果苷主要来自芒果皮和芒果核。芒果核因其高含量的芒果苷而备受关注,成为潜在的芒果苷来源。然而,从芒果核中提取芒果苷是一项具有挑战性的过程,主要是由于存在复杂的基质和化合物在水溶液中的溶解度较差。因此,开发一种高效、全面的技术从芒果核中提取芒果苷对于满足食品和制药产业对该化合物不断增长的需求至关重要。
与传统提取方法相比,超声提取是最廉价、快速、简单和高效的技术之一[6]。由于其较高重现性、适用于各种样品大小、具有提取时间短、溶剂用量少和提取率高等优点[7-9]。超声提取法与极性有机化合物的结合可显著提高提取效率,已广泛应用于天然产物活性化合物的提取[10]。超声增强的机制主要归因于声波传播时空化气泡的行为,这些气泡的空化会产生化学、物理和机械效应[11],从而导致材料基质的破坏,促进可提取化合物的释放并增强溶剂向样品中的传质,增加目标化合物从基质到溶剂的释放[12]。Gao等[13]通过比较超声波辅助提取、25 ℃溶剂提取、热提取和索氏回流提取对雪莲中黄酮类化合物提取率影响,发现超声波辅助提取比传统方法具有更加高效和简单的优势。Ruiz-Montañez 等[14]报道了超声波提取在室温下进行短时间提取不改变芒果苷化合物生物活性,是从Ataulfo 和Autochthonous 芒果果肉和果皮中获得芒果苷最高收率的方法。因此,寻找超声辅助乙醇法提取芒果核中芒果苷的最佳工艺条件具有重要意义。
本研究使用三水平四因素(料液比、超声功率、提取温度和提取时间)Box-Behnken 响应面设计(Box-Behnken Response Surface Design,BBD)研究和优化芒果核中芒果苷提取条件,为开发芒果副产物提供理论参考。
1 材料与方法
1.1 材料与仪器
芒果核 成熟金煌芒,产地为中国广西百色市右江区,将芒果核清洗干净并晒干至水分含量约为9%,然后将干燥的芒果核用磨粉机研磨成粉末并储存在冰箱中的密封容器中,4 ℃冷藏保存;芒果苷标准品(HPLC≥98%)、无水乙醇 分析纯,博美生物科技有限公司;75%乙醇、95%乙醇 分析纯,天津市富宇精细化工有限公司;目筛40 目 绍兴市上虞圣超仪器设备有限公司。
SB-5200DTD 超声波清洗机 宁波新芝生物科技股份有限公司;INESA 紫外可见分光光度计 上海仪电分析仪器有限公司;DHG-9240 电热恒温鼓风干燥箱 上海鸿都电子科技有限公司;FA2204N 分析天平(MAX:220 g d=0.1 mg)上海精若科学仪器有限公司;HBS-2500C 粉碎机 东莞市华太电器有限公司。
1.2 实验方法
1.2.1 芒果核中芒果苷含量测定方法的建立
1.2.1.1 芒果核的处理及总芒果苷提取液的制备选取无虫、无病害的芒果核仁,洗净后置于电热恒温鼓风干燥箱中烘干后粉碎,用40 目筛子过筛,备用。
精密称取芒果核粉末1.00 g 于150 mL 具塞三角瓶中,加入40 mL 75%乙醇,在温度为50 ℃、功率为288 W 的条件下超声50 min,过滤,用75%乙醇定容至50 mL,用75%乙醇稀释50 倍,即为样品待测液。
1.2.1.2 标准溶液的制备 精密称取20.00 mg 芒果苷对照品,用无水乙醇溶解并定容至100 mL,得到200 μg/mL 的标准液。
1.2.1.3 线性关系考察 精确称取芒果苷对照品20.00 mg,用无水乙醇溶解并定容至100 mL,摇匀,得到200 μg/mL 的芒果苷标准品储备液,用移液管分别准确移取0.5、1.0、2.0、3.0、4.0、5.0 mL 置于50 mL 容量瓶中,并用无水乙醇定容,摇匀,得到浓度为2.0、4.0、8.0、12.0、16.0、20 μg/mL 的芒果苷对照品溶液。于波长319 nm 处测定吸光度,以吸光度对浓度绘制标准曲线并进行线性回归分析。
芒果核中芒果苷提取率的计算如下:
式中:Y 是芒果苷提取率,%;C 是样品液中芒果苷质量浓度,mg/mL;V 是样品液体积,mL;d 是样品浓度稀释倍数;M 是芒果核仁粉末的质量,g。
1.2.1.4 重复性实验 参考赵东兴等[15]的方法略做修改。分别准确称取6 份1.00 g 的芒果核仁粉末,按照1.2.1 的提取条件处理样品,在319 nm 波长下平行测定其芒果苷含量,计算相对标准偏差(RSD%),观察测定方法及仪器的重复性。
式中:S 是吸光值的标准差;X 是所测吸光值的平均值。
1.2.1.5 精密度实验 参考赵东兴等[15]的方法略做修改。分别准确称取6 份1.00 g 的芒果核仁粉末,按照1.2.1 的提取条件处理样品,在319 nm 波长下分别重复测定其芒果苷含量6 次,采用公式(2)计算相对标准偏差(RSD%),观察测定方法及仪器的精密度。
1.2.1.6 稳定性实验 参考赵东兴等[15]的方法略做修改。准确称取1 份1.00 g 的芒果核仁粉末,按照1.2.1的提取条件处理样品,在319 nm 波长下在0、20、40、60、80、100 min 取样测定其吸光度,分别测6 次,观察溶液中芒果苷是否保持稳定,从而确定其有效测定时间范围。
1.2.1.7 加标回收率实验 参考赵东兴等[15]的方法略做修改。分别准确称取6 份1.00 g 已知芒果苷含量的样品,分别加入2.00 mg 芒果苷对照品,按照1.2.1的提取条件处理样品,在319 nm 波长下分别测定其芒果苷含量,计算回收率。
式中:X1是加标试液测定量,g;X2是样品中芒果苷含量,g;m 表示加标量,g。
1.2.2 单因素实验 在预实验的基础上,以芒果核中芒果苷提取率为实验指标,采用1.2.1.1 实验方法,对料液比、乙醇浓度、超声时间、超声温度和超声功率5 个因素进行单因素实验。其中料液比分别设1:20、1:30、1:40、1:50、1:60 g/mL5 个水平;乙醇浓度分别设55%、65%、75%、85%、95% 5 个水平;超声温度分别设30、40、50、60、70 ℃ 5 个水平;超声时间分别设30、40、50、60、70 min 5 个水平;超声功率分别设216、252、288、324、360 W 5 个水平。结果均为3 次重复实验平均值。
1.2.3 响应面试验设计 在单因素实验的基础上,以芒果苷提取率(Y)为响应值,选取液料比(A)、乙醇浓度(B)、提取温度(C)和提取时间(D)4 个自变量,通过Design Expert®13.0 版软件Box-Behnken 优化芒果苷提取的最佳条件,设计四因素三水平共27 组试验。随后对实验结果进行回归拟合,建立数学模型,进行方差分析和P值显著性检验,预测最优条件。表1 列出了自变量及对应编码水平。
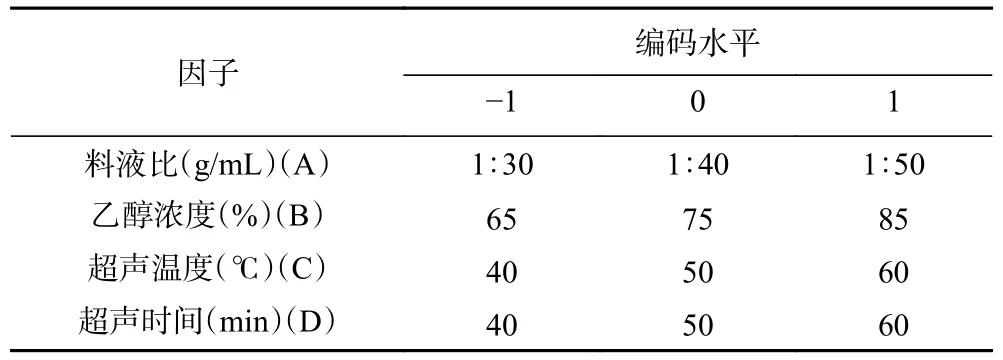
表1 响应面试验的因素水平设计Table 1 Factor level design for response surface testing
1.3 数据处理
每个实验至少重复3 次,数据表示为平均值±标准偏差(n=3)形式。数据经IBM SPSS statistics 22.0软件进行显著性分析,通过BonferroniT检验,在95%置信水平下显著(P<0.05)。响应面数据由Design Expert®13.0 软件分析,使用Origin 8.5 软件绘图。
2 结果与分析
2.1 芒果苷含量测定标准曲线结果
测定不同质量浓度芒果苷对照溶液在319 nm处的吸光值,以浓度为横坐标,吸光度值为纵坐标,得到芒果苷标准曲线,并拟合得到线性方程:y=0.0377x+0.0003,R2=0.9999。在0~20 mg/L 范围内,芒果苷质量浓度与吸光值呈良好的线性关系,说明使用该曲线测定待测样品的芒果苷含量具有较高的准确性,可用于芒果苷的测定。
2.2 重复性试验结果
在319 nm 波长下测定6 个样品中芒果苷的提取率,结果分别为4.77%、4.7%、4.79%、4.75%、4.77%、4.74%,平均值为4.75%,RSD%为0.69%。RSD%越小,说明相对误差越小,结果越可靠。通常认为,当RSD%小于2%时,结果的重复性较好。因此,该实验结果表明该测定方法具有良好的重复性,可以在该波长下准确测定芒果苷的提取率。
2.3 精密度试验结果
在319 nm 波长下分别测定6 个样品中芒果苷提取率,结果分别为4.76%、4.76%、4.79%、4.78%、4.77%、4.81%,平均值为4.78%,相对标准偏差(RSD%)为0.43%,表明各平均值之间的离散程度较小,方法的精密度较高。适用于芒果苷提取率的测定。
2.4 稳定性试验结果
在319 nm 波长下分别测定6 个样品中芒果苷提取率,结果分别为4.76%、4.77%、4.77%、4.77%、4.78%、4.78%,平均值为4.77%,RSD%为0.12%,结果表明由此表明该方法具有较好的稳定性,数据的变异较小,可靠性较高。
2.5 加标回收率试验结果
回收率是评价分析方法精密度和准确度的重要指标之一,通常回收率越高表示分析方法越可靠和精确。根据表2 提供的实验结果可知,使用加标回收率作为评价指标来评估该方法的准确性和可靠性。该方法的加标回收率在98.84%~100.40%,与赵东兴等[15]超声辅助萃取芒果叶中芒果苷含量加标回收率92.80%~103.72%一致。属于比较理想的回收率水平,表明该方法具有较高的准确性和可重复性,可用于芒果核中芒果苷的测定。
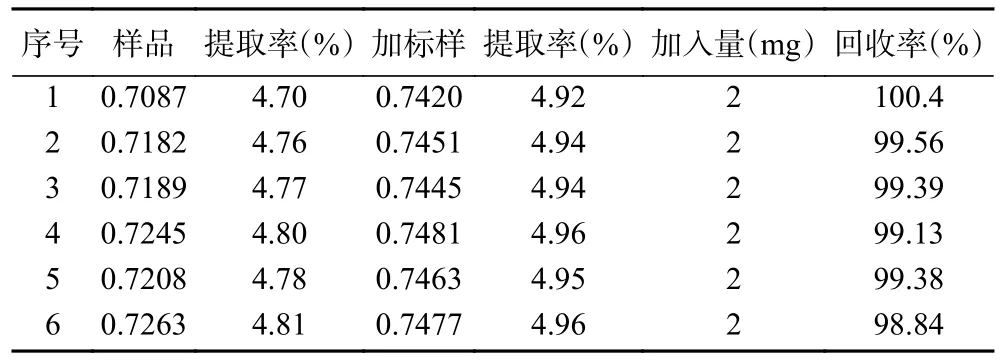
表2 加标回收率实验结果Table 2 Results of spiked recoveries
2.6 芒果苷提取工艺的单因素实验结果
2.6.1 不同料液比对芒果核芒果苷提取率的影响料液比是提取过程中需要优化的重要参数之一。为探究不同料液比对芒果核芒果苷提取率的影响,选择1:20~1:60 g/mL 料液比进行试验。由图1 可知,当料液比为1:20~1:40 g/mL 时,芒果苷的提取率随着料液比的增加而增加。这可能是由于溶剂越多,物料与溶剂的接触面积越大,芒果苷可以从材料中充分溶出。而当料液比为1:40~1:60 g/mL 时,尽管使用较低的料液比时,芒果苷的扩散速率会加快,提取率却随着溶剂量的增加而降低,主要原因是超声能力密度分布减少,从而阻碍了芒果苷的溶解,进而对提取率产生了负面影响[16]。因此选择料液比为1:40 mL/g进行后续响应面优化试验。
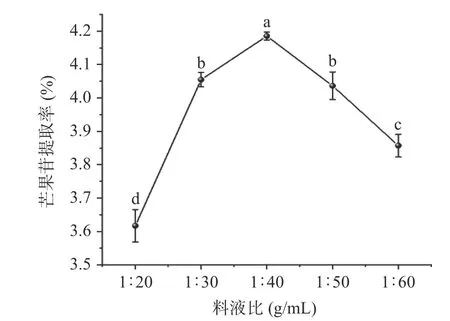
图1 料液比对芒果苷提取率的影响Fig.1 Effect of material-liquid ratio on the extraction rate of mangiferin
2.6.2 不同乙醇浓度对芒果核芒果苷提取率的影响
溶剂浓度在提取芒果苷提取率方面起着重要的作用。由图2 可知,探究不同乙醇浓度对芒果苷提取率的影响,选择55%~95%乙醇浓度进行试验。当乙醇浓度从55%增加到75%时,提取率从2.94%显著提高到4.62%(P<0.05),可能是由于乙醇溶液浓度提高,能有效增强芒果苷溶解作用。而当乙醇浓度超过75%时,芒果苷提取率呈现降低趋势,可能是因为芒果核中其他醇溶性杂质浸出的比例升高,降低了芒果苷的溶解[17]。且以乙醇作为溶剂,有利于芒果苷的溶解和提取,但其对细胞膜的破坏作用较水大,且随着乙醇体积分数的增加其破坏作用更明显[18]。因此,选择乙醇浓度为75%进行后续响应面优化试验。
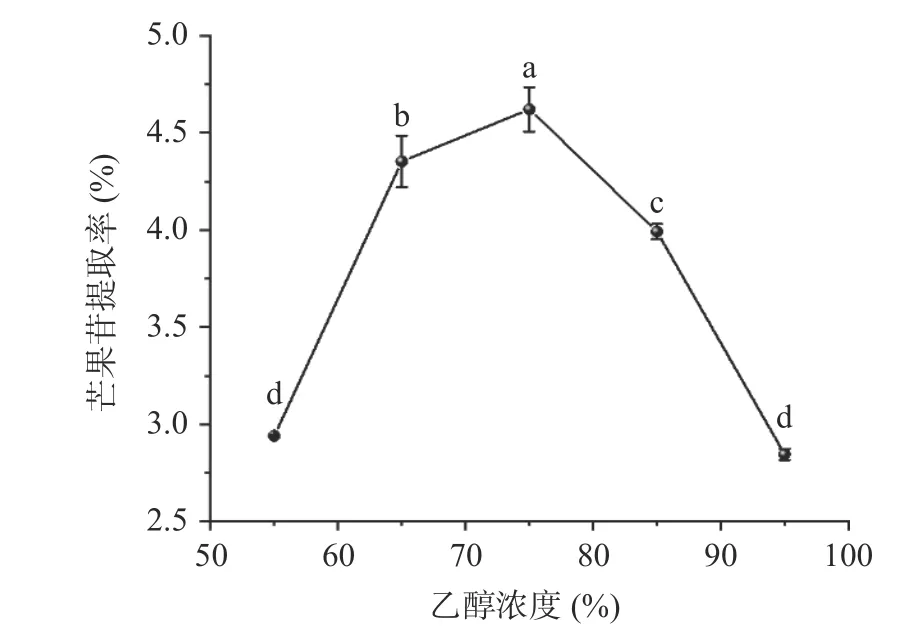
图2 乙醇浓度对芒果苷提取率的影响Fig.2 Effect of ethanol concentration on the extraction rate of mangiferin
2.6.3 不同超声温度对芒果核芒果苷提取率的影响
高温促进芒果苷类化合物的降解反应,提高芒果苷的提取率。因此,研究超声温度产生的两种相反作用对芒果苷提取的影响具有意义。由图3 结果可知,随着温度从30 ℃增加至50 ℃,提取率从3.94%提高到4.66%,这是由于超声的空化效应和热效应所致。空化效应的作用是通过相对较大的力促进提取物的碰撞,使空化核破裂并破坏材料的结构,使空化气泡和空腔内爆[19]。溶剂的蒸气压随着温度的升高而升高,蒸气压对空化的发生和空化强度有很大的影响。在较低的温度下,蒸气压较低,由于空化阈值高,超声产生的空化气泡很少,当气泡以相对大的力量爆炸,会增大物料提前破坏的几率。热效应可能会导致物料结构膨胀和松散,增加溶剂向介质中的扩散性,增强芒果苷在周围介质中的解吸和溶解度,从而增加细胞内产物向溶剂中的传质[19]。此外,溶剂在较高温度下具有更强的溶解能力,随着溶剂移动得更快,其暴露面积增加,最终萃取效率更高。超过50 ℃时,溶剂的表面张力和黏度降低,可改变超声的空化特性,传质强度增加,提取率反而下降。此外由于乙醇本身易挥发,温度过高,乙醇浓度降低,导致提取率骤降。因此,选择超声温度为50℃进行后续响应面优化试验。
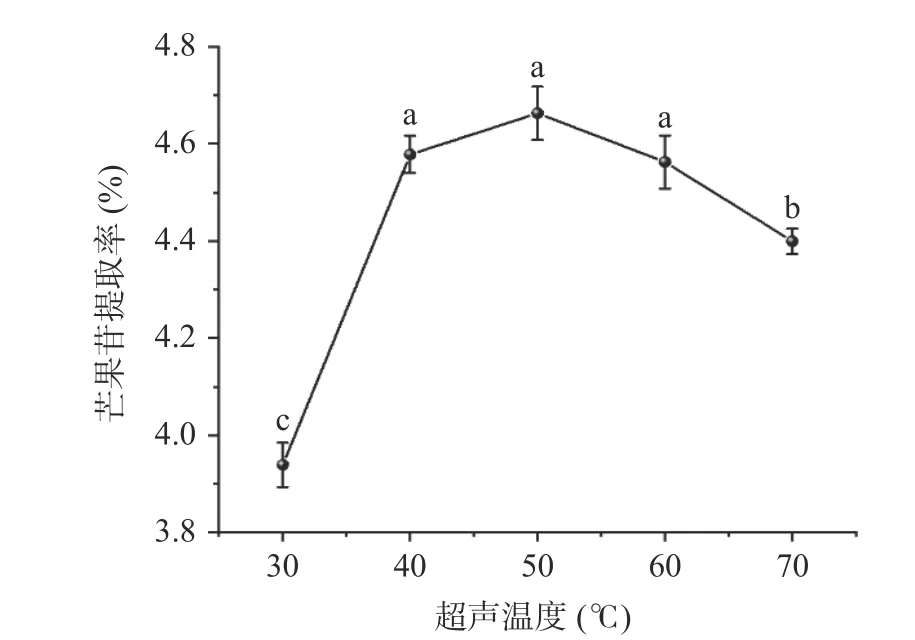
图3 超声温度对芒果苷提取率的影响Fig.3 Effect of ultrasonic temperature on the extraction rate of mangiferin
2.6.4 不同超声时间对芒果核芒果苷提取率的影响
图4 结果表明,超声时间对芒果苷提取率的影响先上升后下降。超声50 min 时,芒果苷提取率达到峰值,为4.67%。这是由于超声波的空化效应会加速溶胀和水化,导致物料的孔隙扩大,暴露在提取溶剂中的细胞数量增加,并进一步导致物料基质表面的破坏和溶剂的渗透[20]。因此芒果苷更容易从物料中释放到溶剂中,增大了提取效率。而当超声时间延长到50 min 之后,芒果苷提取率开始下降。这是由于长时间的超声处理,产生热效应破坏,分解了芒果苷的结构,从而降低了芒果苷的提取率。

图4 超声时间对芒果苷提取率的影响Fig.4 Effect of ultrasonic time on the extraction rate of mangiferin
2.6.5 不同超声功率对芒果核芒果苷提取率的影响
研究了不同超声功率对芒果苷提取率的影响,结果表明,当超声功率在216~288 W 范围时,芒果苷提取率随着超声功率的增大而增加,超声功率为288 W时,芒果苷提取率达到峰值,为4.58%(图5)。这是因为超声处理在提取介质中形成膨胀-压缩循环,从而刺激细胞壁的破裂,促进通过微射流形成和声流洗出细胞内容物[21-22]。因此超声功率的输入越高,通过液体介质的超声波振幅越大,产生空化效应引起物料膨胀、溶剂的吸收和物料孔隙扩大,物料的空腔塌陷越剧烈,从而获得更高的提取率。然而当超声功率超过288 W 时,超声空化观察会产生更多的气泡并破裂,从而影响超声能力传输到介质中的效率,降低芒果苷的提取率[23]。
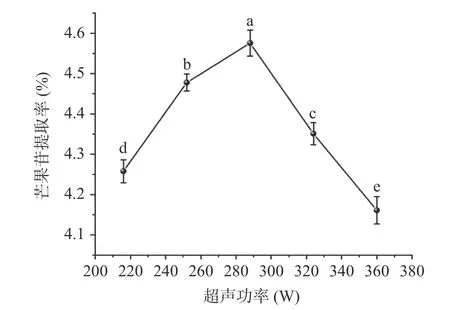
图5 超声功率对芒果苷提取率的影响Fig.5 Effect of ultrasonic power on the extraction rate of mangiferin
2.7 响应面法优化芒果苷提取工艺
2.7.1 响应面试验分析 根据单因素实验结果,选取料液比(A)、乙醇浓度(B)和超声温度(C)和超声时间(D),采用Box-Behnken 模型进行四因素三水平的设计优化实验。以芒果苷提取率为响应值,各因素及水平见表3。
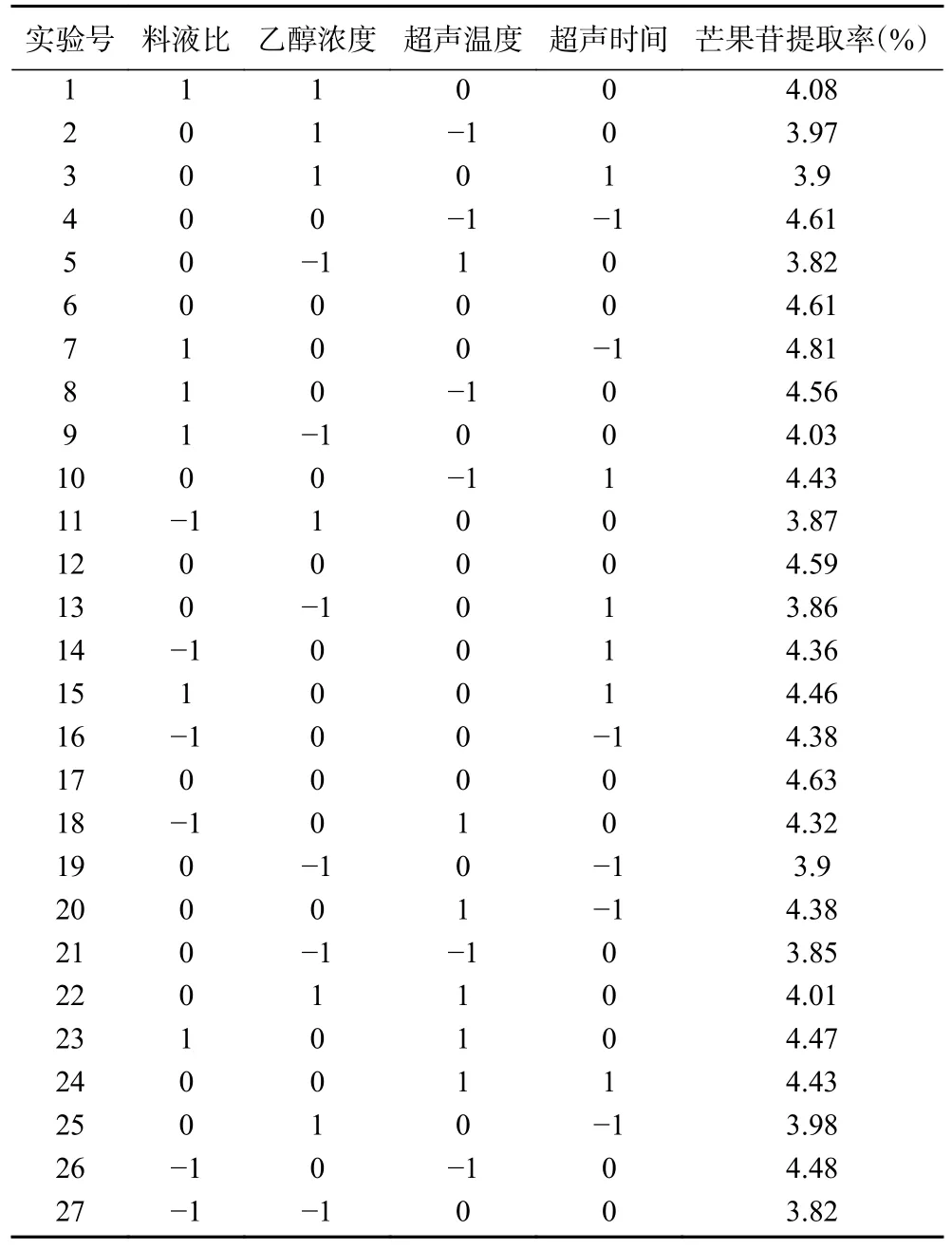
表3 响应面试验设计与结果Table 3 Response surface experimental design and results
根据Design Expert®13 软件对表3 中数据进行多元回归拟合分析。以料液比(A)、乙醇浓度(B)和超声温度(C)和超声时间(D)为自变量,芒果苷提取率为响应值。回归方程为:y=4.61+0.0983A+0.0442B-0.0392C-0.0517D+0.0175AC-0.0825AD+0.0175BC-0.0100BD+0.0575CD-0.0492A2-0.6174B2-0.0879C2-0.0667D2。
2.7.2 响应面回归模型方差分析 通过Design Expert®13.0 软件进行方差分析,结果见表4。由方差结果可知,线性回归方程差异极显著(P<0.0001),所有自变量包括:料液比(A)、乙醇浓度(B)、超声温度(C)和超声时间(D)显著影响芒果苷的提取率(P<0.05),料液比(A)和超声时间(D)之间存在显著交互作用(P<0.05)。此外乙醇浓度(B),超声温度(C)和超声时间(D)的二次项对芒果苷的提取率影响显著(P<0.05)。其余因素对芒果苷提取率影响不显著。根据F值和P值的大小分析,试验范围内各因素对芒果苷提取率影响大小为A(料液比)>D(超声时间)>B(乙醇浓度)>C(超声温度)。
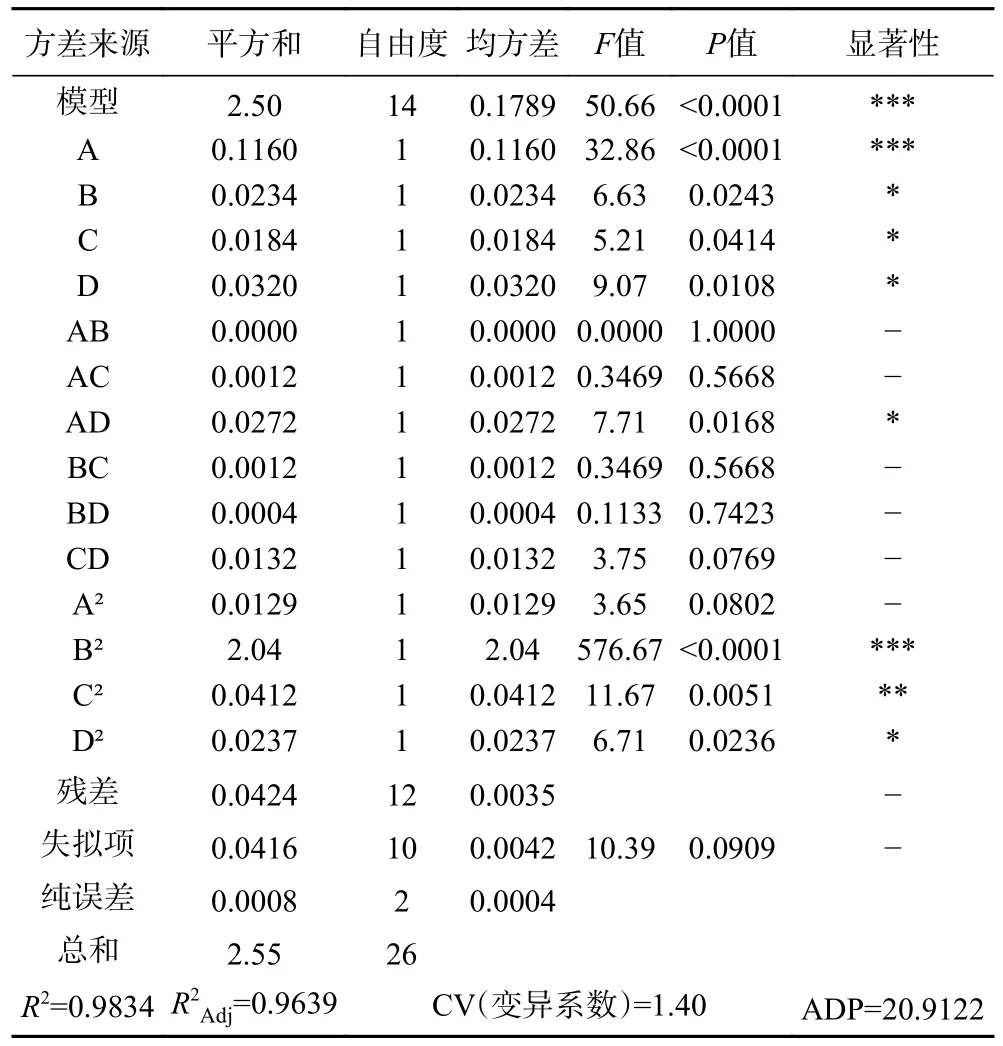
表4 回归模型的方差分析Table 4 Analysis of variance for regression models
表4 列出了芒果苷提取率的拟合二次多项式模型的方差分析(ANOVA)。F检验表明该模型具有非常高的模型F值(F=50.66)和非常低的P值(P<0.0001),表明该模型非常重要。失拟项衡量模型未能在回归中未包含的点上表示实验域中的数据。如表4 所示,失拟项F 值和P值分别为10.39 和0.0909,这意味着它相对于纯误差并不显著,表明模型方程足以预测变量值的任意组合下芒果苷的提取率。模型的决定系数R2=0.9834,能够解释响应值98.34%变化。R2adj(adjusted determination coefficient)是检验回归方程拟合优度的相关性度量。观测值和预测值之间的相关性高[24],R2adj=0.9639,也证实了该模型具有高度显著性,表明观测数据与预测数据之间存在高度相关性。变异系数(CV)表示与实验进行比较的精确程度。由于CV 是一种将标准偏差表示为平均值百分比的度量,因此CV 值越小,重现性越好。表4中的CV 值相对较低为1.4%,一般来说,可接受的CV 值应低于20%。这表明所进行的实验具有更好的精度和可靠性。
ADP 的值有助于预测信噪比和模型合理性。一般来说,ADP 值越大,信噪比越低,模型合理性越高。ADP 的正常值为4.0。这意味着如果任何设计模型的ADP 大于4.0,则需要优化提取条件[25]。研究发现ADP 值为20.9122,高于正常值。因此,Box-Behnken 是优化芒果苷提取率的理想模型。
2.7.3 响应面分析 由表4 可知AB、AC、BC、BD、CD 的交互作用对响应值的影响无显著性差异(P>0.05)。根据回归方程以及响应曲面和等高线图形,分析各种因素对芒果苷提取率的交互作用。结果如图6 所示,变量A、D 对芒果苷提取率的影响均呈现先增后减的趋势,响应面的斜率越陡,交互作用越显著[26]。圆形等高线图表示对应变量之间的交互作用可忽略,而椭圆等高线图表示对应变量之间的交互作用显著[27]。随着料液比(A)和超声时间(D)的变化,响应面趋于抛物线,曲面斜率陡峭,且等高线图呈现椭圆状,表明料液比(A)和超声时间(D)之间存在相互作用,即与ANOVA 结果一致(P<0.05)。该结论与上述响应面模型的回归分析一致。
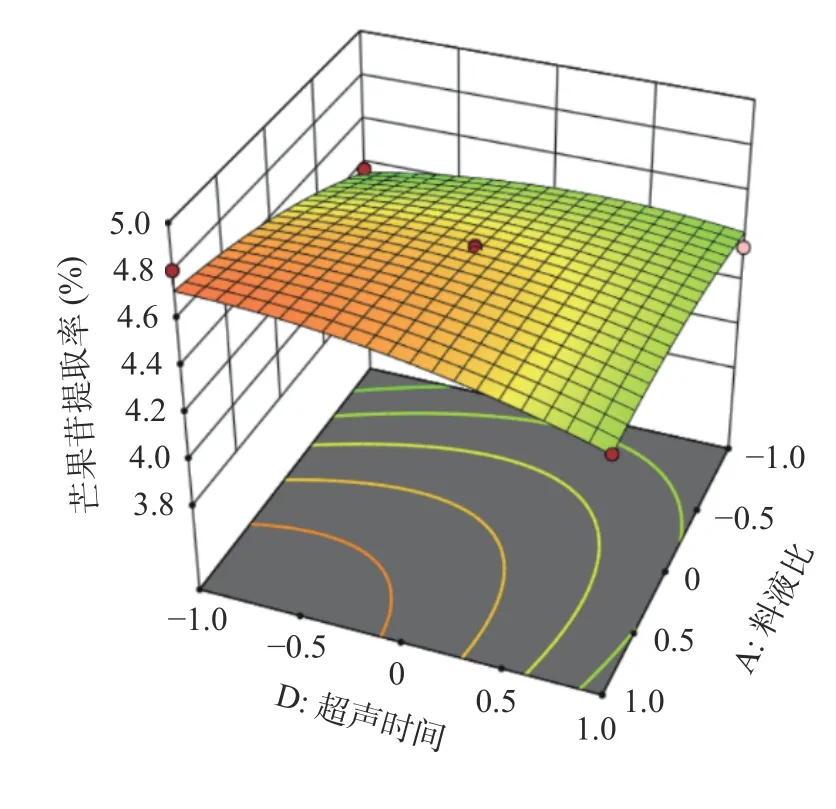

图6 料液比和超声时间交互作用对芒果苷提取效果影响的响应面及等高线Fig.6 Response surface and contours of the effect of material-liquid ratio and sonication time interactions on the extraction effect of mangosteen
2.7.4 提取参数的优化和模型的验证 使用响应面优化预测模型预测的芒果苷提取最佳条件进行额外试验:当料液比为1:50、乙醇浓度为75.38%、超声温度为45.55 ℃、超声时间为40.00 min 时,模型预测的最大响应值为4.75%。为验证模型方程的充分性,结合实际操作的可行性,调整最优试验条件为以75%的乙醇为溶剂,1:50 料液比在45 ℃条件下处理40 min,超声辅助提取芒果苷,重复3 次试验,芒果核中芒果苷提取率平均为4.78%±0.01%,证明了模型的有效性。验证结果表明,实验值和预测值之间的误差值为0.0002,差异较小,这一分析结果表明,二者结果吻合度较高,该优化工艺具有稳定性和可行性。因此,响应面优化结果可以作为芒果苷的提取工艺参数。
3 结论与展望
本研究采用超声辅助乙醇法,以最大限度地提高芒果核中芒果苷的提取率。实验在0~20 mg/L 范围内,R2=0.9999,芒果苷标准曲线线性关系良好。RSD%在0.69%以内,加标回收率在98.84%~100.40%,说明此方法的重复性、精密度、稳定性和回收率高。
在单因素实验的基础上,采用响应面法对实验变量—液料比、乙醇浓度、超声温度和超声时间4 个参数进行优化,得到最佳提取条件:料液比1:50 mL/g、乙醇浓度75%、超声温度45 ℃,超声时间40 min。此条件下芒果苷提取率达到4.78%±0.01%,与预测芒果苷提取率非常吻合。因此,该方法可以实现高效、简便的芒果苷提取,为进一步开发芒果副产物提供了理论参考。
然而,本研究仍存在问题,主要集中在芒果苷的提取与分析方面。首先,研究范围仅限于芒果核中的芒果苷,其他芒果副产物中的芒果苷提取和分析仍需深入研究;其次,所得到的最佳提取条件在实验室条件下确定,其在工业生产中的可行性和适用性有待验证;另外,本研究仅考虑了超声辅助乙醇法对芒果苷提取率的影响,对芒果苷的应用价值和开发潜力的研究尚不够充分。为解决上述问题,今后研究方向可以从以下几个方面展开:首先,拓展研究至其他芒果副产物,探索提高芒果苷资源利用效率和经济效益的提取与分析方法;其次,深入研究超声辅助提取技术在工业生产中的应用和优化,以确保其可行性和适用性;最后,评估芒果苷的生物活性和安全性,探索其在功能性食品、药物等领域的应用,拓宽其应用领域,为其应用开发提供理论基础和实验依据。

