长白山区发酵酱菜中高产胞外多糖乳酸菌的筛选及多糖抗氧化性分析
尉 洁,张玲芳,胡顺安,秦孟春,马 琳,李 丹,段翠翠
(长春大学农产品加工吉林省普通高等学校重点实验室,吉林长春 130022)
乳酸菌(lactic acid bacteria,LAB)是指能利用可发酵碳水化合物产生大量乳酸的一类革兰氏阳性菌[1],是公认的食品级安全微生物,具有维持肠道菌群平衡[2-3]、调节免疫力[4-5]、降低胆固醇[6]和抗氧化[7]等多种益生功能。乳酸菌的益生作用与其所产生的胞外多糖关系密切,乳酸菌胞外多糖(lactic acid bacteria exopolysaccharides,LAB EPS)是乳酸菌生长代谢过程中分泌到菌体细胞外或基质中的多糖类物质,包括黏附在细胞表面的荚膜多糖和分泌到外部环境中的粘液多糖[8]。
研究表明乳酸菌胞外多糖具有抗氧化、免疫调节、抗肿瘤、抗菌等功能[9-10],其中抗氧化功能是其它功能的基础,是最重要也是最需要深入研究的一种功能。当机体受到不良刺激时,产生的过量自由基超出细胞抗氧化防御能力,造成机体氧化与抗氧化作用失衡,产生氧化应激反应[11]。持续的氧化应激可导致脂质过氧化、蛋白质和DNA 损伤,引发炎症、糖尿病、动脉粥样硬化和神经退行性疾病[12]。丁基羟基茴香醚(BHA)、二丁基羟基甲苯(BHT)、没食子酸丙酯(PG)、叔丁基对苯二酚(TBHQ)等合成抗氧化剂具有较高抗氧化活性,但因其一定程度上危害健康而被限制使用[13-14]。因此,本文旨在从发酵酱菜中提取一株高产胞外多糖的乳酸菌,研究其多糖的抗氧化性,以期寻找一种天然来源的、安全的抗氧化剂。
本研究从吉林省延吉市收集了300 余份发酵酱菜,从中筛选出高产胞外多糖的乳酸菌,扩大培养并分离提取胞外多糖。通过检测DPPH 自由基、ABTS+自由基和OH 自由基清除活性,测定多糖的抗氧化性,旨在为乳酸菌胞外多糖作为天然抗氧化剂的开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
发酵酱菜(包括辣白菜、酱辣椒、牛板筋、酸菜、桔梗等)购自吉林省延吉市;过氧化氢溶液、无水乙醇、碘液、蔗糖、硫酸、苯酚 北京化工厂;三氯乙酸、抗坏血酸、硫酸铁 国药集团;水杨酸、过硫酸钾 天津光复试剂有限公司;所有试剂均为分析纯;DPPH、ABTS 北京索莱宝科技有限公司;MRS 液体培养基(g/L):蛋白胨10.0 g、牛肉膏10.0 g、酵母提取物5.0 g、葡萄糖20.0 g、乙酸钠5.0 g、柠檬酸二胺2.0 g、吐温-80 1.0 mL、磷酸氢二钾2 g、硫酸镁0.2 g、硫酸锰0.03 g,蒸馏水1000 mL,121 ℃,高温灭菌20 min;MRS 固体培养基(g/L):MRS 液体培养基中加20 g 琼脂,121 ℃,高温灭菌20 min;MRS-S产糖培养基(g/L):MRS 液体培养基中20 g 葡萄糖替换为25 g 葡萄糖、45 g 蔗糖,121 ℃,高温灭菌20 min。
MLR-352H-PL 电热恒温培养箱 日本Panasonic 公司;ZHWY-2102 双层恒温振荡培养箱 上海智诚分析仪器制造有限公司;DHG-9240A 电热恒温鼓风干燥箱 上海精宏实验设备有限公司;HVE-50 高压蒸汽灭菌器 Hirayama 公司;UV-1550 紫外分光光度计 日本岛津公司;Thermo Multiskan Spectrum 全波长酶标仪 上海奥陆生物科技有限公司;MDF382E 超低温冰箱 日本三洋公司;AUW-120 电子分析天平 日本Shimadzu 公司;J-26XPI冷冻高速离心机 美国贝克曼公司;Centrifuge5430高速离心机 德国Eppendorf 公司;FDU-2100 真空冷冻干燥机、OSB-2100 旋转蒸发仪 日本东京理化株式会社。
1.2 实验方法
1.2.1 发酵酱菜中乳酸菌的筛选 根据参考文献[15]的方法并加以修改,取5 g 发酵酱菜样品研磨,加入45 mL 0.9%生理盐水混匀,取1 mL 样品溶液,梯度稀释(10-3~10-5),均匀涂布于含0.2% CaCO3的MRS 固体培养基上,37 ℃培养24~48 h。观察菌落形态,选取产生“溶钙圈”且表面凸起,边缘光滑,乳白色或黄色的菌落,用无菌接种环挑取单菌落接种于MRS 液体培养基,37 ℃培养24 h,重复MRS 固体培养基划线操作3~5 次,直至菌落形态一致,获得纯培养物[16]。挑取单菌落进行革兰氏染色、过氧化氢酶试验及显微镜观察,其中革兰氏染色阳性、过氧化氢酶阴性的菌株初步认定为乳酸菌[17]。
1.2.2 高产胞外多糖乳酸菌的筛选 产胞外多糖的乳酸菌菌落一般具有“拉丝”或者“粘液”的特点,依据菌落形态对产糖乳酸菌进行初步筛选[18]。并利用苯酚硫酸法测定胞外多糖含量,选取产量较高的菌株用于后续实验。乳酸菌在固体培养基上平板划线后置于恒温培养箱,37 ℃培养48 h,可观察到其在MRS培养基上呈较小、边缘整齐、灰白的不透明圆状,而在产糖培养基MRS-S 上菌落较大,有光泽感,且粘性较强,挑取菌落有拉丝现象产生。
1.2.3 菌株的生物学鉴定 将筛选的产糖乳酸菌送至上海派森诺生物科技有限公司进行16S rDNA 和pheS基因序列检测,并通过MEGA11 软件将测序结果与乳杆菌属内模式菌株进行比对,构建系统发育树,进行种间和种内鉴定。
1.2.4 乳酸菌胞外多糖的提取 参考Di 等[19]的方法并加以修改,胞外多糖的提取主要包括菌株活化、扩大培养、除菌体、浓缩、除蛋白、醇沉、透析等步骤。将活化好的菌株发酵液按1.5%接种量接种于MRS 液体培养基,37 ℃、150 r/min 摇瓶培养48 h,7000×g 离心20 min 去除菌体,采用TCA 法除蛋白,在发酵上清液中加80%三氯乙酸至终浓度为4%,4 ℃静置12 h 沉淀蛋白质,再次离心去除沉淀。使用旋转蒸发仪浓缩上清液,然后加入三倍体积95%预冷乙醇沉淀多糖,4 ℃静置12 h,7000×g、4 ℃离心20 min,用适量去离子水溶解多糖沉淀,利用3400 kDa 透析膜在4 ℃下透析48 h,每8 h 换一次水,最后冻干,即为粗多糖成品。
1.2.5 总糖含量测定
1.2.5.1 绘制标准曲线 采用苯酚硫酸法,以葡萄糖为标准品制作标准曲线[20]。称取10 mg 干燥至恒重的葡萄糖,用蒸馏水溶解,定容于250 mL 容量瓶,分别吸取0.2、0.3、0.4、0.5、0.6、0.7、0.8 及0.9 mL 葡萄糖溶液于试管中,加蒸馏水补至1 mL,然后加入1 mL 5%(v/v)苯酚,5 mL 浓硫酸,混匀静置20 min后,490 nm 处测定吸光度。以糖含量为横坐标(mg/L),吸光度值(A490 nm)为纵坐标绘制标准曲线,建立回归方程,Y=8.4001X+0.022,R2=0.9994>0.99,表示具有较高可行性和线性关系。
1.2.5.2 多糖含量测定 取1 mL 浓度为0.03 mg/mL的多糖样品溶液,加入1 mL 5%苯酚溶液和5 mL浓硫酸,混匀静置20 min,490 nm 处测定吸光度,根据标准曲线计算胞外多糖含量。
1.2.6 胞外多糖体外抗氧化活性测定 将冷冻干燥后的多糖样品配制成10 mg/mL 的胞外多糖溶液,再用超纯水分别稀释浓度为2、4、6、8 mg/mL,用于DPPH 自由基、ABTS+自由基和OH 自由基清除试验。
1.2.6.1 DPPH 自由基清除试验 参照Xu 等[21]的实验方法稍加修改。称取2 mg DPPH 溶于50 mL无水乙醇,使其在517 nm 处吸光度在0.8~1.0 之间。分别取1 mL(浓度范围2~10 mg/mL)的胞外多糖溶液与1 mL DPPH-乙醇溶液充分混匀,室温避光反应30 min,离心(8000 r/min,10 min),吸取上清液,517 nm 处测定吸光度值,利用下面的公式计算胞外多糖的DPPH 自由基清除率。用2 mg/mL 的抗坏血酸作为阳性对照。
式中,A0:水与 DPPH-乙醇溶液反应的吸光值;A1:样品与 DPPH-乙醇溶液反应的吸光值;A2:水与样品混合的吸光值,以排除样品自身对试验的干扰。
1.2.6.2 ABTS+自由基清除试验 参照赵丹等[22]的实验方法并加以修改。0.2 mL 7.4 mmol/L 的 ABTS溶液与0.2 mL 的2.6 mmol/L 过硫酸钾溶液混合,避光反应14 h,制成ABTS 储备液。使用前用无水乙醇稀释,使其在734 nm 处吸光度为0.70±0.02,制成ABTS 工作液。将0.2 mL(浓度范围2~10 mg/mL)胞外多糖溶液与0.8 mL ABTS 工作液充分混匀,避光静置6 min,734 nm 处测定吸光度值。带入下列公式计算胞外多糖的ABTS+自由基清除能力。用2 mg/mL 抗坏血酸作为阳性对照。
式中,A0:水与 ABTS 反应的吸光值;A1:样品与ABTS 反应的吸光值;A2:水与样品混合的吸光值,以排除样品自身对试验的干扰。
1.2.6.3 OH 自由基清除试验 参照王荣平[23]的实验方法并加以修改。分别向试管中加入1 mL(浓度范围2~10 mg/mL)胞外多糖样品,再依次加入1 mL的6 mmol/L 硫酸亚铁溶液和1 mL 的1%过氧化氢溶液,混匀静置15 min,然后加2 mL 的6 mmol/L水杨酸混匀,37 ℃恒温30 min,3000 r/min 离心10 min,吸取上清液,510 nm 处测定吸光度值。利用下式计算胞外多糖的OH 自由基清除能力。用2 mg/mL抗坏血酸作为阳性对照。
式中,A0:超纯水代替样品的吸光值;A1:含不同浓度样品的吸光值;A2:不含样品和H2O2的吸光值。
1.3 数据处理
所有实验均设三组平行,实验数据采用Graph-Pad Prism 8 软件进行绘图和单因素方差分析(ANOVE,LSD)。数值以均值±标准差表示。P<0.05 代表差异显著。
2 结果与分析
2.1 乳酸菌筛选结果
按上述1.2.1 的实验方法分离发酵酱菜中的乳酸菌,利用乳酸菌在含CaCO3培养基产生“溶钙圈”,且具有革兰氏染色阳性,过氧化氢酶阴性的特点,共筛选出160 株疑似乳酸菌,对其进行编号,用60%甘油保存在-80℃冰箱内。菌株A63、A120 和A128 在含CaCO3的MRS 培养基上生长情况如图1所示,菌落周围形成透明“溶钙圈”;革兰氏染色镜检结果如图2 所示,显微镜下均呈蓝紫色的杆状,具有乳酸杆菌的典型特征。

图1 菌株A63、A120、A128 的“溶钙圈”现象Fig.1 Phenomenon of "dissolving calcium circle" of strains A63,A120 and A128
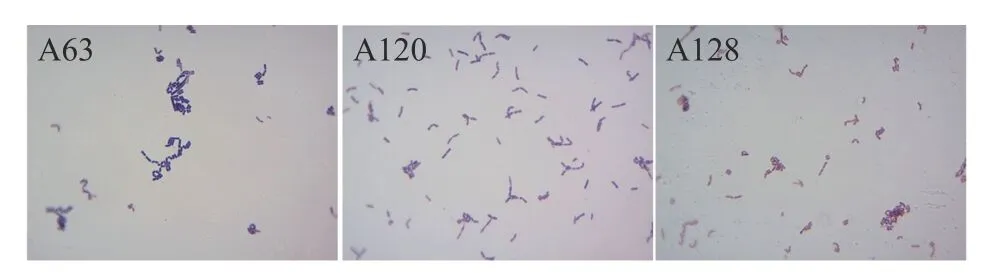
图2 菌株A63、A120、A128 的革兰氏染色镜检结果Fig.2 Results of Gram staining microscopy of strains A63,A120 and A128
2.2 高产胞外多糖乳酸菌的筛选
菌株A63 在MRS 固体培养基和MRS-S 产糖培养基上的生长情况如图3 所示。
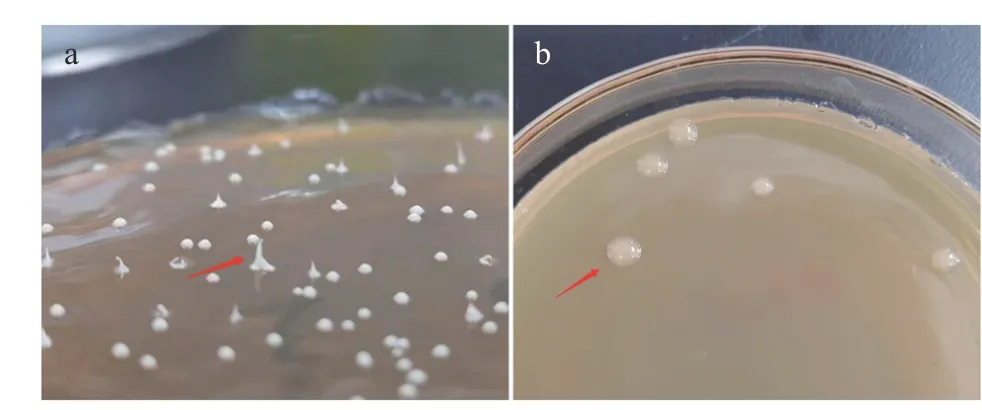
图3 A63 在MRS(a)和MRS-S(b)培养基上的菌落形态Fig.3 Colony morphology of A63 on MRS (a) and MRS-S (b)medium
将上述从发酵酱菜中分离的160 株乳酸菌在MRS 固体培养基上平板划线,用无菌牙签轻挑单菌落,观察到有10 株乳酸菌有拉丝现象,并且在MRSS 产糖培养基上长势良好,呈现光滑的乳白色菌落或呈粘液状。选择拉丝现象较为明显的菌株A63、A120、A128 进行扩大培养、提取胞外多糖并测定产量。胞外多糖产量结果如图4 所示,三株乳酸菌均有较高的胞外多糖产量,其中菌株A63 的胞外多糖产量显著高于菌株A120 和A128,具有更好的开发潜力。

图4 乳酸菌胞外多糖产量Fig.4 Exopolysaccharide production of Lactic acid bacteria
2.3 菌株的生物学鉴定
2.3.1 16S rDNA 基因序列分析 以菌株A63、A120和A128 的基因组DNA 为模板,进行PCR 扩增。引物序列为27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-CTACGGCTACCTTGTTACGA-3’)。取各个菌种纯化后的PCR 产物,使用测序仪ABI 3730-XL 进行DNA 测序。用NCBI Blast 程序将拼接后的序列文件与NCBI 16S rDNA 数据库中的数据进行比对,得到与待测物种序列相似性最大的物种信息[24],并使用MEGA11 软件绘制系统发育树。由图5 可知,三株乳酸菌与L.plantarum和L.pentosus模式菌株的亲缘性较近,无法通过16S rDNA 进行确定,所以采用pheS基因序列分析进一步确定所测菌株的具体种类。
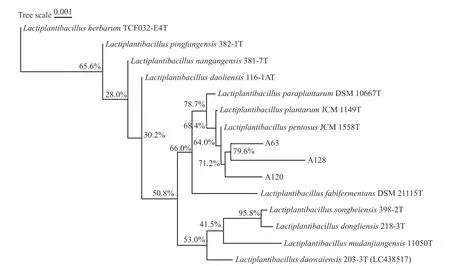
图5 基于16S rDNA 基因序列构建的系统发育树Fig.5 Phylogenetic tree based on 16S rDNA gene sequences
2.3.2pheS基因序列分析 对菌株的pheS基因进行扩增、测序,基因序列同样利用MEGA11 软件与数据库中的模式菌株进行比对分析,绘制系统发育树。由图6 可知,三株乳酸菌与L.plantarum的亲缘关系最近,且相似性为100%,可以判断出三株乳酸菌均为植物乳植杆菌。
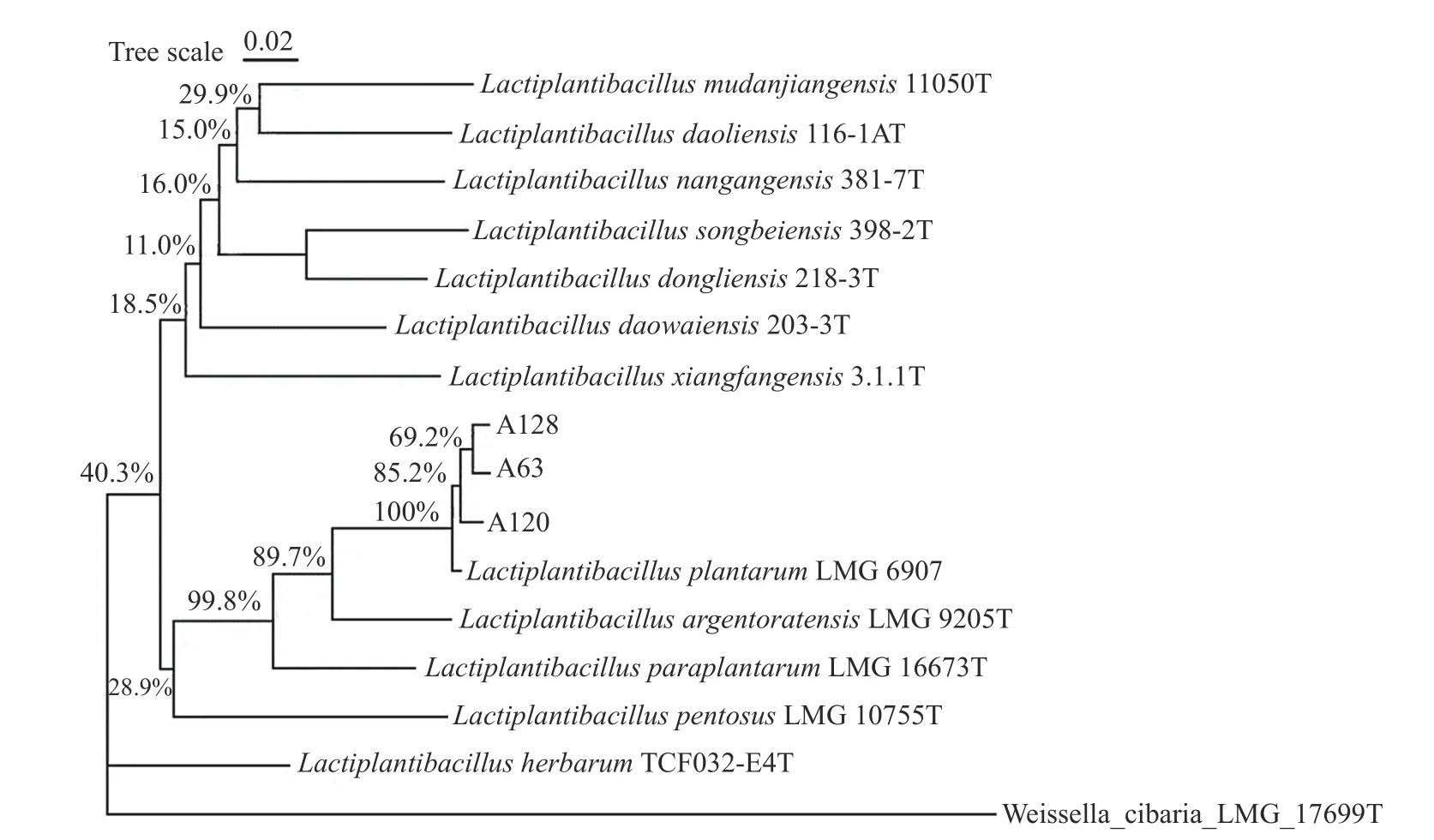
图6 基于pheS 基因序列构建的系统发育树Fig.6 Phylogenetic tree based on pheS gene sequences
2.4 乳酸菌胞外多糖的体外抗氧化活性测定结果
2.4.1 DPPH 自由基清除率 DPPH 自由基是一类较为稳定的合成自由基,清除过量DPPH 自由基是维持体内自由基平衡的重要因素,也是评价抗氧化剂效果的重要指标之一[25]。植物乳植杆菌A63、A120、A128 胞外多糖的DPPH 自由基清除率如图7 所示,其中以2 mg/mL 的抗坏血酸作为阳性对照。由图7可知,三株植物乳植杆菌所产胞外多糖的DPPH 自由基清除率均随着胞外多糖浓度的升高逐渐增加,在试验浓度范围内表现为明显的剂量依赖性,且不同浓度间差异显著(P<0.05)。当胞外多糖浓度为10 mg/mL 时,菌株A63、A120、A128 胞外多糖的DPPH自由基清除率分别为90.47%、79.37%、84.94%,其中菌株A63 胞外多糖的DPPH 自由基清除率最高,与2 mg/mL 抗坏血酸的自由基清除能力接近,表明菌株A63 胞外多糖具有较强的清除DPPH 自由基能力。杨晨璐等[26]对从鲊辣椒中提取的植物乳植杆菌胞外粗多糖和两个纯化后的组分进行抗氧化性研究,结果表明三种多糖对DPPH 自由基的清除率均达到90%以上,说明乳酸菌胞外多糖具有代替抗坏血酸清除DPPH 自由基的潜力。
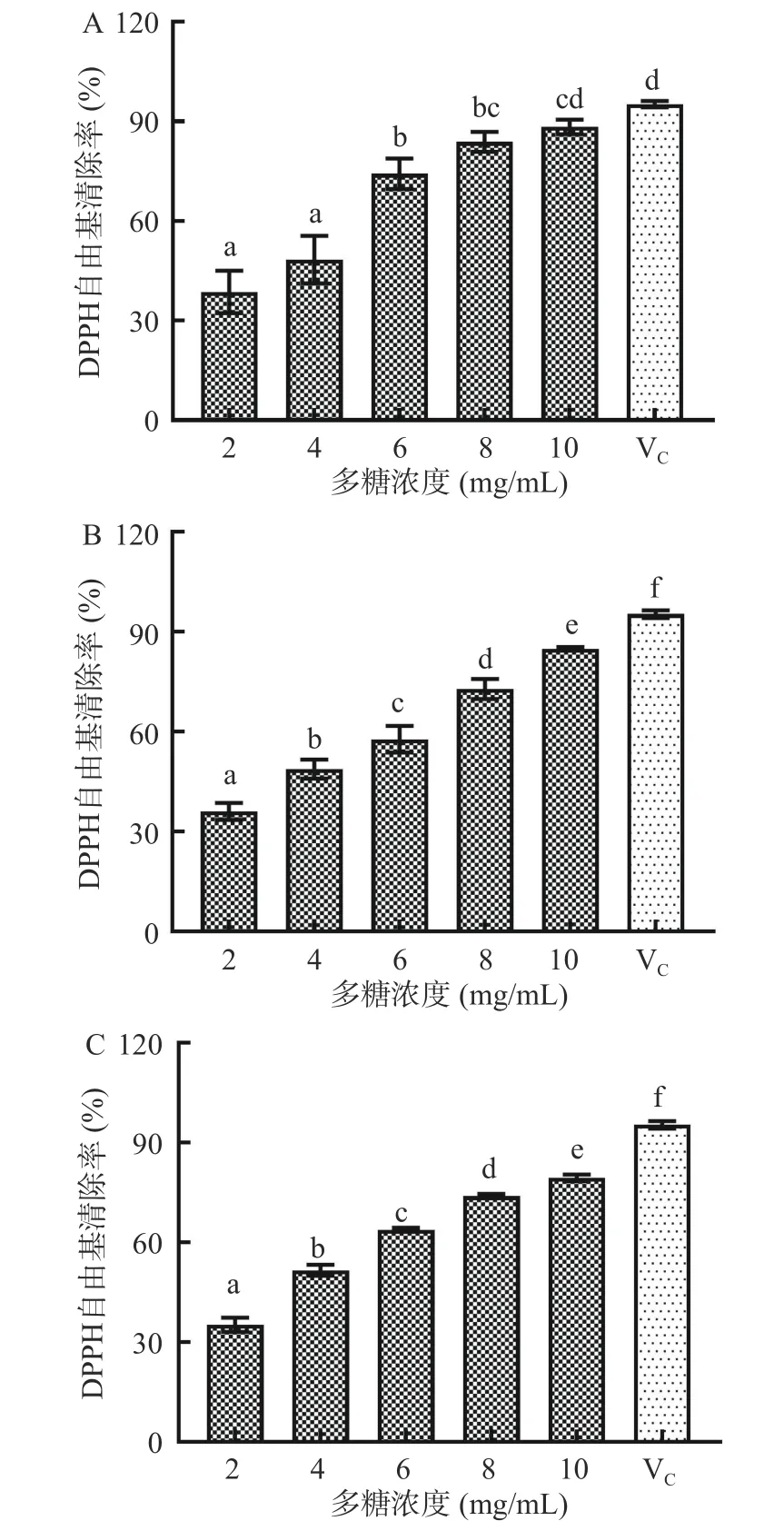
图7 胞外多糖的DPPH 自由基清除率Fig.7 DPPH radical scavenging rate of exopolysaccharides
2.4.2 ABTS+自由基清除率 ABTS+自由基是一种过氧化物酶底物,是评价抗氧化物抗氧化能力的另一个广泛使用的指标[27]。植物乳植杆菌A63、A120、A128 胞外多糖对ABTS+自由基清除率如图8 所示,三株菌的胞外多糖均具有一定程度的清除ABTS+自由基能力。在试验浓度范围内,胞外多糖对ABTS+自由基清除率均表现出浓度依赖性。随着胞外多糖浓度升高,ABTS+自由基清除率增大,但均低于抗坏血酸。当胞外多糖浓度为10 mg/mL 时,菌株A63、A120、A128 胞外多糖的ABTS+自由基清除率分别为51.67%、47.07%、49.92%,植物乳植杆菌A63 胞外多糖的ABTS+自由基清除能力高于其他菌株所产胞外多糖。臧文晶等[28]从自制橘子发酵液中分离的肠膜明串珠菌HDE1 胞外多糖对ABTS+自由基的清除率为40%±0.02%,低于本研究中植物乳植杆菌A63 胞外多糖清除ABTS+自由基能力,说明植物乳植杆菌A63 胞外多糖具有较高的ABTS+自由基清除能力。
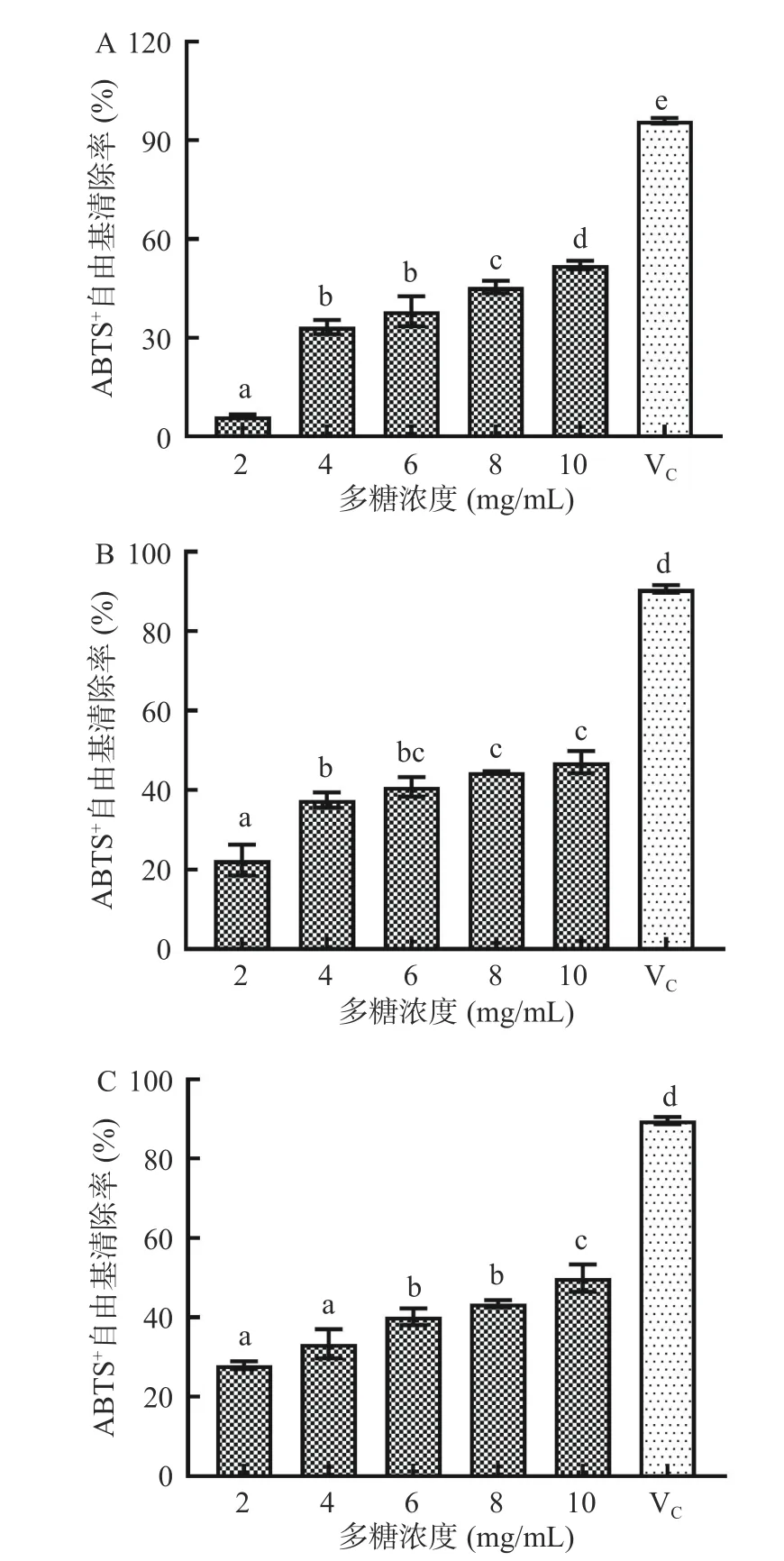
图8 胞外多糖的ABTS+自由基清除率Fig.8 ABTS+ radical scavenging rate of exopolysaccharides
2.4.3 OH 自由基清除率 OH 自由基与核酸、蛋白质等生物大分子作用,会造成机体严重的氧化损伤[29]。胞外多糖主要通过螯合金属离子来抑制羟基的形成,金属离子可以作为助氧化剂催化氧化反应[30]。植物乳植杆菌A63、A120、A128 胞外多糖对OH 自由基清除率如图7 所示,图中以胞外多糖的最低浓度2 mg/mL 的抗坏血酸作为阳性对照。由图9 可知,当胞外多糖浓度为2 mg/mL 时,三株菌的OH 自由基清除率均超过20%。随着胞外多糖浓度升高,OH 自由基清除活性增大,但不同浓度之间差异并不显著。当胞外多糖浓度为10 mg/mL 时,OH 自由基清除活性达到最大,清除率分别为56.21%、34.98%、35.09%。叶广彬等[31]从东北发酵酸菜中分离的乳酸菌GX-3,其胞外多糖浓度在5 mg/mL 时,对OH 自由基的清除率为78.24%±3.52%,高于本研究中植物乳植杆菌A63 胞外多糖的OH 自由基清除率,但DPPH 自由基清除率显著低于A63 胞外多糖,说明不同乳酸菌产生的胞外多糖可以作用于不同种类的自由基,都具有一定程度的抗氧化活性。
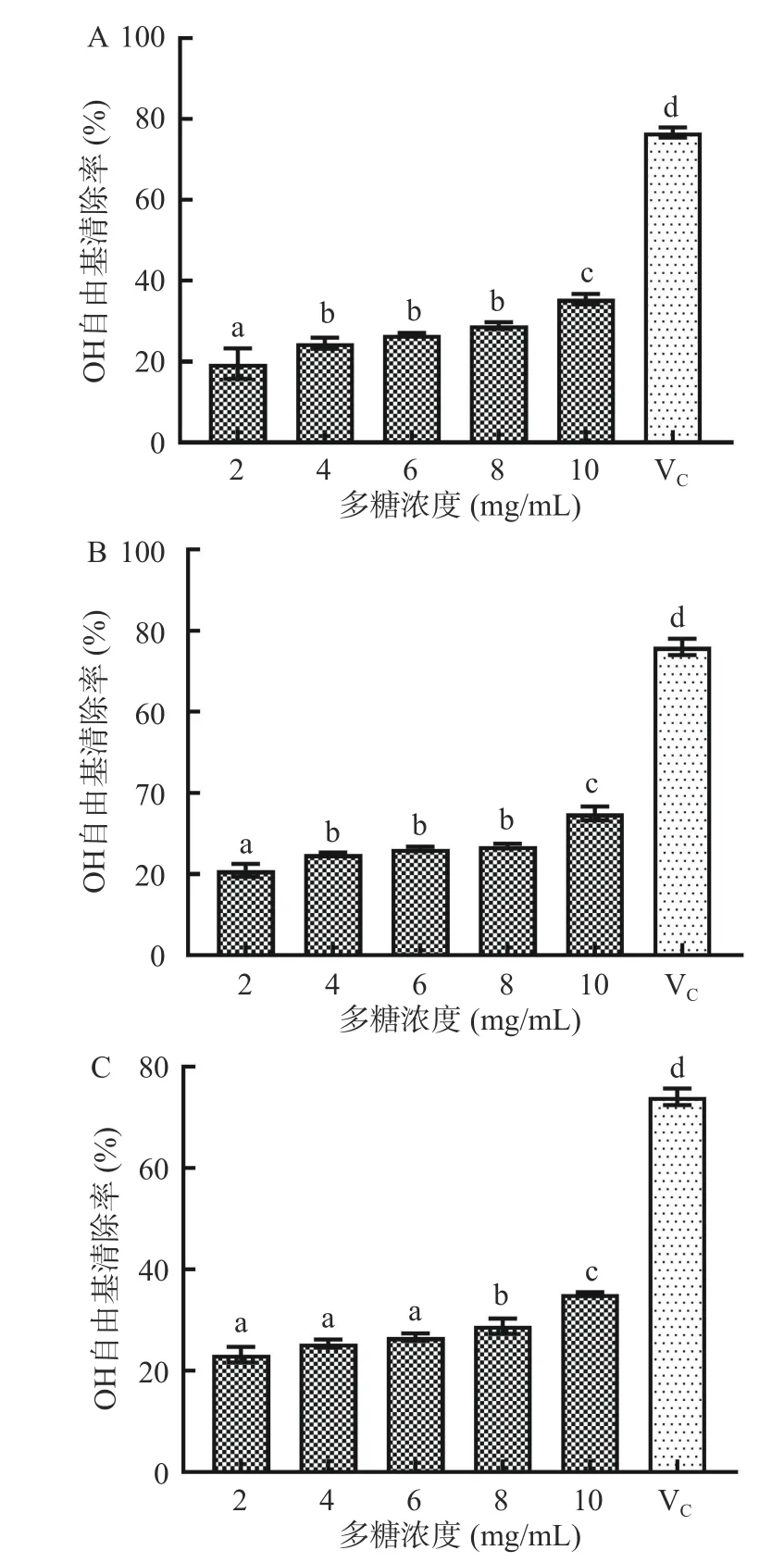
图9 胞外多糖的羟基自由基清除率Fig.9 Hydroxyl radical scavenging of exopolysaccharides
3 结论
本研究从吉林省延吉市300 余份发酵酱菜中筛选出3 株高产胞外多糖的菌株A63、A120、A128,分别对其所产胞外多糖进行体外抗氧化活性的测定。研究表明,菌株A63、A120、A128 胞外多糖产量分别为0.806、0.663、0.630 g/L,经16S rDNA 和pheS基因鉴定为植物乳植杆菌。体外抗氧化结果显示,三株菌所产胞外多糖都具有清除DPPH、ABTS、OH 自由基的能力,且表现为明显的剂量依赖性,当胞外多糖浓度为10 mg/mL 时,植物乳植杆菌A63胞外多糖的DPPH、ABTS 和OH 自由基清除率分别为90.47%、51.67%和35.08%,高于同浓度下菌株A120、A128 胞外多糖的自由基清除率。实验结果表明植物乳植杆菌A63 所产胞外多糖具有较强的抗氧化能力,且具有较高产量,可以作为潜在的天然抗氧化剂来源。本实验为乳酸菌胞外多糖的抗氧化性研究提供了理论依据,但体外理化实验虽然在一定程度上能反映胞外多糖的抗氧化性,却无法体现生物有效性和细胞代谢等问题。因此,后续计划利用小鼠巨噬细胞RAW264.7 开展细胞抗氧化试验,探究A63 胞外多糖对巨噬细胞RAW264.7 氧化损伤的保护作用,以便更好地评估乳酸菌胞外多糖的细胞抗氧化活性。

