米曲霉磷酸甲羟戊酸激酶功能研究
尚怡彤 闫欢欢 王丽红 田学琴 薛萍红 罗涛 胡志宏
(1. 江西科技师范大学生命科学学院,南昌 330013;2. 江西科技师范大学江西省生物加工过程重点实验室,南昌 330013)
在真核生物中,甲羟戊酸(mevalonate, MVA)途径是甾醇和类异戊二烯生物合成的主要代谢通路[1]。整个途径起始于两分子乙酰辅酶A,由乙酰辅酶A 乙酰基转移酶(acetyl‑coenzyme A acetyltrans‑ferase, AACT)、3‑羟基‑3‑甲基戊二酰辅酶A 合酶(3‑hydroxy‑3‑methylglutaryl‑CoA synthase, HMGS)、3‑羟基‑3‑甲基戊二酰辅酶A 还原酶(HMG‑CoA reductase, HMGR)、甲羟戊酸激酶(mevalonate ki‑nase, MK)、磷酸甲羟戊酸激酶(phosphomevalonate kinase, PMK)和甲羟戊酸‑5‑焦磷酸脱羧酶(meva‑lonate‑5‑pyrophosphate decarboxylase, MVD)6 个连续的酶催化,合成异戊烯焦磷酸(isopentenyl‑5‑pyroph‑osphate, IPP)(图1)。在高等植物中,IPP 是类异戊二烯生物合成所需的基本骨架,类异戊二烯是许多植物特定分子的前体,如生长调节剂(如赤霉素和脱落酸)、光合色素、植物毒素、植物抗毒素和植物防御所需的其他化合物,以及芳香萜类化合物和天然橡胶等,这些化合物在细胞过程中具有重要功能[2]。在真菌中,IPP 是麦角甾醇生物合成所需的前体。麦角甾醇是真菌细胞膜的组成成分,对真菌的生长和生存极其重要。麦角甾醇及其衍生物也具有重要的经济价值,如麦角甾醇是维生素D2和类固醇激素药物的前体[3-4];11‑脱氢麦角甾醇过氧化物具有显著的抗肿瘤活性;麦角甾醇的结构类似物具有抗HIV 活性[5-6]等。真菌中,MVA 途径的代谢工程可能为萜类及甾醇类生物合成提供新思路。

图1 MVA 途径代谢通路Fig. 1 MVA pathway metabolic synthesis diagram
PMK 属于GHMP 超家族中的一员,其作用是催化磷酸甲羟戊酸(MVAP)进一步磷酸化为焦磷酸甲羟戊酸(MVAPP),该过程消耗1 个ATP[7]。PMK在异戊二烯亚基的合成中发挥作用,异戊二烯亚基用于合成各种必需化合物,包括甾醇、多醇和泛醌。异戊二烯衍生的分子在一些物种中也用于tRNA和特定蛋白质的共价修饰等。在动物中PMK 的研究较多,如PMK 基因突变将产生半乳糖激酶缺乏症(导致动物产生白内障)[8];MVA 途径中的MK、PMK、MVD 参与了多孔性角化病(PK)的发病机制[9]。在植物中,类异戊二烯和萜类化合物是极为重要的代谢产物,从植物中提取的精油等都有着丰富的药用和经济价值,目前已从拟南芥(Arabidopsis thaliana)[10]、橡胶树(Hevea brasiliensis)[11]、丹参(Salvia miltiorrhiza)[12]、 香 樟(Cinnamomum camphora)[13]、檀香木(Santalum album)[14]等植物中克隆分离并研究了PMK 基因。在真菌中PMK是麦角甾醇通路上游必不可少的酶,因此又称为Erg8。1991 年,研究者首先从酿酒酵母(Saccharomyces cerevisiae)中克隆了ERG8基因,并且证明其是异戊二烯和麦角甾醇合成所必需基因[15]。在鲍姆桑黄菌(Sanghuangporus baumii)中研究发现,Erg8 对其活性成分三萜类化合物的合成十分重要[16]。由于真菌中Erg8是合成麦角甾醇必不可少的基因,因此Erg8也是开发抗真菌药物的作用靶点[17-18]。
然而,Erg8基因在工业真菌——米曲霉(Aspergillus oryzae)中的功能研究甚少。米曲霉是食品和药物管理局(FDA)和世界卫生组织(WHO)认定的安全生产菌株,长期以来,它不仅用于传统的食品发酵、酿造和调味品行业,还用于酶制剂和重组蛋白生产等现代生物技术行业[2,19]。之前的生物信息学研究表明,米曲霉基因组中有1 个PMK 编码基因[20]。在本研究中,使用生物信息学分析鉴定编码PMK 的基因,通过酵母互补研究该基因的功能,并确定它的表达模式、亚细胞定位以及过表达表型和对麦角甾醇生物合成的影响,揭示磷酸甲羟戊酸激酶在米曲霉中的作用,这将为米曲霉或其他真菌脂质代谢的基因工程奠定基础。
1 材料和方法
1.1 材料
野生型米曲霉3.042(CICC 40092)来源于国家菌种保藏中心(中国北京)。尿苷/尿嘧啶营养缺陷型(ΔpyrG)米曲霉3.042 菌株由本实验室构建[21]。米曲霉在30℃的Czapek Dox 琼脂培养基(2%葡萄糖、0.2% NaNO3、0.1% KH2PO4、0.05% MgSO4、0.05%KCl、0.05% NaCl、0.002% FeSO4、1.5% agar、pH 5.5)中培养,3-5 d 后收集孢子,然后悬浮在含有0.05%Tween 80 的无菌水中,并用血细胞计数器测定孢子的浓度。大肠杆菌(Escherichia coli)DH5α 用于质粒构建,根癌农杆菌(Agrobacterium tumefaciens)AGL1 用于根癌农杆菌介导的米曲霉转化。大肠杆菌和根癌农杆菌分别在37℃和28℃的LB 培养基(添加对应的抗生素)中培养。
1.2 方法
1.2.1 进化树分析 以酵母ERG8 为参考序列,通过NCBI 在线查找其同源性序列,并使用相邻连接方法在MEGA 6.0 中创建进化树。所用的物种及PMK/Erg8 蛋白GI 号见表1。

表1 不同物种Erg8 序列号Table 1 Erg8 numbers of different species
1.2.2 基因表达模式分析 收集不同生长时间和不同胁迫条件下的菌丝体,液氮中冷冻并粉碎,使用真菌RNA 试剂盒(Omega Bio‑Tek, Norcross, GA)提取总RNA。使用NanoDrop ND‑2000 分光光度计(Thermo Scientific, Wilmington, DE)测定质量和浓度。使用Prime Script RT 试剂盒(Perfect Real Time,TaKaRa)从1 mg 总RNA 合成cDNA。使用试剂SYBR Premix Ex Taq(TaKaRa,日本)和CFX96 实时PCR 检测系统(Bio‑Rad, CA)进行所有荧光定量PCR(RT‑qPCR)操作[22]。组蛋白H4 用作内参基因,使用公式2-ΔΔCt计算相对表达量。用于RT‑qPCR 的引物序列见表2。
1.2.3 酵母互补erg8突变体(Y40835)和相应的酵母菌株BY4741 均购自EUROSCARF(http://www.euroscarf.de/index.php)。质粒pYES 2.0 用作酵母互补的载体[23]。使用一步克隆试剂盒(Vazyme Biotech Co., Ltd., China)将AoErg8的全长编码序列(CDS)融合到pYES 2.0(Hind III 和EcoR I 线性化),所用引物列于表2 中。使用酵母转化试剂盒II(Coolaber,中国北京)将构建的载体转化到相应的酵母突变体中。对照和转化子分别在YPD(1%酵母提取物、2%蛋白胨、2%葡萄糖、1% agar)和YPG(1%酵母提取物、2%蛋白胨、2%半乳糖、1% agar)培养基上生长,在30℃和37℃下观察表型。此外,收集在30℃的液体YPG 中培养2 d 的对照和转化子,以测定麦角甾醇的含量。
1.2.4 基因过表达表型及麦角甾醇的测定 使用二元载体pEX2B[24]进行基因过表达。使用pEX2B‑AoErg8‑F/R 引物(表2)扩增AoErg8基因,通过一步法(Vazyme Biotech Co., Ltd., China) 连接到二元载体pEX2B(经AflII 线性化),得到pEX2B‑AoErg8‑DsRed 载体;并转化到根癌农杆菌 AGL1中;最后使用农杆菌介导的方法转化为米曲霉3.042 ΔpyrG[21]。
麦角甾醇的提取采用醇碱皂化法。收集培养3 d 的米曲霉菌体,真空冷冻干燥至恒重,研磨,称取0.05 g 菌体粉末置于小玻璃瓶中,加入3 mL 乙醇‑KOH 溶液(25 g KOH + 35 mL ddH2O,无水乙醇定容至100 mL),涡旋1 min,85℃ 水浴锅中水浴 1.5 h 进行皂化。待其冷却至室温,加入3 mL 正庚烷和1 mL 超纯水,涡旋3 min。静置分层,取上层液体1.5 mL,于12 000 r/min 离心10 min,取上清1 mL 于进样瓶中,进行高效液相色谱检测。使用美国Waters e2695 HPLC 系统、Water 2489 UV 检测器、Empower数据管理系统、C18色谱柱;流动相体系为甲醇∶水=95∶5,流动相流速为1.5 mL/min,紫外检测波长为282 nm,每针进样体积为10 μL,每个实验重复3 次[22-23,25]。
1.2.5 亚细胞定位 将构建的pEX2B‑AoErg8‑DsRed质粒和具有GFP 报告基因的pt‑pEX1 质粒[21]共转到米曲霉3.042 ΔpyrG中,使用Leica DM5000B 显微镜观察荧光,以确定融合蛋白的亚细胞定位。
2 结果
2.1 生物信息学分析
为了研究米曲霉中AoErg8的功能,对不同生物中的PMK 进行了系统发育分析。结果(图2)显示,所有分析的物种中都至少含有一个PMK 同源基因。基于PMK 基因的起源,系统发育树可以分为植物、真菌、细菌和动物的分支,动物界智人和小鼠、节肢昆虫中家蚕和欧洲熊蜂为一支;植物、真菌、细菌为一支。因此,Erg8 在植物、动物和真菌中是进化保守的,这与其在植物、动物和微生物中均为MVA 途径下游IPP 合成必需酶的功能一致。
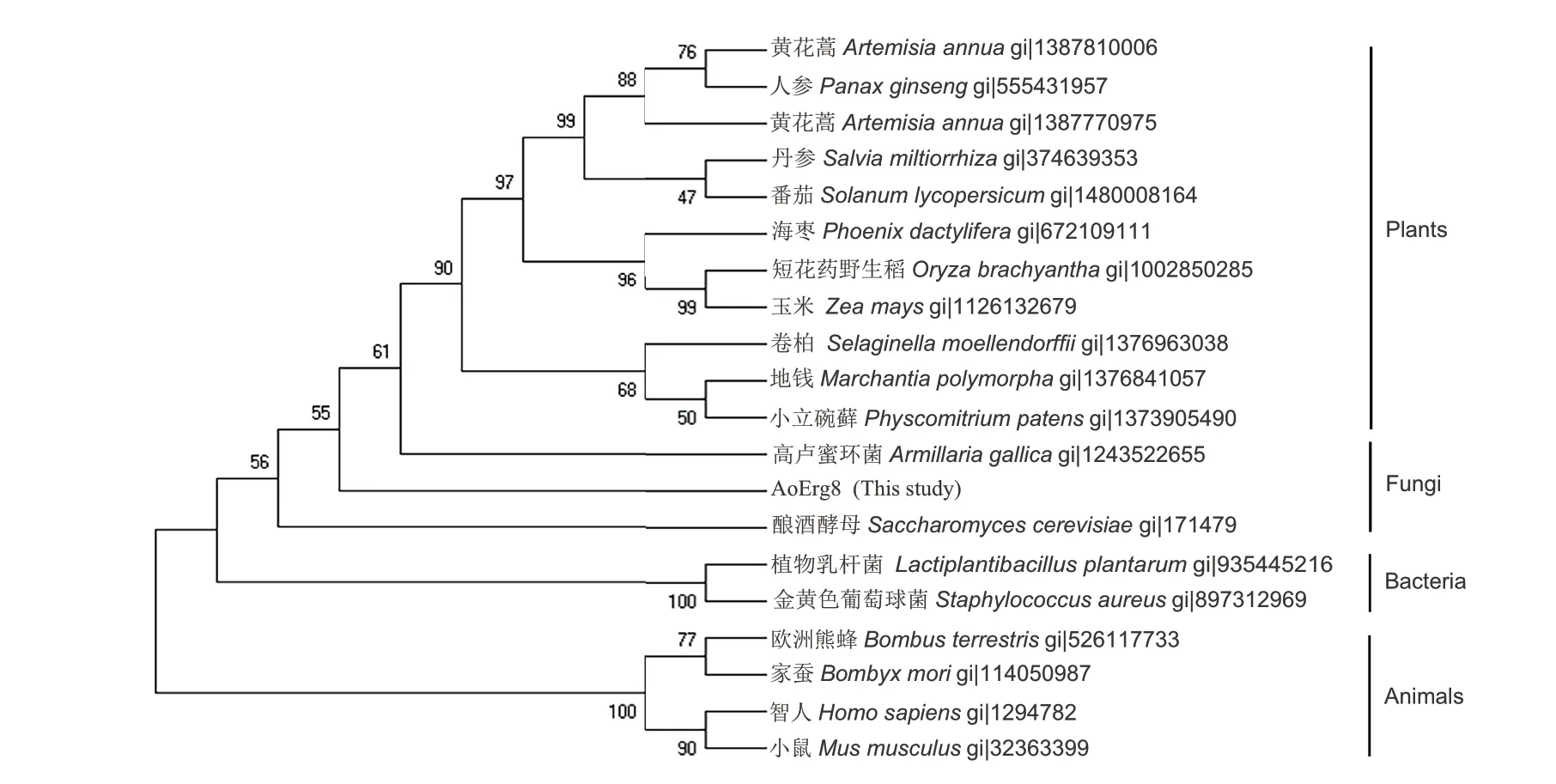
图2 不同物种磷酸甲羟戊酸激酶的系统发育分析Fig. 2 Phylogenetic analysis of phosphomevalonate kinases from different species
2.2 表达模式分析
为了研究AoErg8在米曲霉生长过程中的作用,使用RT‑qPCR 测定其在不同生长时间和不同生长条件下的表达量。在正常条件下,不同生长时间的AoErg8的表达水平不同,72 h 表达量最高,是24 h 的2 倍,是48 h 的20 倍(图3‑A)。据报道,麦角甾醇参与了酿酒酵母的应激反应,因此还研究了AoErg8在温度和非生物胁迫下的表达:30℃时AoErg8表达水平最高;低温下,22℃时表达量为30℃一半;高温下,37℃时显著降低,到42℃又明显上调(图3‑B)。盐处理抑制了AoErg8的表达,在5%、10%和15% NaCl 胁迫下的表达水平仅约为对照的1/10、1/11 和3/10(图3‑C)。AoErg8的表达在2%乙醇胁迫下减少了约4/5,在4%乙醇胁迫下仅为对照的1/6 左右(图3‑D)。因此,AoErg8在不同生长时间和不同胁迫下表达量均发生了明显的改变。
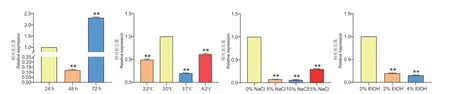
图3 AoErg8 在琼脂CD 培养基上不同生长时间和不同非生物胁迫下的表达水平Fig.3 Expressions of AoErg8 on agar CD medium under different growth time and different abiotic stress
2.3 酵母互补
酿酒酵母erg8突变体对温度敏感,在37℃下高温致死。为了验证米曲霉AoErg8功能是否保守,将AoErg8基因的全长CDS 融合到酵母表达载体(pYES2.0)上,并转化到酵母erg8突变体中。由于pYES2.0 含有半乳糖诱导的GAL1 启动子,在30℃和37℃的YPD(葡萄糖)和YPG(半乳糖作为诱导剂)培养基上分别观察到所有转化子的表型。结果(图4‑A)表明,erg8突变体在37℃下在YPD 和YPG 上不能生长;AoErg8转化子可以恢复37℃下的致死表型。此外,测量了30℃液体培养基中对照和所有转化子的麦角甾醇含量。当YPG 诱导转化基因时,AoErg8/erg8转化子的麦角甾醇含量与突变体相比有所增加(图4‑B)。因此,AoErg8可以部分恢复erg8突变体中麦角甾醇的含量,进一步说明AoErg8可以恢复erg8突变体的温度敏感性表型。

图4 AoErg8 可以恢复酿酒酵母erg8 突变体的表型Fig. 4 AoErg8 may restore the phenotype of Saccharomyces cerevisiae erg8 mutant
2.4 AoErg8过表达表型及对麦角甾醇的影响
将构建的pEX2B‑AoErg8‑DsRed 载体转化米曲霉,过表达米曲霉AoErg8。转化子马铃薯葡萄糖琼脂(PDA)中培养,观察表型。结果(图5‑A)显示,AoErg8过表达菌株颜色加深,孢子和气生菌丝增多;从横切面可以直观观察到孢子浓密以及气生菌丝的高度增加。此外,还统计了PDA 培养基中的孢子数和菌落直径,结果(图5‑B, C)表明,AoErg8过表达菌株的孢子数和菌落直径都有所增加。由于AoErg8 参与麦角甾醇合成,还测量了AoErg8过表达菌株的麦角甾醇含量。结果(图5‑D)显示,AoErg8过表达菌株中麦角甾醇的含量降低了50%。因此,AoErg8的过表达影响了米曲霉菌株生长、孢子形成和麦角甾醇含量。
2.5 AoErg8亚细胞定位
鉴定AoErg8 亚细胞定位对于理解其功能非常重要。因此,使用红荧光蛋白DsRed 作为报告基因来研究AoErg8 在米曲霉中的亚细胞定位。DsRed基因在AoErg8的C 末端融合,以尿苷/尿嘧啶营养缺陷型作为筛选标记构建过表达载体,观察到AoErg8在细胞中均匀分布。同时,将AoErg8‑DsRed 与仅含GFP 为报告基因的pt‑PEX1‑GFP 载体(GFP 均匀定位于细胞质)共定位观察发现,绿色荧光和红色荧光完全重合,从而表明AoErg8 定位在细胞质(图6)。
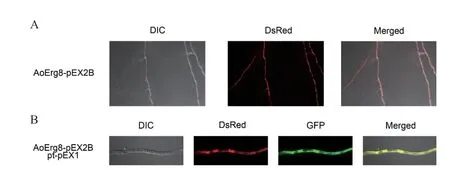
图6 AoErg8 的亚细胞定位Fig. 6 Subcellular localization of AoErg8
3 讨论
鉴定MVA 途径基因功能对MVA 途径的遗传修饰很重要。MVA 途径在生产类异戊二烯、合成橡胶商业生产的重要原料和高能生物燃料方面具有潜在的应用[16,26]。在真菌中,MVA 途径是麦角甾醇生物合成途径的上游,这在酿酒酵母中已经得到了很好的研究[27]。然而,在工业应用十分广泛的米曲霉中关于麦角甾醇生物合成途径的研究还很少。课题组前期研究表明,麦角甾醇生物合成途径在酿酒酵母和米曲霉之间是保守的,而米曲霉中的麦角甾醇生物合成基因更为复杂,有多个同源物编码相同的生物合成酶[28]。本实验室前期工作对两个MVA 途径上游的基因Erg10和Erg19及下游的Sterol 甾醇14α-去甲基酶Erg11进行了研究[2,22-23],而目前尚无关于米曲霉中Erg8基因的报道。
3.1 AoErg8在米曲霉中的功能
本研究主要对米曲霉麦角甾醇合成通路中的AoErg8基因功能进行了研究。生物信息学分析表明,AoErg8在生物进化上是保守的。据报道,橡胶树[13]、檀香木[16]、茯苓[29]等PMK 基因可恢复酿酒酵母的erg8缺失突变,独行菜[30]、紫苏[31]、鲍姆桑黄菌[18]等具有GHMP 激酶超家族多个保守结构域,说明PMK 在功能上是保守的。本研究发现,AoErg8在早期(24 h)和晚期(72 h)表达量相对较高,暗示其可能参与早期生长发育和晚期产孢这两个过程;与该结果一致的是,AoErg8过表达菌株确实影响了菌丝体的生长和产孢;酵母互补实验结果发现,AoErg8可以恢复erg8酿酒酵母突变体的温度敏感表型,证明了AoErg8在米曲霉和酵母中功能相对保守;以荧光蛋白为报告基因研究发现,AoErg8定位于细胞质中;过表达AoErg8基因不仅降低了麦角甾醇的含量,还对米曲霉孢子和菌丝的生长都有影响。
3.2 AoErg8在麦角甾醇合成通路中的功能
之前本实验室已经研究了Erg8 下游的甲羟戊酸‑5‑焦磷酸脱羧酶(Erg19),AoErg19的功能在酿酒酵母和米曲霉之间也是保守的,AoErg19 定位在液泡,过表达AoErg19对米曲霉的菌丝生长没有显著影响,但同样降低了麦角甾醇的生物合成[2],通过RT‑qPCR 证明了在AoErg19过表达菌株中AoErg8表达量下调,暗示AoErg8 可能是AoErg19过表达菌株中反馈调节的靶标。因此,进一步研究米曲霉麦角甾醇生物合成途径中的相关基因,为将来通过基因的表达调控、合成生物学等手段提高麦角甾醇的产量提供重要的科学依据。AoErg8的研究不仅对理解MVA 途径具有重要意义,而且对麦角甾醇生物合成途径也具有重要意义。
4 结论
本研究确定了AoErg8的功能、表达模式、亚细胞定位。AoErg8作为MVA 途径中的关键基因,在进化上是保守的,其能够回补酿酒酵母erg8突变体的温度敏感表型。AoErg8 定位于细胞质中,AoErg8的过表达不仅降低了麦角甾醇的生物合成,对米曲霉菌落生长和孢子形成都有一定影响,表明AoEgr8参与到米曲霉的多种生理过程。因此,对米曲霉AoErg8基因的鉴定可能为MVA 途径及麦角甾醇合成通路的遗传调控提供有价值的信息。