一株异养硝化-好氧反硝化细菌的筛选及氮转化特性研究
蒋慧慧 王强 付维来,3 饶志明 张显
(1. 巢湖学院生物与环境工程学院,合肥 238024;2. 江南大学工业生物技术教育部重点实验室,无锡 214122;3. 福建大北农华有水产科技有限公司功能饲料与养殖环境控制重点实验室,漳州 363500)
农业生产过度使用氮肥、生活和工业废水中氮的释放均可产生含氮废水,水体中高水平的氮化合物可导致富营养化和水质恶化,进而对生态平衡和人民群众的饮水安全带来威胁[1],绿色、安全、经济的废水脱氮技术亟待开发。生物脱氮法通过微生物自身代谢活动使有机氮向无机氮转化,最终形成氮气释放,相较于物理、化学脱氮具有成本低廉、安全高效和无二次污染等优点[2]。传统的生物脱氮分为硝化反应和反硝化反应两个过程,第一步由好氧自养型微生物完成硝化反应,将氨氮转化为硝态氮;第二步是反硝化菌在缺氧条件下将亚硝酸盐氮、硝酸盐氮还原成氮气的反硝化过程[3-4]。然而,新型异养硝化-好氧反硝化(heterotrophic nitrification and aerobic denitrification,HNAD)细菌可以在一个反应器中实现铵和亚硝酸盐/硝酸盐的同步去除(图1)[5],单菌脱氮进一步提高废水生物处理效率,降低运行成本和复杂性。为满足高盐[6]、低温[7-8]、高温[9]等不同环境条件下脱氮的应用需求,研究人员从不同生长环境中筛选出多种HNAD 菌,包括芽孢杆菌属(Bacillussp.)[10-11]、肠球菌属(Enteroco‑ccussp.)[12]、假单胞菌属(Pseudomonassp.)[5,13-14]、不动杆菌属(Acinetobactersp.)[15]、葡萄球菌属(Staphylococcussp.)[16]等,其中Pseudomonassp.和Bacillussp.报道较多。

图1 异养-好氧反硝化微生物氮代谢途径Fig. 1 Nitrogen metabolism pathways of HNAD microorganisms
根据 HNAD 细菌的特点,本研究从水产养殖池塘底泥中取样,分离筛选出一株转化铵态氮的微生物菌株,经16S rRNA 基因序列系统发育分析,鉴定为阿氏芽孢杆菌(Bacillusaryabhattai),通过逐步提高铵态氮的添加浓度驯化筛选菌株,提高其铵态氮的耐受能力和氨氮去除能力。进一步探索菌株氨氮降解的最佳条件,并对菌株的异养硝化-好氧反硝化特性研究,为其在水产养殖废水处理中的应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 材料来源 福建某水产养殖池塘池底的新鲜污泥。
1.1.2 培养基 DM 基本培养基(/L):C6H5Na3O75.64g,KH2PO41.5 g,Na2HPO40.42 g,MgSO4·7H2O 0.1 g,NaNO21.5 g,pH 7.0。DM 固体培养基,即在液体培养基的基础上添加2%的琼脂粉。
改良的硝化培养基(/L):C4H4Na2O48.67g、KH2PO41 g、Na2HPO40.42 g、NaCl 2 g、MgSO4·7H2O 0.1 g、NH4Cl 0.764 g、微量元素溶液2 mL,pH 7.2。
改良的反硝化培养基(/L):C4H4Na2O48.67g、KH2PO41 g、Na2HPO40.42 g、NaCl 2 g、MgSO4·7H2O 0.1 g、NaNO31.21 g(或NaNO20.99 g)、微量元素溶液2 mL,pH 7.2。
LB 培养基(/L):胰蛋白胨10 g、酵母粉5 g、NaCl 10 g。固体培养基,即在液体培养基的基础上添加2%的琼脂粉。
微量元素溶液(/L):MnCl2·4H2O 1.5 g、ZnSO41.05 g、H3BO30.3 g、(NH4)6Mo7O24·4H2O 1.1 g、CuCl2·2H2O 0.15 g、EDTA‑2Na·2H2O 5.71 g、FeSO4·7H2O 4.87 g、CaCl2·2H2O 7 g。
上述培养基在使用前需121℃高温灭菌20 min。
1.2 方法
1.2.1 菌株的分离与筛选 将来自水产养殖池底的新鲜污泥取5.0 g 加入到含有100 mL 无菌水的500mL 锥形瓶中,加入玻璃珠,于30℃、180 r/min 振荡分散。取3 mL 的菌悬液转移到含有100 mL DM培养基的烧瓶中,在30℃和180 r/min 下孵育,以富集表现良好的氨降解菌株。需氧孵育36 h 后,取3 mL 菌悬液在同等条件下进行二次富集。接种环蘸取二次富集悬液并在DM 固体培养基上划线,多次转接划线后获得单个菌落。取单菌落转接于DM 液体培养基,然后按接种量6%接种于NH4+‑N 浓度为200 mg/L 的硝化培养基,30℃、180 r/min 摇床培养。每12 h 取样一次,测定OD600nm下的菌液密度,其余样品以5 000 r/min 离心5 min,提取上清液,测定上清液的NH4+‑N 浓度,并计算氨氮去除率。综合分析菌株的生长曲线和脱氮性能,筛选出优势菌株进行形态观察、生物鉴定和氮转化特性研究。
1.2.2 菌株的鉴定 以通用引物27F(5'‑AGAGTT TGATCMTGGCTCAG‑3')和1492R(5'‑CGGTTACCT TGTTACGACTT‑ 3')扩增菌株的16S rRNA 基因。将PCR 扩增产物送至苏州金唯智生物科技有限公司测序,将测序获得的基因序列与GenBank 中已有序列进行比对,并用MEGA11 建立系统发育树。
1.2.3 菌株的驯化 用接种环挑取单菌落,接种到含有10 mL 液体LB 的50 mL 锥形瓶中,以30℃和180 r/min 振荡培养12 h。然后,取3 mL 菌液置于无菌EP 管中,8 000 r/min 离心5 min,用无菌生理盐水洗涤2 次,将洗涤后的菌液按6%接种量接种于 NH4+‑N 浓度为200 mg/L 的硝化培养基中,30℃、180 r/min 培养24 h,开始适应性驯化。每个浓度循环转移数次,直到菌株适应此浓度环境,然后将菌液转移到下一个梯度硝化培养基(NH4+‑N 浓度为400 mg/L、600 mg/L)中,接种量依然为6%,直到菌株不再显著降解氨氮。定期采样并检测OD600nm和NH4+‑N 浓度。驯化获得突变株用于后续脱氮性能试验。
1.2.4 影响菌株脱氮性能的单因素实验 分别研究氨氮浓度、碳源、碳氮比、初始pH 和培养温度对菌株氨氮降解的影响。以丁二酸钠为碳源、氯化铵为氮源,配置氯化铵浓度分别为200、400、600、800 mg/L 的改良的硝化培养基。在50 mL 培养基中分别接种6%的活化菌株。30℃、180 r/min 振荡培养72 h 以上。每隔12 h 取一次样,分光光度计测定菌液密度(OD600nm),离心取上清后测定NH4+‑N 浓度,并计算氨氮降解率。分别选择碳源:丁二酸钠、柠檬酸三钠、丙三醇、甲醇;碳氮比5∶1、10∶1、15∶1、20∶1;初始pH 为6.0、7.0、7.5 和8.5;温度为20℃、25℃、30℃ 和35℃,以氯化铵为氮源,接种量及培养条件同上,每12 h 取样后测定菌液密度及上清液的NH4+‑N 浓度。
1.2.5 菌株的异养硝化-好氧反硝化特性研究 按6%接种量分别在50 mL NH4+‑N 浓度为200 mg/L 的硝化培养基和NO3‑‑N 浓度为200 mg/L 的反硝化培养基中接种。30℃、180 r/min 振荡培养72 h 以上。12 h 取样一次,OD600nm测定菌液密度,离心取上清后测定上清液中的NH4+‑N、NO2‑‑N、NO3‑‑N 和TN 浓度,并计算相应氮去除率。
1.2.6 氮元素浓度测定 本实验中NH4+‑N、NO3-‑N、NO2-‑N 和TN 浓度是通过水质测定仪(烟台海洋启恒环保技术有限公司HX‑C 型)进行检测的。以NH4+‑N 浓度测定为例,打开主机电源将测定指标设定为氨氮,选择量程为5-50 mg/L 的1 号曲线;取5 mL 蒸馏水做空白样,待测试管中加入0.5 mL 待测样品和4.5 mL 蒸馏水。向空白试管和各待测试管中加入两滴氨氮1 试剂,再加入两滴氨氮2 试剂;混匀后静置10 min,比色并记录测定结果。NO3-‑N 和NO2-‑N 浓度测定时,只需将测定指标设定为硝酸盐氮或亚硝酸盐氮,选择合适量程,分别添加硝酸盐氮试剂或亚硝氮试剂,其余操作参考同上。
TN 浓度测定,先打开消解仪电源,设置总氮指标消解(125℃,30 min),启动升温;打开测定仪电源,将测定指标设定为总氮,选择量程为20-100 mg/L的1 号曲线;取2 mL 蒸馏水做空白样,向待测试管中加入0.4 mL 样品(可稀释),再加入1.6 mL 蒸馏水;向空白试管和各待测试管依次加入1 mL TN1 试剂,混匀后插入恒温的消解仪加热孔内进行消解;消解完成后,冷却至室温。再依次向各管加入0.5 mL TN2 试剂,混匀即为消解液;分别移取1 mL 消解液加入到4 mL TN3 试剂中,混匀后静置,15 min后比色测定。
2 结果
2.1 异养硝化-好氧反硝化菌的筛选
从养殖池底污泥中筛选出5 株具有亚硝酸盐转化功能的菌株,分别命名为JN01-05。将其转接至改良的硝化培养基中,获得的生长曲线如图2‑A 所示。JN01 的生长速率远高于其他菌株,其次是JN04和JN05。各菌株在以NH4+‑N 为氮源的培养基中的氨降解率如图2‑B,在200 mg/L 氨氮浓度和摇瓶发酵72 h 时,JN01 的氨氮去除率达到75.79%,高于JN04 的62.48%,而其他3 株菌的降解效率均低于30%。综合考虑菌株的生长速率和脱氮性能,发现菌株JN01 具有较高的氨氮降解能力,菌种保藏后用于后续菌种鉴定和脱氮性能试验。

图2 不同菌株的生长曲线(A)和NH4+-N 的去除效率(B)Fig. 2 Growth curves(A)and NH4+-N removal efficiencies(B)of different strains
2.2 菌落形态和系统发育树
菌株JN01 可形成单一菌落,白色,表面粗糙,边缘不规则;电子显微镜下观察其形态呈长杆状。PCR 获得菌株JN01 的部分16S rRNA,测序后获得序列,基于GenBank 数据库,通过在NCBI 网站上进行同源序列比较,建立了系统发育树(图3)。菌株JN01 与芽孢杆菌属的关系最密切,因此菌株被鉴定为阿氏芽孢杆菌(Bacillusaryabhattai)JN01。
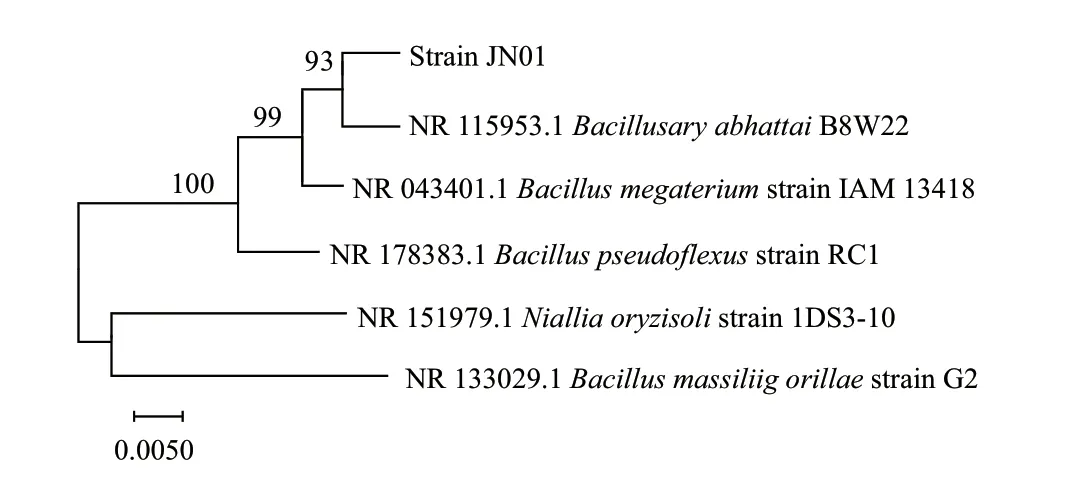
图3 菌株JN01 的系统进化树Fig. 3 Phylogenetic tree of the strain JN01
2.3 菌株的驯化
采用氨氮递增法对菌株JN01 的耐铵态性进行了驯化。驯化前,菌株JN01 在培养基内的NH4+‑N 浓度为200 mg/L 的条件下,24 h 内的生长速度最快,培养60 h 时OD600nm达到最大值1.701,如图4‑A。当NH4+‑N 浓度为600 mg/L 时,菌株生长受到明显抑制,最大菌体密度仅0.768。驯化前的最高氨氮去除率为菌株在NH4+‑N 浓度为200 mg/L 时达到70.18%,最低为NH4+‑N 浓度为600 mg/L 时仅有35.74%,如图4‑B。驯化后,菌株的生长、氨氮去除率均有不同程度提高,在NH4+‑N 浓度为200 mg/L 的条件下,菌体OD600nm最高为2.645,同时氮去除率最高87.29%;NH4+‑N 浓度为600 mg/L 时,OD600nm为1.261,氨氮去除率增加为44.72%。通过驯化,菌株JN01 对铵态氮的耐受能力进一步提升,可用于高浓度NH4+‑N 水样的脱氮处理。
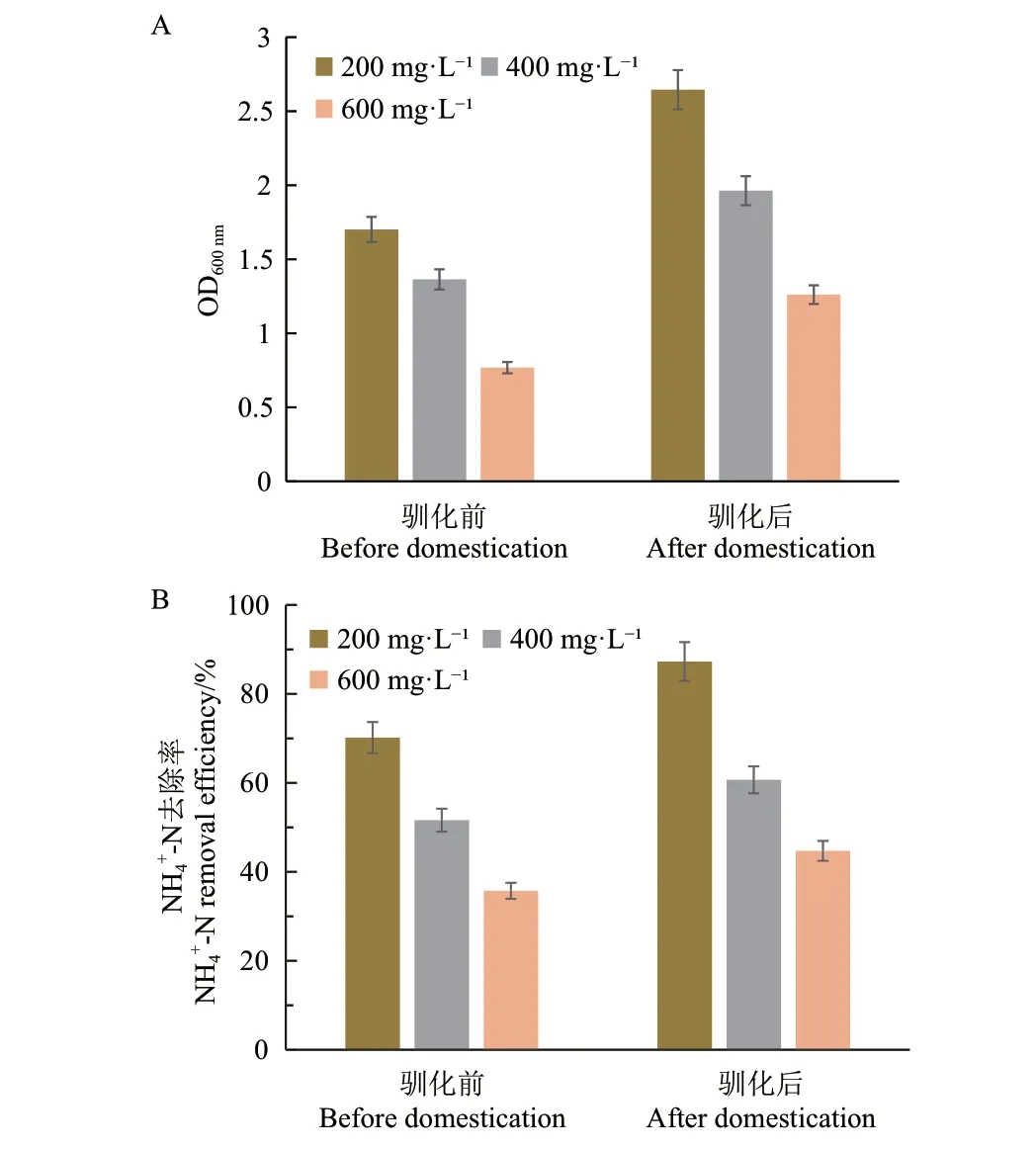
图4 菌株JN01 驯化前后的 OD600 nm(A)和 NH4+-N 去除效率(B)的变化Fig. 4 Variation of OD600 nm(A)and NH4+-N removal efficiency(B)before and after the domestication of B. aryabhattai JN01
2.4 影响菌株脱氮特性的单因素研究
2.4.1 不同氨氮浓度对NH4+‑N 去除率的影响 为研究不同氨氮浓度对菌株 JN01 生长速率和降解铵态氮的影响,选择NH4+‑N 浓度为200、400、600、800 mg/L 进行氨降解实验。结果如图5 所示,NH4+‑N 浓度越高,菌株JN01 的生长速率受到抑制,氨氮降解率也随之降低。NH4+‑N 浓度为200 mg/L 时,菌株JN01 的OD600nm在36 h 时达到2.267 后进入生长稳定期,表明低浓度下铵态氮能较好的被菌株吸收利用,满足菌体的生长,并获得84.72%的铵态氮去除效率。
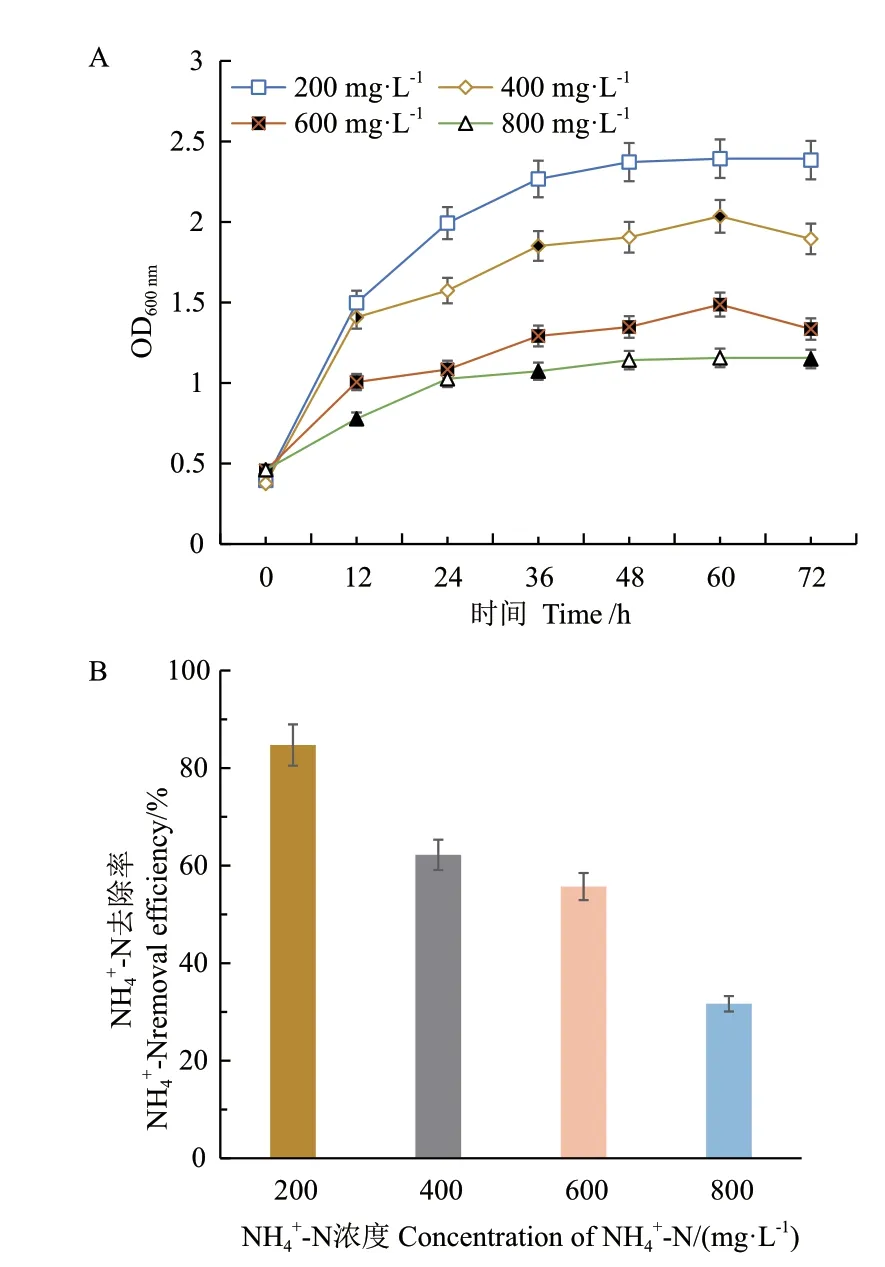
图5 不同氮源浓度对菌株JN01 的OD600 nm(A)和NH4+-N 去除率(B)的影响Fig. 5 Effects of N concentration on the growth characteristics OD600 nm(A)and NH4+-N removal efficiencies(B)of B. aryabhattai JN01
2.4.2 不同碳源对NH4+‑N 去除率的影响 为探究菌株JN01 的最佳碳源,在NH4+‑N 浓度为200 mg/L 时,选择丁二酸钠、柠檬酸三钠、丙三醇和甲醇作为实验碳源。如图6 所示,菌株JN01 在使用丙三醇、丁二酸钠和柠檬酸三钠时生长效果更好,当碳源为甲醇时,菌株的生长速率明显降低,可见不同碳源对菌株JN01 的生长影响存在较大差异。其中,丙三醇为碳源时,菌株JN01 的OD600nm最高达3.172,而以甲醇为碳源时培养60 h OD600nm仅0.709。对各碳源条件下,菌株JN01 对铵态氮的降解效果进行比较,可以明显看到菌株JN01 在含丁二酸钠的硝化培养基中NH4+‑N 的去除率最高,为87.13%,其次是柠檬酸三钠为碳源时,获得83.54%的铵态氮去除率。其他两种碳源条件下,NH4+‑N 去除率均不高于40%。综合考虑菌株的生长情况和NH4+‑N 去除率,选择丁二酸钠为最佳碳源用于后续脱氮实验。

图6 不同碳源对菌株JN01 的OD600 nm(A)和NH4+-N 去除率(B)的影响Fig. 6 Effects of different carbon sources on the growth characteristics OD600 nm(A)and NH4+-N removal efficiencies(B)of B. aryabhattai JN01
2.4.3 不同碳氮比对NH4+‑N 去除率的影响 为探明菌株JN01 氨氮代谢的最佳初始碳源浓度,选择氮源浓度为200 mg/L,最佳碳源为丁二酸钠,分别控制C/N 比为5∶1、10∶1、15∶1 和20∶1,记录培养72 h 的OD600nm和NH4+‑N 浓度。实验结果如图7 所示,当C/N 为5∶1 时,OD600nm最高为1.758,NH4+‑N 浓度为79.44 mg/L,NH4+‑N 去除率为60.28%;当C/N为10∶1 和15∶1 时,由于碳浓度增加,菌株的生长更加旺盛,NH4+‑N 的降解率也随之提高,C/N为15∶1 时,NH4+‑N 浓度降至18.52 mg/L,降解率为90.74%,此时菌株OD600nm为2.776。C/N 增加到20∶1 时,菌株JN01 对NH4+‑N 降解效率没有明显提高,OD600nm也与C/N 为15∶1 时相差不大。在成本控制的原则下,选择C/N 为15∶1 继续进行后续单因素实验。
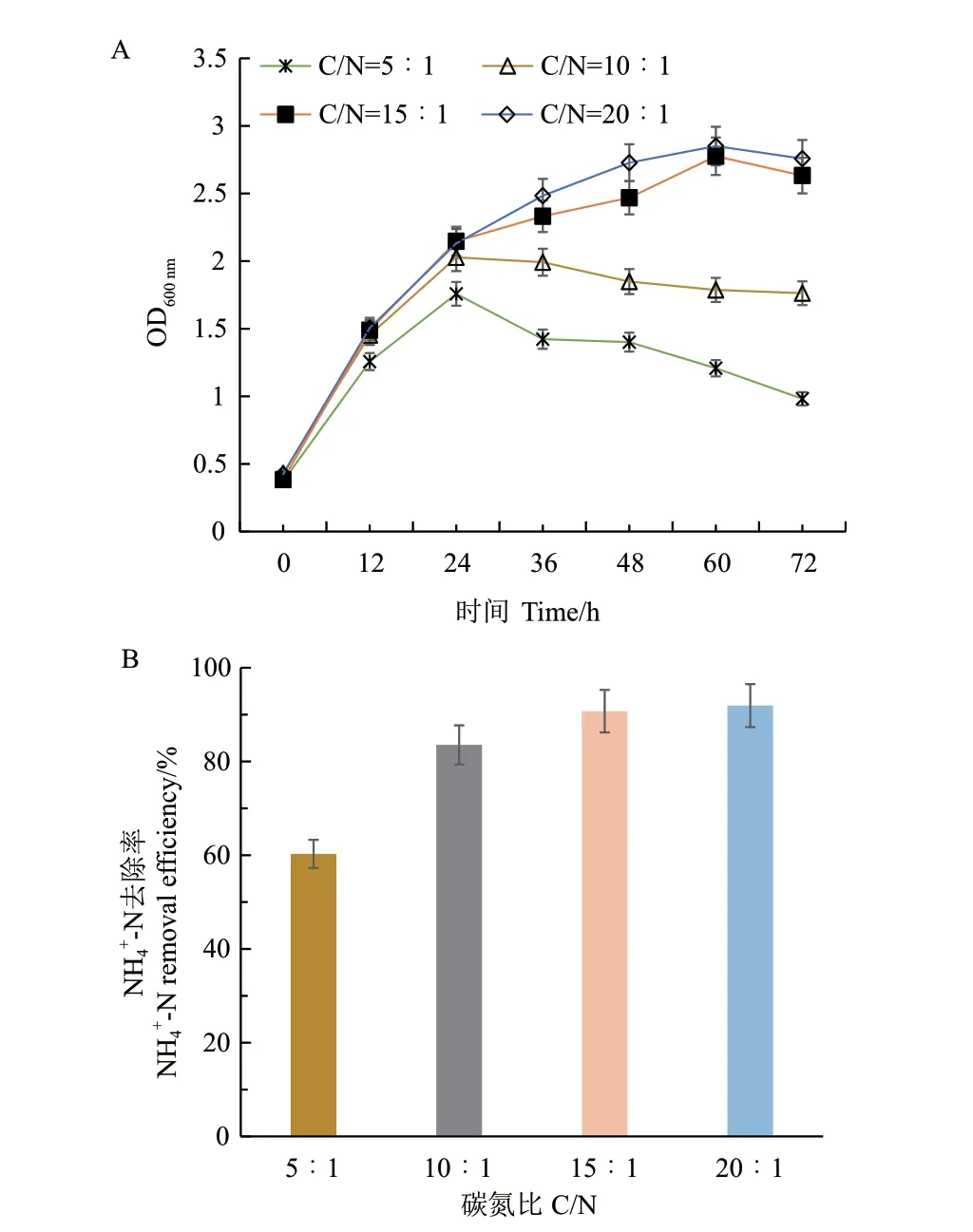
图7 C/N 对菌株JN01 的OD600 nm(A)和NH4+-N 去除率(B)的影响Fig. 7 Effects of C/N on the growth performance OD600 nm(A)and NH4+-N removal efficiencies(B)of B.aryabhattai JN01
2.4.4 初始pH 对NH4+‑N 去除率的影响 为研究pH对菌株 JN01 生长和氨氮去除效率的影响,设置初始pH 为6.0、7.0、7.5 和8.5。结果(图8)显示,菌株 JN01 在初始 pH 值为 7.0 和 7.5 的硝化培养基中生长良好,NH4+‑N 的去除率都在90%以上,其中,pH 为7.5 时,菌株生长最好,60 h 的OD600nm达到2.792,同时NH4+‑N 去除率是92.37%。pH 为6.0 时,菌株JN01 的生长明显受到抑制,对数生长期较短,且最高OD600nm仅1.584,NH4+‑N 去除率约60%。
2.4.5 培养温度对NH4+‑N 去除率的影响 菌株JN01 的细胞生长和铵态氮的去除受温度影响程度如图9,结果表明,在20-35℃范围内,较高的温度有利于提高HNAD 的性能。经过72 h 的培养,在30℃条件下,NH4+‑N 去除率达到92.78%,但在20℃和25℃条件下,去除率分别只有74.55%和82.08%。
2.5 菌株的异养硝化-好氧反硝化特性研究
分别将菌株JN01 接种于NH4+‑N 浓度为200 mg/L 的异养硝化培养基和NO2-‑N 浓度为200 mg/L的好氧反硝化培养基中,菌株的生长情况及NH4+‑N、NO3-‑N、NO2-‑N 和TN 变化趋势见图10。以NH4+‑N为氮源时,如图10‑A,24 h 内NH4+‑N 的浓度明显下降,且菌株在24 h 内的生长速度最快,OD600nm在60 h 时达到最大值2.636,之后处于稳定期。72 h 内,培养基内的NH4+‑N 和TN 分别降至31.87 mg/L 和38.55 mg/L,降解率分别为84.07%和80.73%。异养硝化过程中NO3-‑N 逐渐上升,NO2-‑N 呈现先上升后下降的趋势。
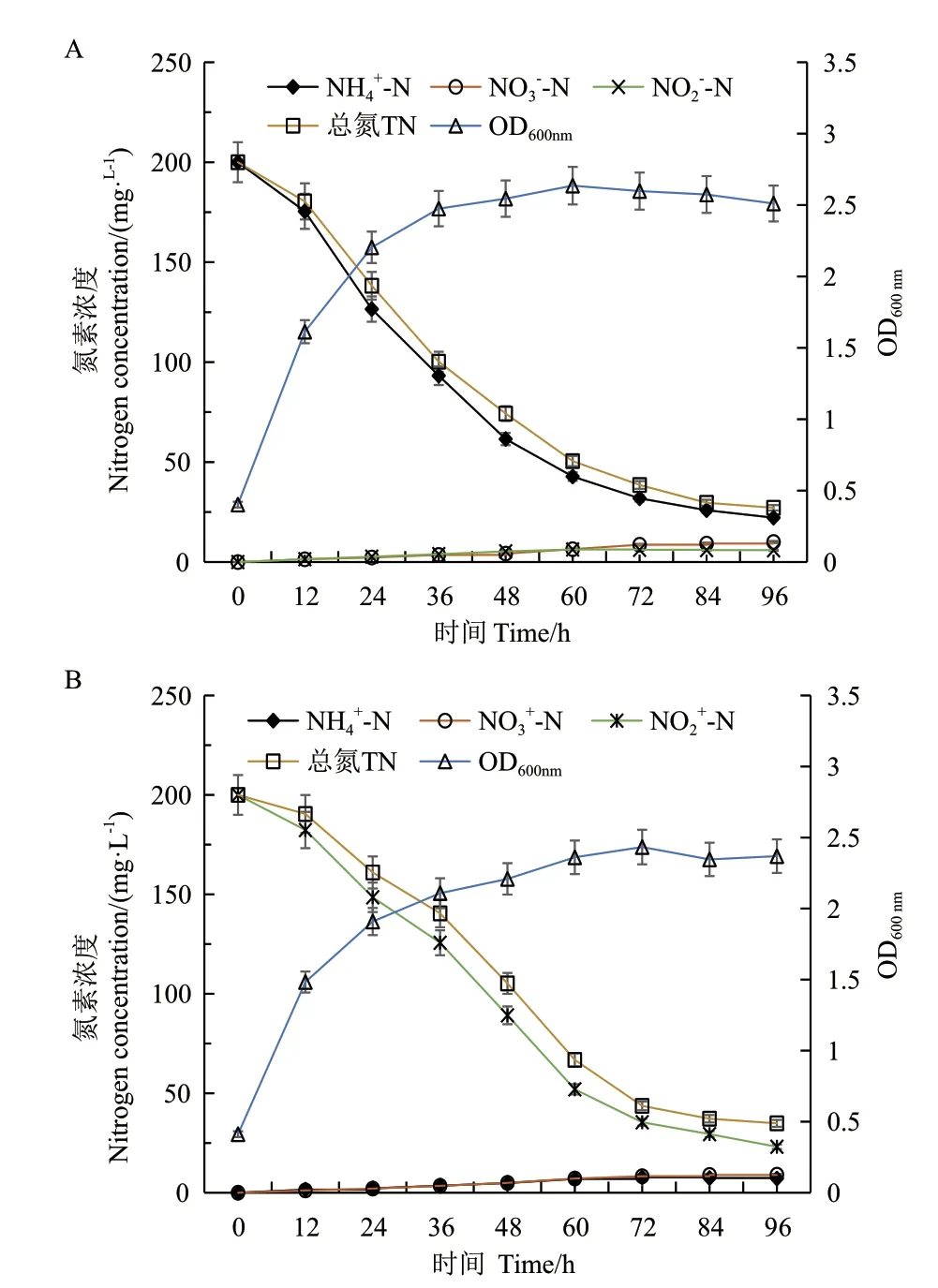
图10 菌株JN01 在铵态氮(A)和亚硝态氮(B)为唯一Fig. 10 Growth characteristics of strain JN01 and trends of NH4+-N, NO3--N, NO2--N, TN with initial NH4+-N(A) or initial NO2--N (B) as sole nitrogen source
NO2-‑N 为氮源时,如图10‑B,菌株JN01 适应时间相对较长,24 h 后NO2-‑N 的浓度开始有较明显下降。菌株72 h 后进入生长稳定期,OD600nm最高达到2.433,此时NO2-‑N 浓度降至35.41 mg/L,降解率为82.30%,TN 从200 mg/L 降至43.64 mg/L,TN 的降解率为78.18%。好氧反硝化过程中NO3-‑N 逐渐上升,NH4+‑N 先上升后下降。
3 讨论
HNAD 菌对不同氮源的降解情况不尽相同,表1 列举了部分HNAD 菌对NH4+‑N、NO3-‑N、NO2-‑N 和总氮的降解情况。由表可知,大多数菌株来源于水体(含污泥)或土壤,以芽孢杆菌属的相关研究报道最多;从氮去除率来看,Pseudomonas alcaliphila对NH4+‑N、NO3-‑N 和NO2-‑N 均 具 有100%的去除率[7],其他菌株多表现为异养硝化或好氧反硝化性能突出,如Bacillus thuringiensisWXN‑23[11]和Halomonas venustaTJPU05[6]对NO2-‑N 的去除率达100%,而对NH4+‑N 的去除率低于87%。B.aryabhattaiJN01 具有良好的异养硝化能力,与其他具有HNAD 特性的芽孢杆菌属细菌相比,其对NH4+‑N 的降解率仅次于Bacillus cereusGS‑5[17],后者是利用研制的填料床生物反应器固定菌株,并在生物反应器中多层交替填充,降解处理过程复杂,降解成本高。菌株JN01 对NO2-‑N 和总氮的去除率处于中等水平,综合NH4+‑N 的去除情况,B.aryabhattaiJN01 在芽孢杆菌属中具有良好的异养硝化和好氧反硝化特性。

表1 HNAD 菌对NH4+-N、NO3--N、NO2--N 和TN 的去除情况Table 1 Removal efficiencies of NH4+-N, NO3--N, NO2--N and TN by HNAD microorganisms
硝化过程是氮化合物转化的开始,会受到铵态氮浓度的影响。NH4+‑N 浓度越高,菌株JN01 的生长速率受到抑制,氨氮降解率也随之降低,这表明氮源浓度能够显著影响菌株JN01 的生长和氮代谢,即高浓度的铵态氮抑制了硝化过程,这一结果与Marek 等[23]的研究结果一致,即高浓度的NH4+‑N 对微生物细胞产生胁迫作用。同理,虽然P.alcaliphila[7]和Glutamicibactersp. WS1[22]对NH4+‑N的去除率达到100%,但两者处理的初始氨氮浓度分别为150 mg/L 和45 mg/L,若将浓度增加到200 mg/L,相应菌株的脱氮性能极有可能受到不同程度的影响。
碳源可以为细胞生长提供碳骨架元素,并为细胞代谢提供能量。根据好氧反硝化细菌的代谢特点,合适的碳源不仅可以加快菌体生长速率,还可以为好氧反硝化这一氧化还原反应过程提供充足的电子供体[10]。不同碳源的化学结构和分子量对反硝化效率有显著影响,有研究指出菌株一般倾向于利用化学结构简单、分子量小的碳源,如乙酸钠[24]、琥珀酸钠[14]、和柠檬酸钠[16]等,也有以蔗糖[12]、葡萄糖[10,25]等为碳源的报道。菌株JN01 的生长与NH4+‑N 降解趋势存在一定程度的相关性。菌株在丙三醇中生长旺盛可能是丙三醇进入糖酵解途径,为菌株生长提供充足能量。以丁二酸钠和柠檬酸三钠为碳源的培养基中,菌株JN01 的生长状况良好,铵态氮降解效果也较好,这可能是因为丁二酸和柠檬酸是三羧酸循环的中间代谢物[26],易于直接被菌体细胞所利用。碳源的浓度会直接影响菌株的生长和好氧反硝化性能[27]。过低的碳源浓度不仅不能满足菌体生长的需求,还无法提供氮代谢过程中的有效电子,使菌体的物质代谢和能量代谢同时受限;过高的碳源浓度会增加培养成本,也会带来资源浪费。综合菌株生长及NH4+‑N 去除率,说明在一定 C/N 范围内,碳源浓度越高,能量供应越充分,好氧反硝化效果越好,这与Patureau 等[28]的研究结论一致。
大多数HNAD 细菌具有较宽泛的pH 适应范围,但进行好氧反硝化代谢的最适pH 一般为中性或弱碱性[29]。pH 为7.5 时,菌株JN01 生长最好,NH4+‑N 去除率也最高,这可能是由于弱碱性培养条件下部分NH4+转化为NH3,后者以游离的状态更利于细菌进行氨氮代谢[30]。综合分析菌体生长情况和NH4+‑N 去除率发现,中性至弱碱性培养基更利于菌株 JN01 生长和进行氨氮代谢,这一结论与Glutamicibactersp. WS1[22]类似。细菌可以在很宽的温度范围内生存,对于HNAD 细菌来说,温度不仅影响其生长,还对好氧反硝化效率产生影响。Zhang等[31]指出NH4+‑N 向N2的转化是由与硝化和反硝化相关的功能酶催化的,其活性极易受到温度变化的影响,因此极端温度不利于绝大多数HNAD 细菌的生长和代谢。菌株JN01 的最适生长温度和最佳NH4+‑N 去除温度一致,均为30℃,这一结果与假单胞菌 NP5[26]和不动杆菌C‑13[32]相似,可见菌株的氨氮降解与细菌生长密切相关。
废水处理过程中铵态氮和亚硝态氮往往同时存在,尤其是在处理水产养殖废水时,氨氮和亚硝态氮同时超标的情况经常遇到。综合分析比较两种氮源条件下菌株的生长情况和脱氮能力,菌株JN01 可以在氮起始浓度为200 mg/L 的条件下保持较高的脱氮性能,其中在以NH4+‑N 为唯一氮源时,生长速率更快,表现出良好的异养硝化特性;而NO2-‑N 为唯一氮源时,生长速率和脱氮性能稍弱,但仍保持在较高水平,略高于B. simplexH‑b[19]。综上,菌株JN01 兼具异养硝化和好氧反硝化特性,可适用于氨氮和亚硝酸盐超标的含氮废水的处理。氮源培养时的生长曲线及NH4+-N、NO3--N、NO2--N 和TN 变化趋势
4 结论
从福建某水产养殖池底的新鲜污泥中分离筛选到一株氨氮降解菌JN01,通过 16S rRNA 鉴定为阿氏芽孢杆菌(B.aryabhattai)。采用氨氮递增法对菌株进行驯化,最高氨氮去除率由驯化前的70.18%提升到87.29%。以丁二酸钠为碳源、碳氮比为15∶1、初始pH 7.5、培养温度30℃,氨氮添加浓度200.0 mg/L 时NH4+‑N 去除率达到 92.78%。另外,在亚硝态氮为唯一氮源的条件下,菌株JN01 对NO2-‑N 降解率可以达到82.30%。综上,B.aryabhattaiJN01 能分别利用铵态氮和亚硝态氮作单一氮源,并具有较好的生长性能和氮去除率。