同步放化疗联合抗EGFR药物对局部晚期食管癌疗效的Meta分析
柳 颖,孔德九,胡晓辰,张嘉诚,申 深,张杰冲,原 翔,王新帅
食管癌(esophageal cancer,EC)在全球肿瘤发生率中排名第六,据统计在2020年全球约有60.4万例新发食管癌病例,约有54.4万人死于食管癌,其发病率为3.1%,死亡率高于其他癌症(5.5%)[1]。2020年中国新增食管癌死亡病例约30.1万例,占全球死亡病例的50%以上,居中国恶性肿瘤死因第4位[2]。因此,食管癌也是严重威胁人民健康的主要恶性肿瘤之一。目前食管癌的治疗方式有手术、化疗、放疗、靶向治疗和免疫治疗等,其中,手术切除病灶是早期及局部晚期食管癌的主要的治疗方法[3],但早期食管癌通常较难发现,患者发现时多处于中晚期[4],错过了手术治疗的最佳时机。越来越多的专家认为,对于局部晚期的患者进行根治性同步放化疗可能是较为有效的方案,但如何提高同步放化疗疗效仍需探索。
基于癌症相关基因突变DNA测序的靶向治疗已成为目前研究的重点,这些靶点包括信号通路中的特异性基因突变,如血管内皮生长因子(vascular epidermal growth factor,VEGF)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、受体酪氨酸蛋白激酶erbB-2相关的基因突变,目前靶向治疗食管癌的临床研究主要针对EGFR这一靶点[5]。EGFR是一种跨膜蛋白,由一个胞外配体结合结构域(extra-cellular domain,ECD)、一个跨膜结构域(transmembrane domain,TD)、一个近膜(juxtamembrane,JM)片段、一个酪氨酸激酶结构域(tyrosine kinase domain,TKD)和一个羧基端调控尾巴组成[6-7],配体结合引起的构象变化导致TKD的自磷酸化和反式磷酸化,随后招募适配器蛋白,如Src同源结构域(src homology-2,SH2)或磷酸酪氨酸结合结构域,这些结构域激活细胞存活和增殖所必需的下游通路[8-9]。尽管EGFR在一系列非恶性组织中表达,包括皮肤和胃肠道组织,但它在多个上皮性癌症中过表达,EGFR蛋白在50%的食管癌中高表达,在约30%的病例中发生基因扩增[9],因此,EGFR信号通路在食管癌的发生和发展中起着重要作用,可作为一个治疗靶点。
临床上使用的EGFR抑制剂主要包括两大类,一类以厄洛替尼、吉非替尼等酪氨酸激酶抑制剂(tyrosine-kinase Inhibitor,TKI)为代表,一类以西妥昔单抗、帕尼单抗等作用于受体胞外区的单克隆抗体(monoclonal antibodies,mAbs)为代表。有临床研究表明分子靶向治疗联合同步放化疗可以进一步提高食管癌患者近期疗效和生存率[10],也有研究无法证实同步放化疗联合靶向药物可使晚期食管癌患者获益。因此,晚期不可手术的食管癌患者在同步放化疗的基础上是否联合靶向治疗仍需进一步探索。本研究纳入厄洛替尼、吉非替尼、西妥昔单抗、帕尼单抗这4种EGFR抑制剂,分别联合同步放化疗治疗晚期食管癌,采用Meta分析评估治疗的有效性。
1 材料与方法
1.1 文献检索策略
本研究搜索了中文和英文的数据库。中文数据库包括中国知网(China national knowledge infrastructure,CNKI)、维普中文期刊和万方医学期刊。使用主题词和自由词的组合,以“食管癌”“同步放化疗”“厄洛替尼”“吉非替尼”“西妥昔单抗”“帕尼单抗”为关键词。外文的数据库包括PubMed、Embase、Cochrane Library、Web of Science,以“esophagus cancer”“Chemoradiotherapy”“Erlotinib”“gefitinib” “cetuximab”“Panitumumab”为关键词,检索范围为建库至2022年4月20日的相关文献,结合医学主题标题(MeSH)术语进行调整,并针对相关参考文献采用手工扩大检索。
1.2 纳入与排除标准
纳入标准:①纳入文献为自建库至2022年4月间发表的研究类型文章,语种为中文和英文;②文献类型为随机对照试验(randomized controlled trial,RCT);③研究对象是病理报告提示食管癌的患者,临床评估为失去了手术切除的机会,没有放化疗禁忌症;④试验组:使用抗EGFR药物联合同步放化疗,对照组:同步放化疗不联合EGFR药物;⑤试验组和对照组的各基因型数据能够有效地计算HR和95%CI;⑥研究可评价患者的OS。
排除标准:重复报道、质量差等不可用文献,重复发表或相似数据的研究仅纳入质量较好者。
1.3 方法学质量评价
使用Jadad量表对纳入的文献进行质量评价,并采用2人独立评价的方法,当评价结果存在分歧时,则选择另一位研究者参与评价,尽可能做到文献质量评价客观。评价条目有:①随机序列产生(3分);②随机化隐藏(3分);③盲法(3分);④撤出与退出(1分)。1~3分视为低质量,4~7分视为高质量。纳入的文献需≥4分。
1.4 资料提取
提取的数据信息包括:①被纳入研究的基本信息,包括第一作者的姓名、发表时间、文献类型等;②患者的基本特征,包括患者中位年龄、使用的化疗药物及放疗剂量、联合的靶向药物等;③研究的结局测量指标,包括OS。见表1。
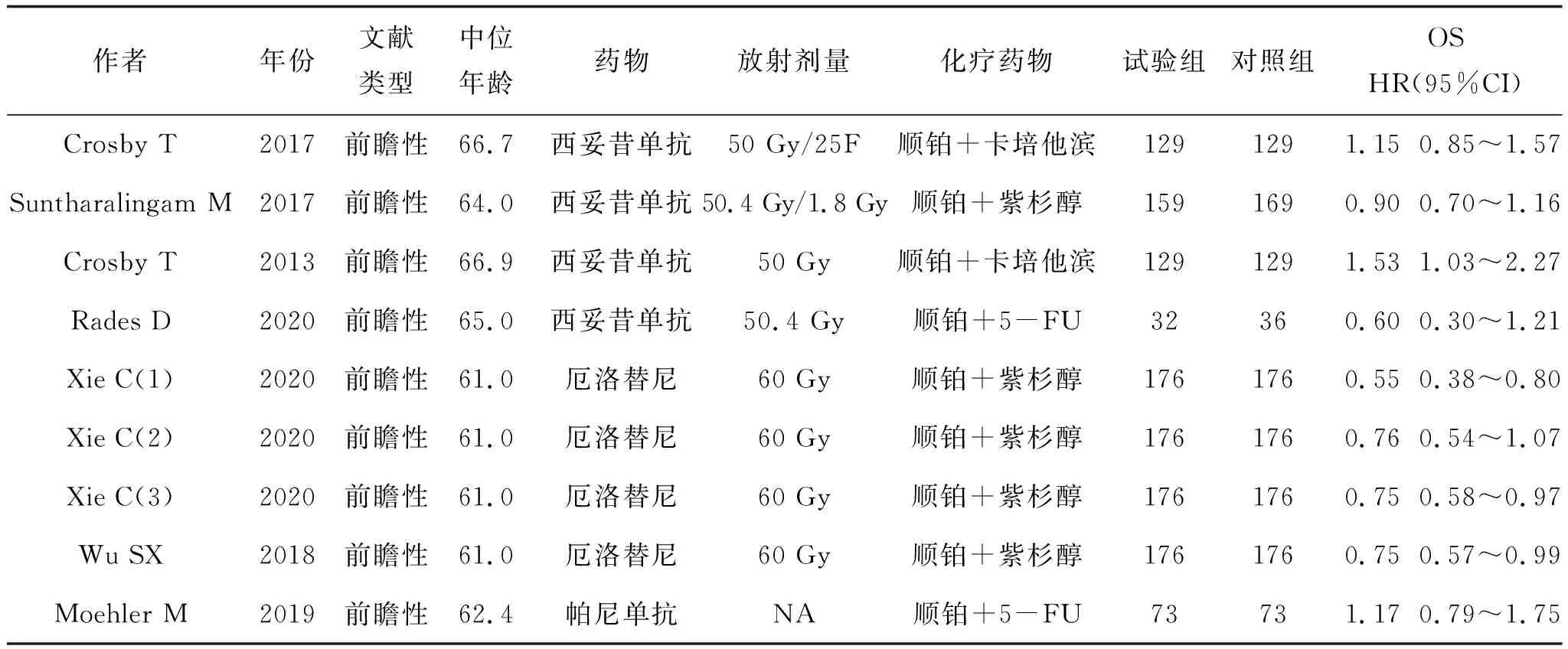
表1 资料提取
1.5 偏倚风险
考虑到可能存在发表偏倚等会造成Meta分析出现异质性因素,因此本文对所纳入异质性较高的数据制作漏斗图观察发表偏倚。
1.6 统计学分析
采用RevMan 5.4.1统计软件进行Meta分析。P<0.05可认为具有统计学差异,进一步的异质性使用Q检验进行评估,并使用I2进行量化,当P<0.05且I2>50%时,选用随机效应模型;否则,使用固定效应模型进行分析。计数资料采用风险比率(hazard ratio,HR)及其95%置信区间(confidenceinterval,CI)代表效应,Meta分析的检验水平为α=0.05。
2 结果
2.1 文献检索结果
初步检索共纳入359篇相关文献。通过数据库搜索发现评估同步放化疗联合厄洛替尼、吉非替尼、西妥昔单抗、帕尼单抗治疗食管癌有效性和安全性的潜在研究96篇,在进一步仔细阅读全文后,最终纳入7篇文献,包含10组临床对照试验[11-18],涉及样本量为1 806例患者,其中实验组896例,对照组910例。纳入的7篇文献Jadad量表评分均为4分及以上,属于高质量文献。
2.2 Meta分析结果
2.2.1 同步放化疗联合靶向药物的OS
纳入的研究中,7项研究共9组实验数据报道了HR,经异质性检验(chi2=23.22,P=0.003,I2=66%)提示方差不齐,表明这些研究是异质性的,因此使用随机效应模型进行Meta分析。结果显示,试验组HR低于对照组,差异无统计学意义(HR=0.87,95%CI:0.72~1.06,P=0.17)。见表2。因考虑到此结果异质性较大,故进行了亚组分析。
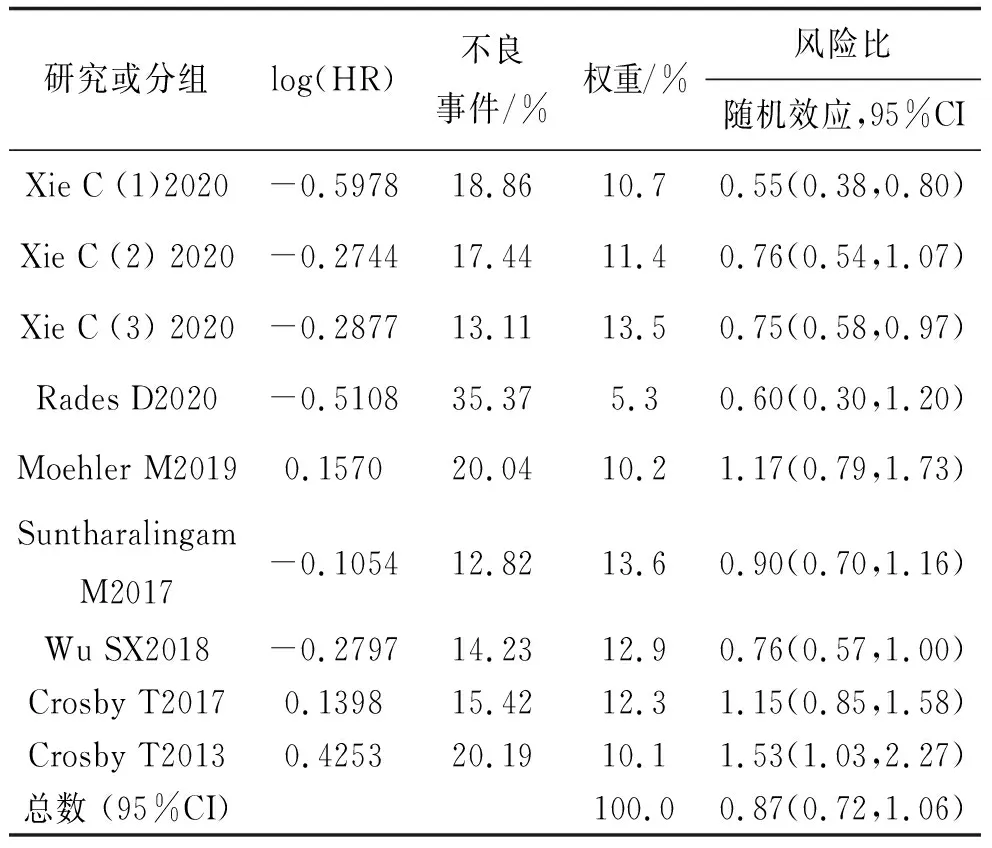
表2 同步放化疗联合靶向药物纳入文献及相关分析
2.2.2 同步放化疗联合厄洛替尼的OS
纳入的研究中,2项研究共4组实验数据报道了HR,经异质性检验(chi2=2.34,P=0.50,I2=0%)提示方差齐,研究间几乎没有异质性,因此使用固定效应模型进行Meta分析。结果表明,试验组的HR低于对照组,差异有统计学意义(HR=0.72,95%CI:0.62~0.83,P<0.0001)。见表3。

表3 同步放化疗联合厄洛替尼纳入文献及相关分析
2.2.3 同步放化疗联合西妥昔单抗的OS
纳入的研究中,4项研究共4组实验数据报道了HR,经异质性检验(chi2=7.77,P=0.05,I2=61%)提示方差不齐,研究之间是异质的,因此选择随机效应模型进行Meta分析。结果发现,试验组的HR高于对照组,差异无统计学意义(HR=1.05,95%CI:0.78~1.41,P=0.77)。见表4。
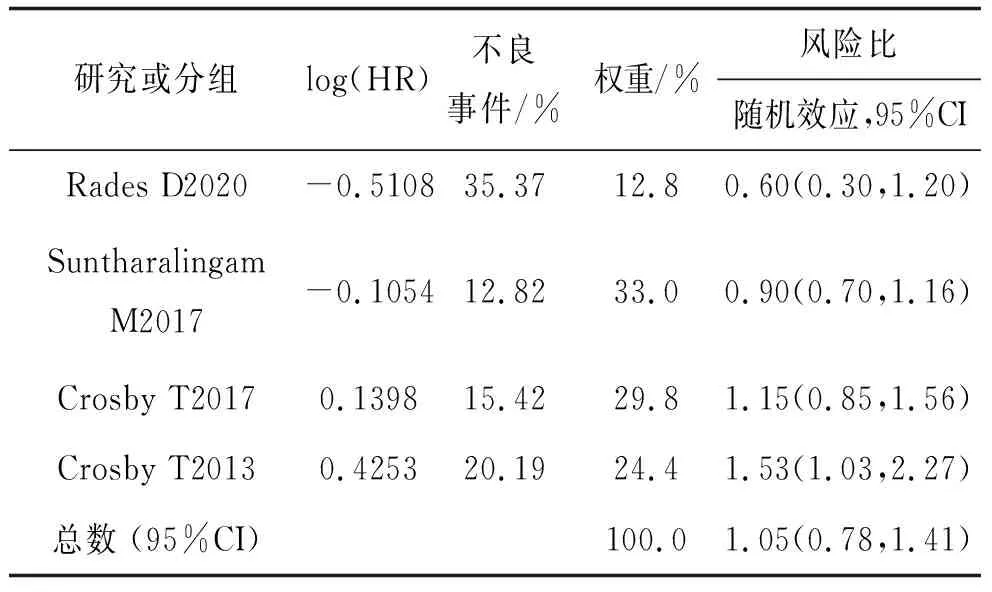
表4 同步放化疗联合西妥昔单抗纳入文献及相关分析
2.3 发表偏倚
使用HR作为效应指标,生成所有纳入文献数据的漏斗图,漏斗图中各点分布基本对称,提示偏移可控。见图1。

A:联合靶向药物;B:联合厄洛替尼;C:联合西妥昔单抗。图1 同步放化疗联合抗EGFR药物各亚组OS的发表偏倚漏斗图
3 讨论
对于晚期不可手术食管癌患者,同步放化疗可提高治疗效果,改善预后,延长生存期,本研究纳入厄洛替尼、吉非替尼、西妥昔单抗、帕尼单抗这四种EGFR抑制剂,Meta分析来评估其联合同步放化疗治疗晚期食管癌的疗效。经过严格筛选,本研究最终成功纳入9项相关临床试验,并逐步进行Meta分析。结果发现,对于晚期食管癌患者,同步放化疗联合靶向药物在患者OS方面差异无统计学意义(HR=0.87,95%CI:0.72~1.06,P=0.17)。在靶向药物的选择上,厄洛替尼联合同步放化疗可明显改善患者的OS(HR=0.72,95%CI:0.62~0.83,P<0.0001),表明同步放化疗联合厄洛替尼可使患者死亡风险降低28%,延长其生存期。西妥昔单抗联合同步放化疗在OS上无统计学差异(HR=1.05,95%CI:0.78~1.41,P=0.77)。
SCOPE1试验和RTOG0436试验同样显示出在晚期食管癌标准放化疗中加入西妥昔单抗未能带来生存获益[13-15],而其中的原因可能与SCOPE-1试验中西妥昔单抗组中断放疗次数更频繁有关,中断放疗可能会降低疾病的控制和生存率,使得生存获益并不显著[9],这与本项研究结果一致。先前的研究得出结论,同步放化疗联合西妥昔单抗与增加毒性相关[19-23],西妥昔单抗的加入增加了毒性,并影响了总生存率。一项Ⅲ期实验结果显示,在标准放化疗中联合厄洛替尼显示出总体生存期获益的趋势,亚组分析也显示厄洛替尼在所有亚组中均有获益,并且毒性可控[16]。因此,与单抗类药物西妥昔单抗相比,在晚期食管癌患者中优选EGFR酪氨酸激酶抑制剂厄洛替尼。
头颈部鳞状细胞癌(head and neck squamous cell carcinomas,HNSCC)有高达80%~90%的可能存在EGFR过表达或携带突变,这些改变直接影响整体和无进展生存期[24]。使用抗EGFR单克隆抗体或激酶结构域抑制剂并联合放射治疗仍然是HNSCC患者的一种治疗选择。有文献报道,治疗HNSCC常用的单克隆抗体包括FDA批准的西妥昔单抗和帕尼单抗,前者联合放疗或化疗药物如顺铂治疗HNSCC具有良好的疗效[25]。一项Ⅱ期试验表明,厄洛替尼联合顺铂和放疗并没有提高HNSCC的有效率和无进展生存期,尽管尚未进行进一步的临床试验,迄今为止,与标准治疗相比,EGFR酪氨酸激酶抑制通常与低应答率有关,主要是由于缺乏预测性生物标志物来识别最有可能应答的HNSCC患者[26]。因此,对于头颈部鳞癌患者,使用西妥昔单抗可能比厄洛替尼更能使患者获益。
本研究的局限性:①本研究中包含的样本量不足以代表全球,可能存在异质性偏大;②化疗方案、放疗的范围及剂量可能对研究结果有影响;③有关“吉非替尼”的文献因不符合纳入标准,故排除在外,可能影响整体结果分析;④检索到有关“帕尼单抗”的文献过少,样本量不足。因此,未来中尚需要更高质量的临床研究,特别是大样本、多中心的随机双盲对照试验来进一步验证同步放化疗联合靶向治疗在晚期食管癌中的有效性及安全性,以及最佳的同步化疗方案和靶向药物的选择,以期为靶向药物联合同步放化疗在食管癌临床应用中提供更多的证据。
综上所述,同步放化疗联合抗EGFR药物治疗局部晚期食管癌患者的疗效不一。在抗EGFR药物的选择上,优选厄洛替尼。

