食管鳞癌免疫治疗相关基因鉴定
任 婧,王登奎,杨瑞娜,袁小志,刘志伟,王新帅
食管鳞癌(esophageal squamous cell carcinoma,ESCC)作为食管癌中的主要组织学类型,在我国发病率和死亡率均较高[1]。目前对于食管癌的治疗主要是手术、放疗、化疗、靶向治疗和综合治疗,依据患者病情,选择个体合适的治疗方案,可显著延长患者总生存期。近年来,免疫治疗手段作为一种新的抗肿瘤治疗方式已在肿瘤研究中不断取得进展。肿瘤的免疫治疗是指激活人体免疫系统,通过自身免疫功能抑制“免疫逃逸”,发挥抗肿瘤作用[2]。其治疗方式是通过药物重新启动建立体内免疫系统对肿瘤的清除,恢复体内抗肿瘤免疫反应。目前已有的免疫治疗药物有免疫检查点抑制剂、肿瘤相关疫苗、小分子抑制剂等等。近年来,肿瘤免疫治疗已在多种肿瘤治疗中取得了巨大的成就,如黑色素瘤、肾癌、非小细胞肺癌等等。此外,最新食管癌治疗指南支持PD-1抑制剂可作为晚期一线、晚期二线食管癌治疗新标准。并且,免疫联合放化疗在食管癌治疗中已证实出安全性和可行性。表明免疫治疗在食管鳞癌治疗中的可行性。基因集富集分析(gene set enrichment analysis,GSEA)是指将数个基因组成的基因集与整个转录组、修饰组等做出简单而清晰的关联分析,相比于差异基因富集分析,GSEA是从全体基因的表达矩阵中找出具有协同差异的基因集,故能兼顾差异较小的基因。鉴于免疫治疗在食管鳞癌治疗中的潜力,且为了更好地助力食管鳞癌的免疫治疗研究,作者基于生物信息学分析展开了此次研究。
1 资料和方法
1.1 资料来源在GEO公共基因数据库(https://www.ncbi.nlm.nih.gov/geo/)中,以“ESOPHAGEAL SQUAMOUS CELL CARCIONMA”为关键词检索,下载包括ESCC及癌旁组织基因芯片数据集GSE20347。
1.2 基因集富集分析和核心基因鉴定运用R软件(4.0.4版本)中clusterProfiler包对基因表达数据进行基因集富集分析,挑选免疫相关通路并鉴定通路中核心基因进行下一步分析。
1.3 预后、免疫浸润分析和PPI网络构建为了探索本研究鉴定的基因表达量,作者基于UALCAN数据库(https://ualcan.path.uab.edu/index.html)分析核心基因与食管癌患者临床特征相关性。HPA人类蛋白质数据库(https://www.proteinatlas.org/)是包含蛋白质组学、转录组学、单细胞转录组等多组学的数据库,依据其单细胞数据,分析核心基因在细胞中表达分布,探究细胞间是否存在互作关系。在THE KAPLAN-MEIER PLOTTER (http://kmplot.com/analysis/index.php p=background)和TIMER2.0(http://timer.cistrome.org/)中分别进行核心基因生存预后分析及核心基因在食管癌组织中与免疫细胞浸润的相关性分析。基于GENEMANIA(http://genemania.org/)数据库构建蛋白-蛋白相互作用(PROTEIN-PROTEIN INTERACTION,PPI)网络预测基因功能[3]。
1.4 统计学分析P<0.05被认为具有统计学差异,基因集富集分析采用多重假设检验矫正。
2 结果
2.1 数据处理GSE20347平台信息为GPL571[HG-U133A_2] AFFMETRIX HUMAN GENOME U133A 2.0 ARRAY,且GSE20347基因芯片共有34例样本包含17例ESCC组织及17例癌旁组织,经R软件标准化及探针转换处理,共得到12 402个基因表达数据集。
2.2 基因集富集分析和核心基因鉴定运用clusterProfiler 包对基因表达矩阵进行基因集富集分析,结果如图1所示,共得到15个免疫相关通路:免疫效应过程、白细胞介导的免疫、免疫效应过程中的负调控、免疫受体的体细胞多样化、单一位点内通过种系重组免疫受体的体细胞多样化、免疫球蛋白的体细胞多样化、体液免疫负调节、B细胞免疫调节、B细胞活化参与免疫反应、自然杀伤细胞介导免疫、免疫球蛋白产生、自然杀伤细胞介导免疫调节、通过体细胞突变实现免疫受体的体细胞多样化、体液免疫应答、调节免疫球蛋白产生,依据通路中基因RANK排名,鉴定出15个核心基因(UTP18、PTPN14、UMPS、ATAD5、BCL11B、ATM、CTNNBL1、SCCPDH、TNFSF4、MICA、POLB、TUBA1C、UNG、EHMT2、PKN1)。
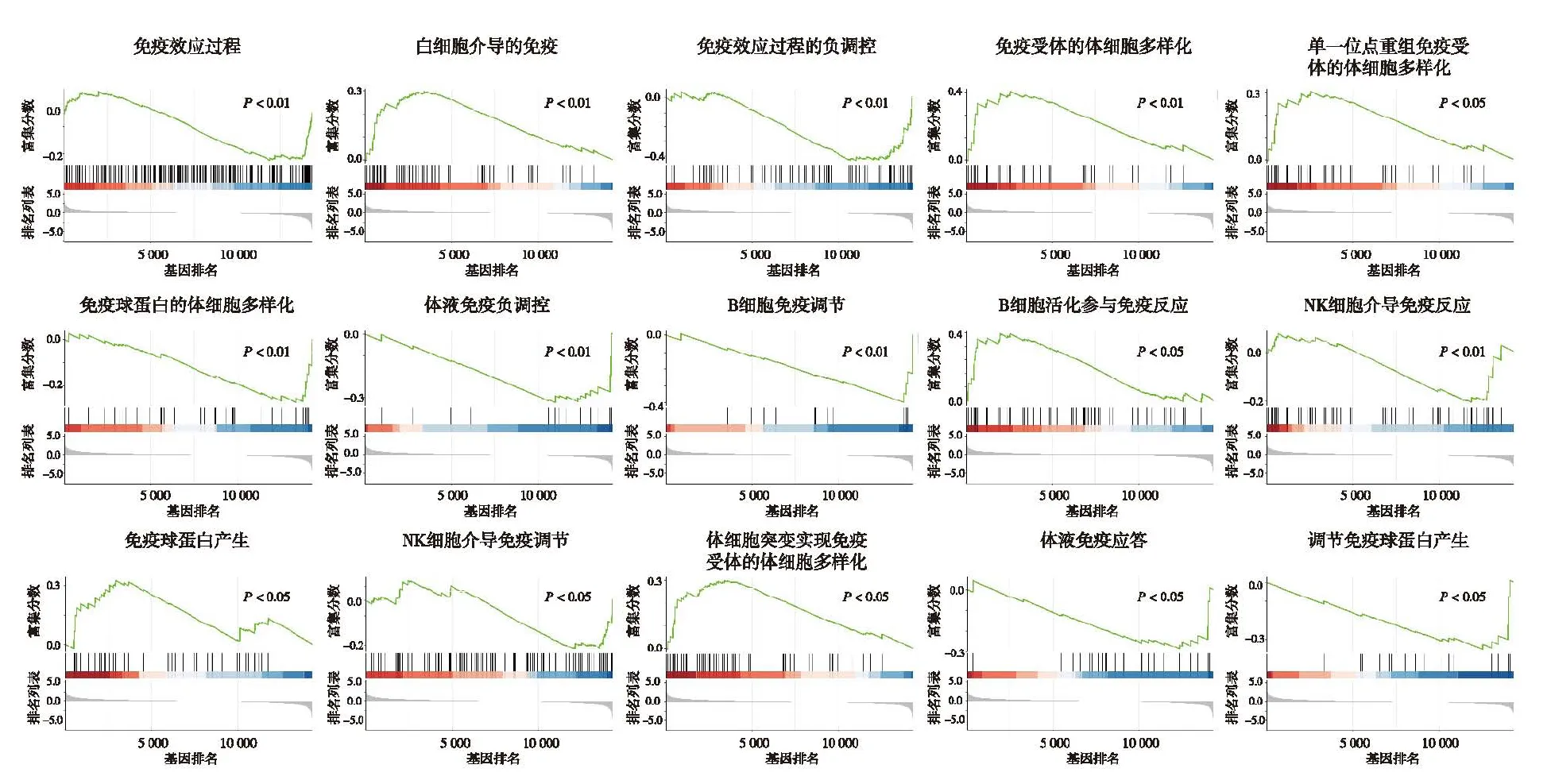
图1 基因集富集分析
2.3 预后及肿瘤免疫浸润分析基于KM plotter数据库对核心基因进行预后评估,生存预后结果如图2所示15个核心基因中ATAD5、ATM、EHMT2、PTPN14、UTP18基因高表达与ESCC患者较好的总生存期(overall survival,OS)显著相关(P<0.05)。进一步分析预后相关的核心基因与食管癌患者肿瘤分级及淋巴结转移关系,结果如图3和图4所示,对比正常组织,免疫基因与肿瘤分级及淋巴结转移显著相关(P<0.05),且肿瘤的分级和分期越高,部分基因的表达量越高。细胞测序结果分析(图5)提示EHMT2、ATAD5和UTP18在鳞状上皮细胞和B细胞中表达分布丰富,ATM在免疫细胞中表达分布较丰富,PTPN14主要富集于内皮细胞中。考虑到核心基因在免疫细胞中分布丰富,我们进一步行肿瘤免疫浸润分析,结果如图6所示,CD4+T细胞和中性粒细胞浸润水平与ATAD5、UTP18、ATM和PTPN14表达水平呈正相关,而与EHMT2表达水平呈负相关。树突状细胞浸润水平与ATAD5、ATM和PTPN14表达水平呈正相关,与UTP18和EHMT2表达水平呈负相关。B细胞浸润水平与ATAD5和UTP18表达水平呈正相关。CD8+T细胞浸润水平与ATM、EHMT2和PTPN14表达水平呈正相关。
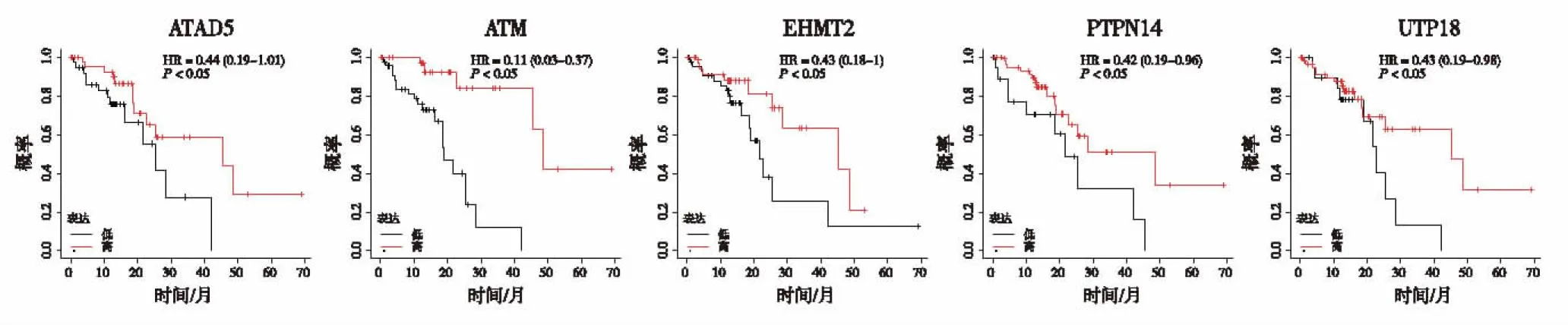
图2 免疫基因OS评估

图3 免疫基因在不同分级表达量
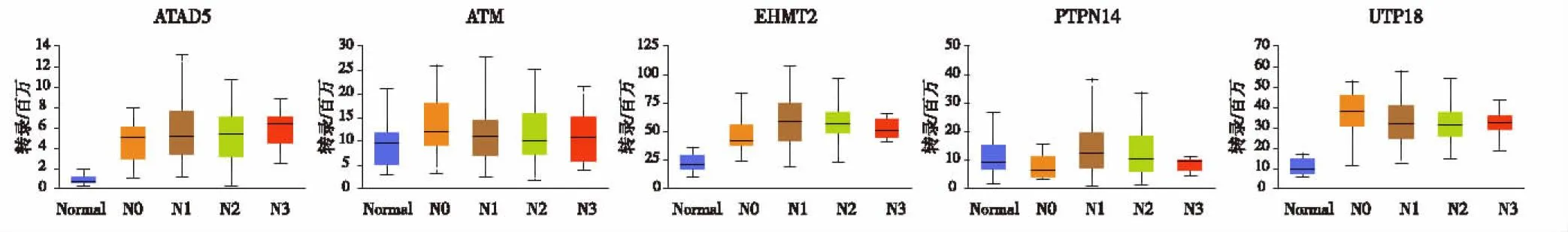
图4 免疫基因在不同淋巴结转移表达量
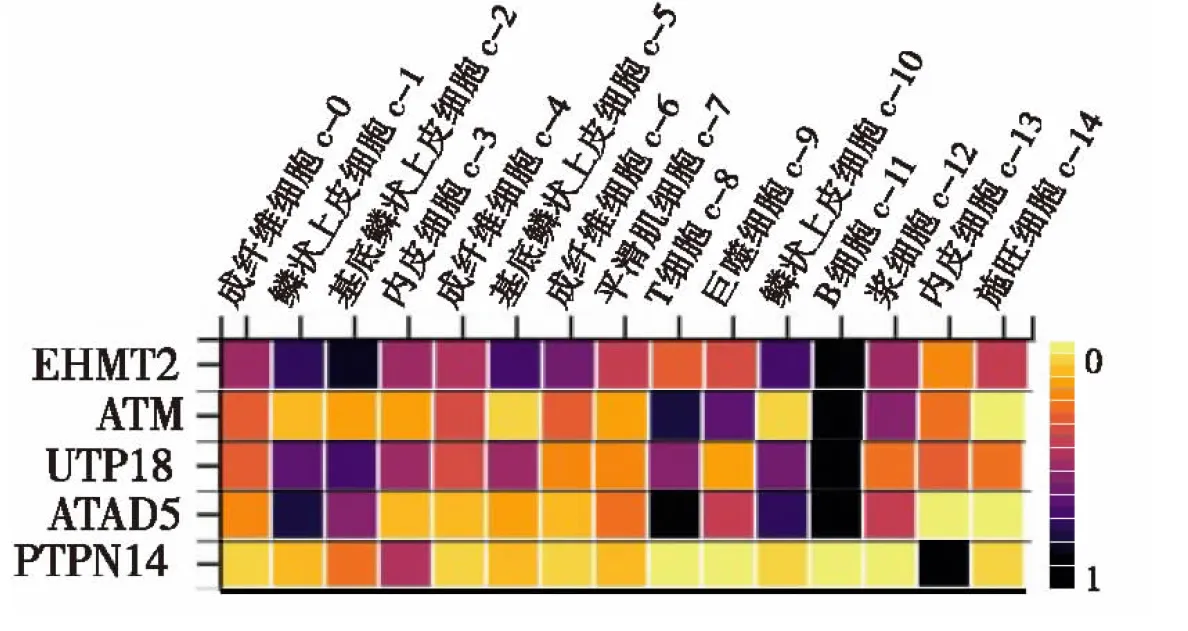
图5 免疫基因单细胞亚群分布热图
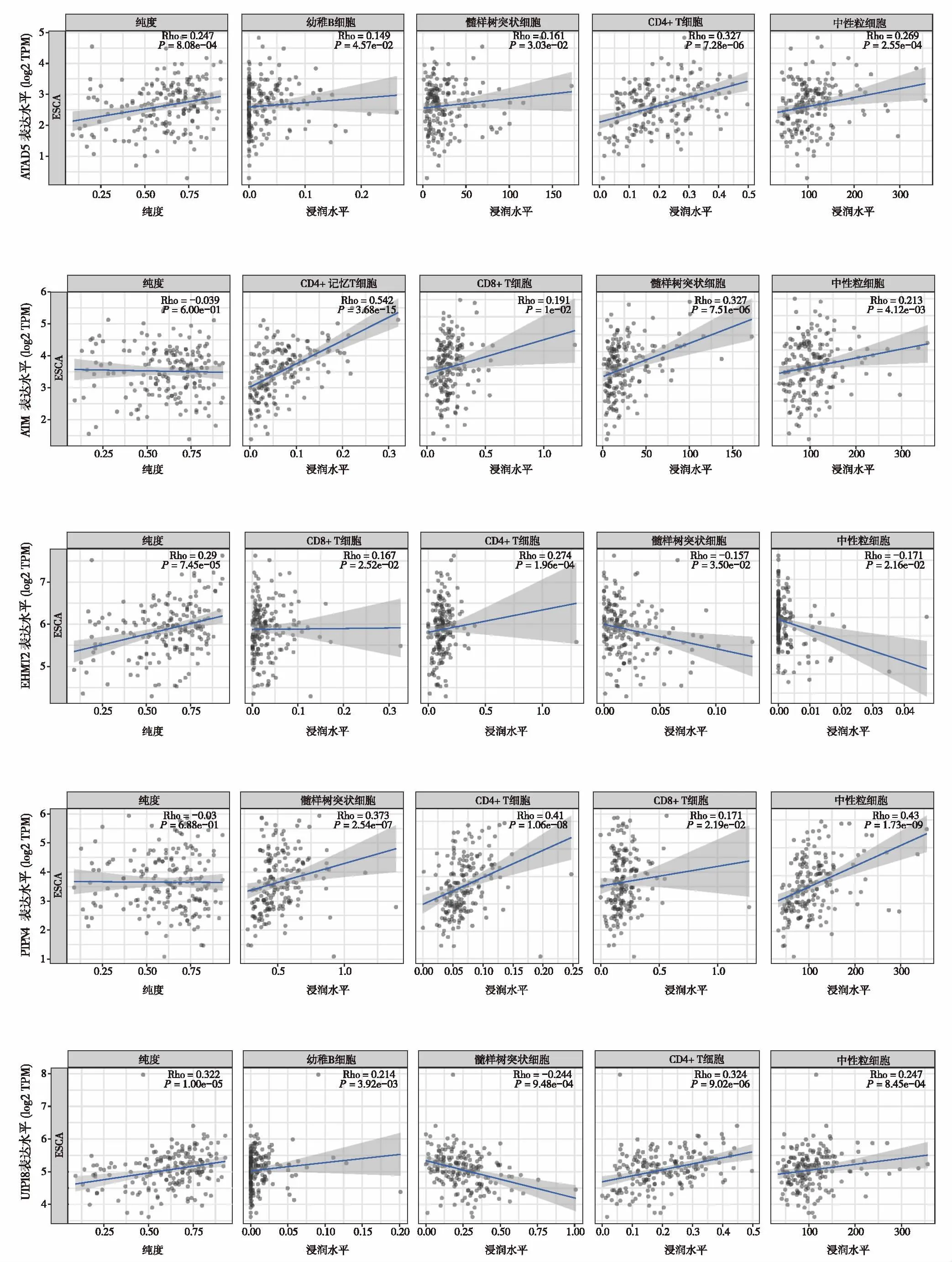
图6 肿瘤免疫浸润分析
2.4 核心基因网络构建基于GeneMANIA数据库构建核心基因的PPI网络,如图7所示,参与网络的基因主要涉及功能包括组蛋白甲基转移酶活性、细胞周期的正调控、细胞周期阻滞的正调控、细胞周期过程的正调控、DNA损伤检查点、细胞周期检测点。
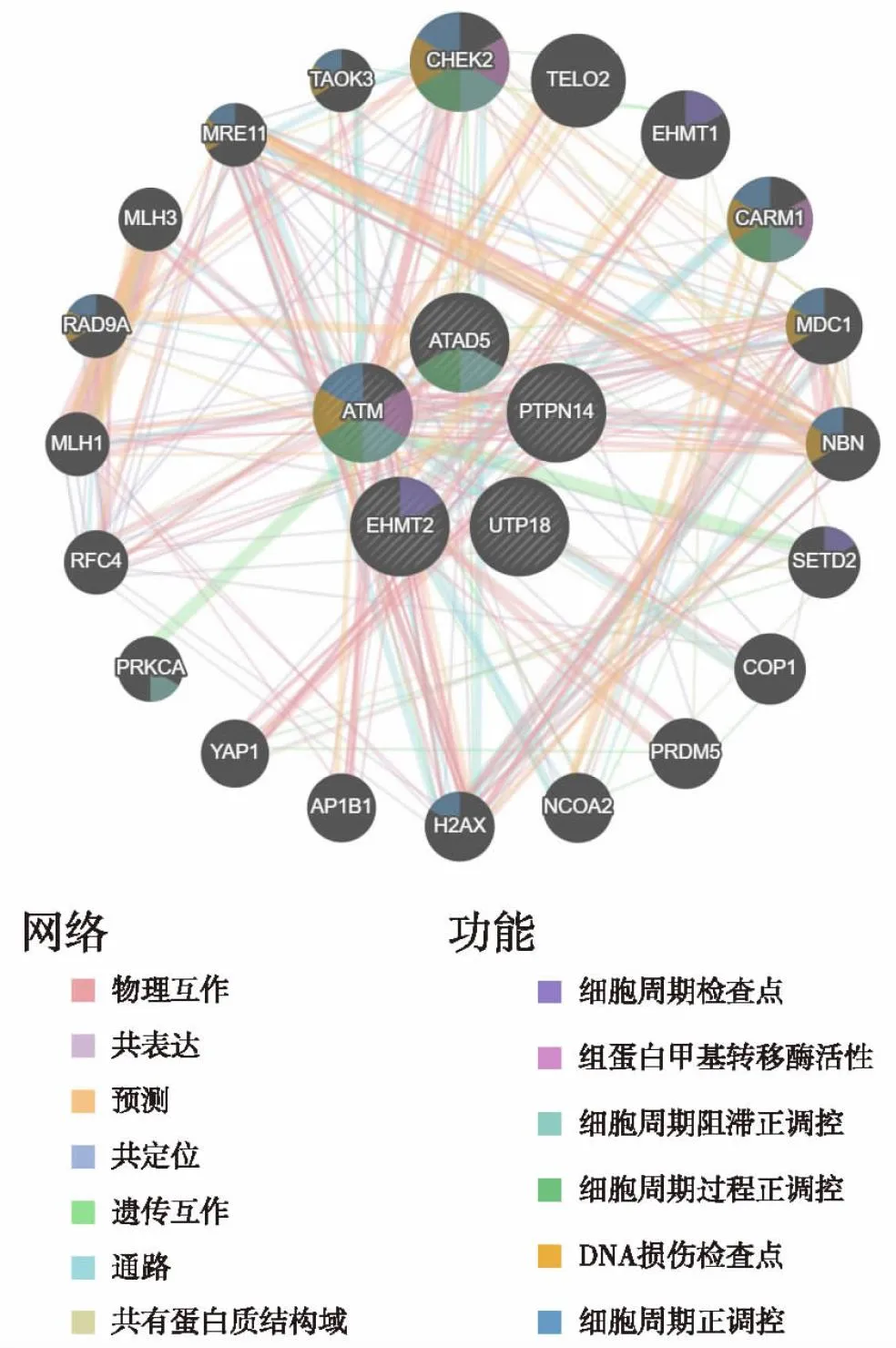
图7 核心基因PPI网络及功能构建
3 讨论
食管癌治疗是肿瘤治疗的难点和热点[4]。肿瘤微环境是体内肿瘤细胞生长的内外环境,与肿瘤细胞的生长和转移相关,且肿瘤微环境中不仅有肿瘤细胞,还包括免疫细胞、成纤维细胞、结缔组织等,微环境中浸润的免疫细胞作为癌症的特殊生物标志物显著影响肿瘤的诊断、生存预后和临床抗肿瘤效果。此外,肿瘤微环境中的免疫抑制细胞可以通过影响免疫细胞对肿瘤细胞识别更进一步促进肿瘤细胞生长。肿瘤免疫浸润分析可帮助研究人员开发新型癌症诊断和治疗策略。本研究通过基因集富集分析鉴定出ESCC基因集主要参与的免疫相关通路(免疫效应过程、白细胞介导的免疫、免疫效应过程中的负调控等)和通路中的核心基因。生存预后提示核心基因中ATAD5、ATM、EHMT2、PTPN14、UTP18基因高表达与ESCC患者较好的OS显著相关。且核心基因的表达与肿瘤分级及淋巴结转移相关。此外,单细胞测序提示核心基因在鳞状上皮及免疫细胞中表达丰度较高,提示免疫细胞与鳞状细胞可能通过这些核心基因位点进行互作,而且核心基因肿瘤免疫浸润分析结果显示ESCC组织中CD4+T细胞、CD8+T细胞、中性粒细胞、树突状细胞、B细胞的浸润水平与核心基因表达水平存在相关性。这些免疫通路可能参与肿瘤微环境的改变,而通路中的核心基因会影响免疫通路整体的效价,并且核心基因会导致肿瘤微环境内免疫细胞水平的改变可能会进一步加速肿瘤的免疫逃逸。这些瀑布反应会使得体内的肿瘤细胞恶性程度更高。而且,通过构建基因网络发现核心基因主要调控细胞周期、DNA损伤检查点和组蛋白甲基转移酶活性。结果表明核心基因在调控免疫通路的同时还能影响细胞内的增殖周期、蛋白修饰、DNA损伤修复等等。总的来说,核心基因不仅影响体内肿瘤生存的微环境,还同时调控细胞内的代谢,而细胞内外的改变可能会使得肿瘤细胞恶性程度更高。
核心基因的进一步分析同样更加重要。ATAD5是一种AAA+ ATP酶蛋白,可与RFC2-5形成选择性复制因子C样复合体(ribasome lamellar complex, RLC),对于维持基因组稳定性非常重要[5]。既往HeLa和酵母细胞研究表明,免疫球蛋白重链(Igh)重组、B细胞分裂降低和基因组不稳定性与ATAD5 表达降低相关[6-7]。属于激酶家族的ATM主要参与DNA链断裂后的细胞周期检查点因子Chk、DNA修复和凋亡等生物学反应[8]。已有研究证实,在人单核细胞和巨噬细胞中,炎症因子基因的表达可以直接由p53和ATM依赖机制诱导[9],而T细胞激活引起的氧化应激反应以及T细胞受体和CD40诱导的抗体类别转换重组过程中的DNA双链断裂损伤均需要ATM调控[10-11],且在基因毒应激后,NF-κB靶基因参与炎症的转录诱导需要ATM对p65的Ser547磷酸化[12]。EHMT2是一种赖氨酸甲基转移酶,其主要功能是使组蛋白H3的赖氨酸二甲基化 (H3K9me2)[13]。EHMT2是T细胞、先天淋巴细胞和Th细胞发育、分化以及功能调节的中心控制点。如EHMT2通过介导依赖H3K9me2的T细胞反应参与T细胞功能调节,或通过H3K9me2限制转录因子和共激活剂对特定基因位点的可及性,调控幼稚T细胞,抑制基因表达,而且可抑制病毒感染期间记忆T细胞CD25和CD27的表达[14-15]。UTP18是核糖体亚基加工组的重要组成部分。已有研究发现在人神经母细胞瘤、肝癌、黑色素瘤、乳腺癌细胞和HEK 293T细胞中观察到内源性UTP18免疫应答[16]。PTPN14是调节多种细胞过程的信号分子,包括细胞生长、分化、有丝分裂周期和致癌转化。PTPN14作为肿瘤抑制因子,其低表达与较短的总生存率相关[17]。但新研究表明,PTPN14通过介导血管内皮钙粘着蛋白的磷酸化也参与了炎症的调节[18]。
综上所述,本研究基于基因集富集分析鉴定出与ESCC显著相关的免疫基因,同时分析免疫基因与肿瘤患者临床特征的相关性,并进一步通过肿瘤免疫浸润分析发现与核心基因显著相关的免疫细胞,可为ESCC免疫相关研究提供一定的理论依据。

