环状RNA在食管癌诊断和预后中的研究进展
马丽霞,左志向,石林林,李佳怡,喻 莹,谷变利,鲁智豪,高社干
2020年全球癌症统计数据显示,食管癌新发60.4万例,死亡54.4万例,发病率位列第七,死亡率位列第六位,通常食管癌病理类型90%以上是食管鳞癌[1]。由于食管癌早期症状不明显,多数患者发现时已至中晚期,且预后较差[2]。虽然近年来食管癌患者的治疗和管理得到了很大的改善,但总的5 a生存率(约10%)和食管癌切除术后5 a生存率(15%~40%)仍然很低[3]。因此,挖掘食管癌早期诊断和治疗的分子标志物迫在眉睫。
环状RNA(circular RNA,circRNA)是一种非编码RNA,其3′端和5′端共价结合形成闭合环状结构,对核酸外切酶不敏感,因此结构较为稳定;同时具有组织特异性和序列保守性等特点[4-5]。circRNA最初在20世纪末的RNA病毒中被发现,且被认为是转录背景噪音,没有生物学功能[6]。随着高通量测序技术和生物信息学方法的应用,circRNA的研究才有了重大进展;随后,circRNA在不同组织和细胞中的表达谱及重要功能被揭示[7-8]。多项研究已经证实circRNA在转录和转录后水平调控基因表达,通过改变细胞增殖、分化和凋亡,参与肿瘤的发生发展,并可作为肿瘤标志物[9]。
基于此,本文对circRNA在食管癌诊断和预后中的作用及研究进行综述。
1 circRNA的特点及生物学功能
circRNA主要通过反向剪接机制产生,这一过程不同于经典剪接。迄今为止,circRNA生物发生机制的3种假设模型已被广泛接受,其中包括RNA结合蛋白(RNA Binding Protein,RBP)介导、内含子配对驱动和套索驱动环化[10-16](见图1A)。根据起源,circRNA可分为4种类型,即外显子circRNA、外显子内含子circRNA、内含子circRNA和基因间circRNA[17](见图1B)。circRNA通常具有以下特性:①普遍性:circRNA在多种物种中广泛表达,在人体表达的基因中,大约1/8能检测到circRNA的表达,并且其表达水平比相应的线状RNA高出约10倍[18-19]。②稳定性:与常见的线性RNA不同,circRNA具有封闭的环状结构,不受RNA外切酶影响。③保守性:circRNA在物种间表现出高度的保守性。例如,大约有15 000个circRNA在人类和小鼠的同源位点中表达,分别占人类和小鼠circRNA总量的15%和40%[20]。④特异性:在不同细胞、组织或发育的不同阶段,circRNA通常表现出特异性[21-24]。
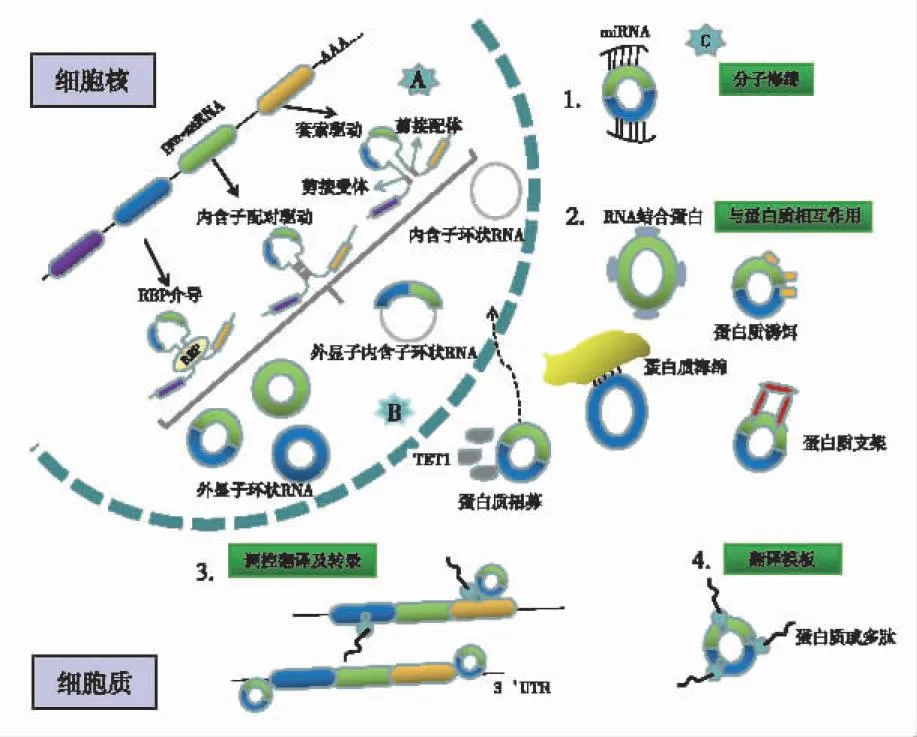
图1 circRNA的生成及功能
circRNA的生物学功能主要包括:①作为microRNAs(miRNAs)分子海绵,与miRNAs竞争性结合,降低miRNAs靶向mRNA的能力,并参与机体不同器官细胞生理功能的调节[25](见图1C1)。②与蛋白质相互作用:RBP是最著名的circRNA相互作用分子,许多RBP在癌症中参与circRNA介导的致癌或抑癌过程。circRNA也作为蛋白质海绵、蛋白质诱饵、蛋白质招募或蛋白质支架,直接或间接地调控转录或翻译。此外,circRNA与蛋白质的相互作用也有助于靶蛋白转录后的调控,包括泛素化和磷酸化介导的降解等[26](见图1C2)。③调控基因转录和翻译:一方面,circRNA可与RBP相互结合影响亲本基因mRNA的表达;另一方面,circRNA形成过程中内含子间的竞争性互补配对,可以与线性RNA之间达成一种平衡,影响mRNA的表达,甚至蛋白质翻译[15,27-28](见图1C3)。④翻译蛋白质:因序列中存在核糖体入口位点(internal ribosome entry site,IRES)[3],或通过m6-甲基腺苷(N6-methyladenosine,m6A)介导的帽不依赖机制[29],参与疾病相关蛋白质的编码过程[30](见图1C4)。
2 circRNA与食管癌的恶性演进
2.1 食管癌中circRNA的功能
尽管多数研究处于早期阶段,但目前研究支持circRNA作为致癌基因或肿瘤抑制因子参与食管癌的恶性演进,并有望成为食管癌潜在的治疗靶标。表1总结了circRNA在食管癌中的作用研究。

表1 食管癌中circRNA的功能
2.1.1 circRNA调控细胞增殖研究显示circRNA在细胞增殖调控中发挥重要作用。利用临床样本,Luo等通过qRT-PCR技术发现circFNDC3B在癌组织中的表达水平较癌旁明显升高,食管癌细胞系中转染sh-circFNDC3B后,细胞增殖能力减弱,表明circFNDC3B调控食管癌细胞增殖[31]。大部分circRNA(如circRNA-0008717、circRAD23B、ciRS-7等)作为分子海绵与miRNA相互作用,也调控食管癌细胞的增殖[32-34]。
2.1.2 circRNA调控食管癌细胞迁移、侵袭circRNA在调控食管癌细胞的迁移、侵袭和转移中也发挥了重要作用。Hu等证实circGSK3β通过与GSK3β相互作用,抑制GSK3β活性,促进食管鳞癌细胞迁移和侵袭[35]。研究发现某些circRNA会抑制肿瘤细胞的迁移与侵袭。例如,circ-BMI1[38]、circ-Foxo3[39]在食管鳞癌组织中低表达,过表达后都能抑制细胞的迁移及侵袭。由此可见circRNA对食管癌细胞迁移及侵袭调控作用是双向的。
2.1.3 circRNA调控食管癌细胞凋亡和细胞周期肿瘤细胞一般具有无限生长的特性,肿瘤发生是其细胞凋亡受抑制的结果。研究发现circRNA调控食管癌细胞凋亡,如hsa_circ_0023397在食管癌细胞中下调,过表达后明显抑制了KYSE-150细胞的增殖并促进其凋亡,机制研究表明其通过竞争性结合miR-106b影响食管癌细胞的生物学功能[40]。细胞周期的紊乱导致细胞增殖失调,诱发癌变。has_circ_14153通过结合miR-4469,激活CDK3的表达,调控食管癌细胞周期[41],参与食管癌的发生发展。
2.1.4 circRNA调节食管癌细胞自噬自噬是一种受多种非编码RNA调控的细胞内降解途径。目前对ciRS-7(CDR1as)的研究比较深入,在食管鳞癌细胞中,它通过竞争性结合miR-1299,影响其下游Akt-mTOR信号通路,抑制自噬[42]。
2.2 circRNA调控上皮细胞-间充质转化(Epithelial-Mesenchymal Transition,EMT)
EMT是一种上皮细胞向间充质细胞转变的过程,为上皮细胞提供迁移和转移的能力。EMT异常激活促进肿瘤细胞的侵袭和扩散,是肿瘤转移过程中必要的细胞过程。例如,circ_0004370通过miR-1301-3p/COL1A1轴介导食管癌细胞EMT过程[43]。hsa_circ_0006948在食管鳞癌组织中过表达,通过吸附miR-490-3p增强HMGA2诱导EMT,促进肿瘤进展[76]。hsa_circ_0012563通过调控XRCC1/EMT通路促进食管鳞癌的迁移和侵袭[78]。
2.3 circRNA调节放疗抵抗
获得性放射抵抗是放疗后肿瘤局部复发或治疗失败的最重要原因,了解circRNA参与放化疗耐药的调控机制可以识别新的靶点以优化治疗,这方面研究目前较少。Su等应用微阵列技术对3752个人类细胞样本circRNAs的表达进行了定量分析,明确了KYSE150细胞系放疗抵抗的表达谱,筛选出2个关键分子(circRNA_001059和circRNA_000167),有助于阐明circRNA在放疗抗性中的分子机制[37]。此外,研究表明circRNA_100367通过miR-217/Wnt3通路调控食管鳞癌的辐射敏感性[79]。circVRK1通过调控miR-624-3p/PTEN轴和PI3K/AKT信号通路逆转食管鳞癌细胞辐射抗性[75]。
3 食管癌诊断和预后标志物
越来越多的研究发现,circRNA作为一种新的肿瘤标志物潜力巨大。例如,Fan等发现hsa_circ_0001946和hsa_circ_0062459在血浆中作为食管鳞癌诊断标志物的AUCs分别为0.894(敏感性92%,特异性80%)和 0.836(敏感性64%,特异性92%)[8]。大部分circRNA在食管癌中高表达且与预后不良相关;Huang等发现circ_0004771在食管癌血浆和组织中表达上调,并且其表达水平与原发肿瘤的浸润程度和血管浸润程度显著相关,提示circ_0004771可作为判断预后的指标[44]。然而,也有小部分低表达circRNA提示食管癌预后较差。例如,circ-SMAD7在食管癌组织与血浆中低表达,与TNM分期(P=0.000)和淋巴转移(P=0.000)高度负相关[80]。体内体外实验证实circ-Foxo3的过表达抑制食管癌细胞的生长、迁移和侵袭;在食管癌组织中低表达的circ-Foxo3,经circ-Foxo3/miR‐23a/PTEN通路起作用,与组织学分级相关,且提示预后不良[39]。
同时,得益于测序技术的飞速发展,越来越多的circRNA及其在人类癌症中的作用得以揭示。Wang等利用高通量测序分析,从73对食管鳞癌和癌旁组织中共检测到128 165个circRNA,与CircBase数据库重合25 945个。其研究表明,食管癌组织中circRNA的丰度低于正常组织,且表达量存在差异,进一步筛选出hsa_circ_0005314、hsa_circ_0007541、hsa_circ_0000005和hsa_circ_0077536作为食管癌诊断和预后标志物,准确率较高[7]。Fan等利用微阵列技术对3对食管鳞癌冷冻肿瘤和癌旁组织进行了研究,发现了食管鳞癌相关的1 045个上调和1 032个下调circRNAs,分析出hsa_circ_0001946和hsa_circ_0043603可作为食管癌诊断标志物,单独hsa_circ_0001946的AUC、敏感性和特异性为0.894、92和80%,单独hsa_circ_0043603则为0.836、64和92%,而共同检测的AUC、敏感性和特异性为0.928、84和98%。而且还证实了在冰冻和石蜡包埋组织中的hsa_circ_0001946水平可预测食管鳞癌复发、总生存率和无疾病生存率,而hsa_circ_0001946的过度表达则降低细胞增殖、迁移和侵袭能力,显示其作为食管癌预后标志物的潜力[8]。
通过广泛的临床样本测试,包括食管癌患者和健康对照组的组织、血清和外泌体,多个circRNA被认定为潜在的分子标志物,这些circRNA有可能实现食管癌的早期诊断并预测其复发和转移(表2)。
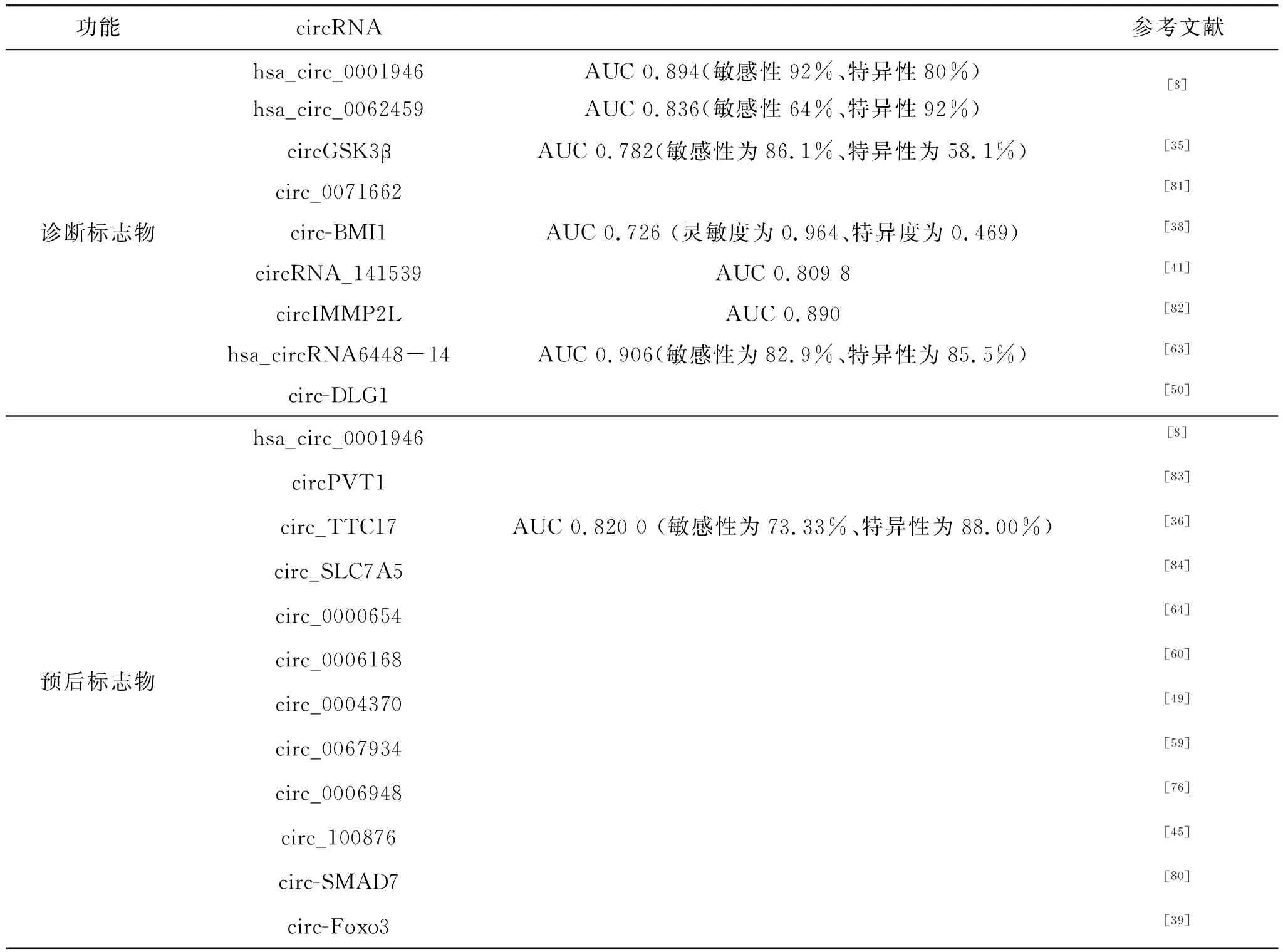
表2 circRNA作为食管癌诊断和预后标志物
4 展望
近年来,随着对circRNA研究的不断深入,越来越多的疾病与circRNA联系起来,特别是肿瘤。但食管癌中circRNA的研究目前尚处于初级阶段,大量circRNA在食管癌中的功能亟待阐明,且能够作为早期诊断和预后标志物的分子仍比较少,需要更多的基础与临床研究来揭示和证实。本文综述了circRNA在食管癌中的功能及临床应用,着重介绍了circRNA作为食管癌诊断和预后标志物的潜在临床价值,以期为食管癌早期诊断、预后评估提供新思路。

