用高效液相色谱法比较牦牛和犏牛乳中两种乳清蛋白含量
王丽婷,金素钰,黄 林,吴笑寒,郑玉才
(西南民族大学畜牧兽医学院,四川 成都 610041)
牦牛(Bosgrunniens)是青藏高原特有的牛种.乳是牦牛的主要畜产品,其蛋白质、脂肪、钙和磷等矿物质元素及一些人体必需氨基酸含量均显著高于普通牛乳.然而,牦牛的泌乳期短、日挤乳量仅约为1.5 kg,远低于普通奶牛[1].因此,犏牛乳近年来日益成为青藏高原地区重要的乳源.犏牛是公黄牛与母牦牛的杂交后代,表现出明显的杂种优势,日挤乳量可达4.1 kg.与牦牛乳类似,犏牛乳也具有营养价值高、绿色无污染等优点[2].
乳清蛋白约占牛乳蛋白的20%,主要由α-乳清蛋白(α-La)、β-乳球蛋白(β-Lg)、免疫球蛋白等组成,前两种蛋白质均由乳腺自身合成,约占总乳清蛋白的76%[3].β-Lg具有多种生物学功能,但却是牛乳的主要过敏原;β-Lg具有多种遗传变异体,普通牛乳中主要有A和B[3],牦牛乳中则为E[4].α-La是乳清中第二丰富的蛋白质,富含色氨酸和半胱氨酸,α-La参与乳糖的生物合成,可控制乳糖的合成量,是泌乳量的一个重要调控因子[5].本研究采用高效液相色谱法(HPLC)测定牦牛和犏牛乳中α-La和β-Lg的含量,并用电泳方法对β-Lg进行分型,以期为青藏高原地区乳的质量监控提供支持.
1 材料与方法
1.1 乳的采集与处理
试验乳样均采自四川省红原县,来自健康的麦洼牦牛(n=67)和犏牛(n=36).牦牛包括全奶牦牛(n=40)和半奶牦牛(n=27),前者指当年产犊的泌乳牦牛,至夏季采样时泌乳期约为3个月; 后者指前一年产犊,第二年(即采样当年)继续挤乳的牦牛,采样时其泌乳期超过一年[6];犏牛主要以西门塔尔犏牛为主.试验牛年龄为 5~15 岁,胎次 1~8 胎,常年天然草场放牧,无补饲.于6 月青草季节清晨用手工挤乳,每头牛采集乳样约 50 mL,冰冻后带回实验室,-80 ℃保存.
牦牛和犏牛乳经离心后获得脱脂乳,再采用等电点沉淀法制备乳清,简要过程:取2 mL脱脂乳,加4.94 mol·L-1的乙酸缓冲溶液(33.3%乙酸钠与33.3%冰乙酸等体积混合,现配现用,pH=4.29)200 μL,迅速混匀,然后以10 000 rpm/min离心10 min,上清即为乳清,-20 ℃保存备用,上样前用0.22 μm的水性膜过滤.
1.2 用HPLC分析乳中两种乳清蛋白含量
实验所用高效液相色谱仪为Agilent1100型,色谱柱为AgelaVenusil ASB C18(5 μm,4.6 mm×250 mm);柱温30 ℃;检测波长215 nm;进样量10 μL;流动相:A相为0.1%三氟乙酸/H2O,B相为0.1%三氟乙酸/乙腈.采用线性梯度洗脱的方式,起始浓度A相为100%,B相为20%,在20 min内B相升至50%,在40 min内升至80%并保持.每个样品分析时间为42 min.
牛α-La和牛β-Lg(北京博奥森生物技术有限公司)工作液浓度分别为0.2~2.0 mg/mL和0.5~2.5 mg/mL.按照上述色谱条件分别对其进行检测,并以浓度为横坐标,峰面积平均值为纵坐标制作标准曲线.将待测乳清在相同色谱条件下分析.本研究以保留时间定性,外标法定量.所有样品均重复进样3次.
1.3 用电泳法检测乳中β-Lg遗传变异体
取20 μL乳清加入60 μL的9.6 mol/L尿素和4 μL的1%溴酚蓝指示剂,混匀后取2 μL用非变性聚丙烯酰胺凝胶电泳(PAGE)分析β-Lg遗传变异体[7],用考马斯亮蓝G-250染色凝胶,经脱色后拍照.
2 结果
2.1 乳清蛋白的HPLC标准曲线
α-La和β-Lg的HPLC保留时间分别约为20 min和22 min(图1).α-La(0.2~2 mg/mL)和β-Lg(0.5~2.5 mg/mL)的标准曲线均显示很好的线性关系,R2在0.999以上(图2).
2.2 牦牛和犏牛乳中两种乳清蛋白的含量
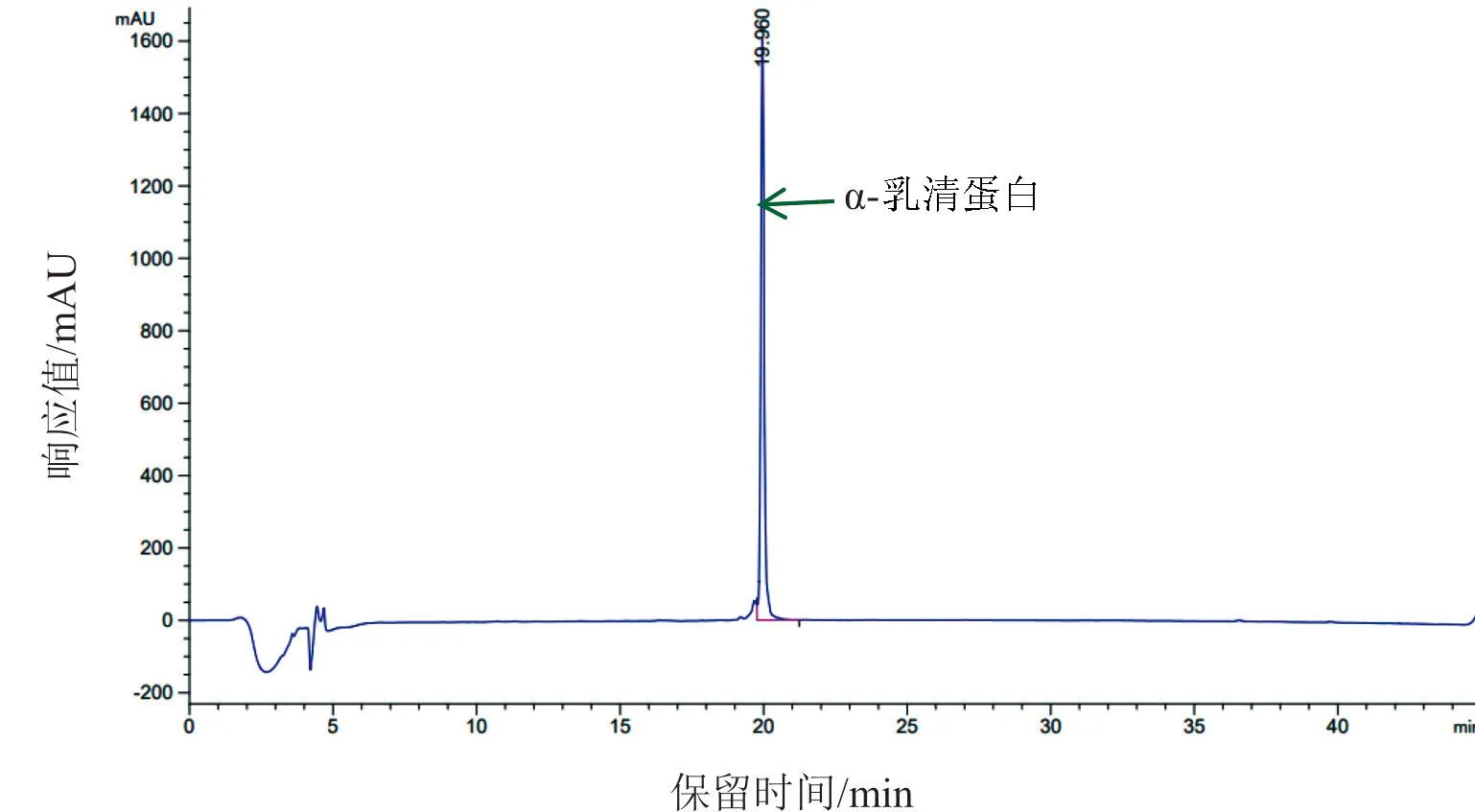
用HPLC分析牦牛和犏牛乳清,α-La和β-Lg分别在其标准品的时间窗口内显示色谱峰(图3).牦牛和犏牛的α-La均为单峰,牦牛(n=67)和多数犏牛(n=26)的β-Lg均为单峰(图3A),但10头犏牛β-Lg显示为没有分离完全的双峰(图3B).因此,HPLC色谱图的单峰或双峰,无法对应其实际的基因型.
根据标准曲线计算全奶牦牛、半奶牦牛和犏牛乳中α-La和β-Lg的含量(表1),α-La在上述3类乳中的含量无显著差异,分别为0.884 0 mg/mL、0.851 7 mg/mL和0.834 2 mg/mL,但β-Lg在半奶牦牛乳中的含量极显著高于全奶牦牛乳和犏牛乳(P<0.01),而全奶牦牛与犏牛乳中β-Lg含量无显著差异.在半奶牦牛乳中,α-La和β-Lg总含量也极显著高于全奶牦牛乳和犏牛乳(P<0.01).
(A)

(B)图1 牛α-La和β-Lg标准品的HPLC图谱Fig.1 HPLC diagram of bovine α-La and β-Lg standardsA:1 mg /mL的牛α-La;B:0.5 mg /m L的牛β-Lg A:1 mg/mL bovine α-La;B:0.5 mg/mL bovine β-Lg

(A)

(B)图2 牛α-La和β-Lg的标准曲线

(A)

(B)图3 牦牛和犏牛乳清的HPLC图谱Fig.3 HPLC diagram of yak andcattle-yak wheyA:牦牛;B:犏牛A: yak;B:cattle-yak

表1 全奶牦牛、半奶牦牛和犏牛乳清中α-La和β-Lg的含量及比值Tab.1 The content and ratio of α-La and β-Lg in whey of total-lactating yak,half-lactating yak and cattle-yak
2.3 用电泳方法检测牦牛和犏牛β-Lg遗传变异体
用PAGE对牦牛和犏牛的乳清进行检测,β-Lg遗传变异体获得很好分离,共检测到3种β-Lg遗传变异体,基因型分别是AE、BE和EE(图4).试验的67头全奶牦牛和半奶牦牛β-Lg均为EE型;36头犏牛中,β-Lg为AE型的11个,BE型25个,每头犏牛均含E等位基因,而A和B等位基因频率分别为0.152 8和0.347 2.
结合色谱和电泳的结果可以看出,HPLC虽然可以准确分析乳中两种乳清蛋白的含量,但无法根据色谱峰确定其基因型,因为多数犏牛(n=26)的β-Lg的HPLC呈单峰,而PAGE显示这些样品β-Lg均为杂合型(AE或BE型).因此,HPLC与PAGE结合,才可同时对β-Lg进行定量和基因分型.

图4 牦牛和犏牛乳清蛋白PAGE 图谱Fig.4 Whey protein PAGE patterns of yaks and cattle-yaks1~3泳道为牦牛,4~9泳道为犏牛,图下部字母代表每个样品的β-Lg基因型
3 讨论
α-La和β-Lg是牛乳中含量最多的乳清蛋白,分别约占乳清蛋白的 12%~19%和48%~50%[3].α-La是唯一能结合钙的乳清蛋白,属于小分子酸性蛋白质,可提供必需氨基酸和支链氨基酸,同时也是调节泌乳量的一个重要因子,近年来还发现其在抗菌、抗病毒和作为潜在药物载体方面的功能[8].β-Lg的功能尚不完全清楚,但被认为具有多种生物学功能,如Kushibiki等[9]研究发现β-Lg可以促进视黄醇、甘油三酯和长链脂肪酸的肠道吸收;Zasila等[10]发现其对维生素D、维生素E等脂溶性维生素亲和力很高,促进其吸收;β-Lg还可能作为药物的载体和生物活性物质的来源[11-12].因此,测定乳中这两种乳清蛋白含量有实际意义.
乳蛋白组成受泌乳阶段、营养及饲养管理等诸多因素影响.实验测得α-La含量在全奶牦牛、半奶牦牛和犏牛乳中无显著差异,提示该蛋白对泌乳的重要性.半奶牦牛是在青藏高原放牧条件下,牦牛特有的泌乳类型,处于自然延长泌乳期(Naturally extended lactation stage),这种现象也存在于一些放牧奶牛中[13].半奶牦牛泌乳期显著长于全奶牦牛,处于相对的泌乳后期,但在青草季节乳腺分泌仍处于活跃状态,本研究发现其α-La/β-Lg发生显著变化,可能是半奶牦牛乳的一个重要特点.
本研究建立了测定牦牛乳和犏牛乳的α-La和β-Lg含量的HPLC法,采用的是常规的C18色谱柱,标准品线性关系好,色谱峰分离好(图1),可实现准确定量测定,而以往测定乳中α-La和β-Lg含量采用的是C4或C8色谱柱[14-15].测定结果与已报道的牛乳中α-La和β-Lg总含量接近[3].值得注意的是,犏牛乳β-Lg存在遗传变异体[4],采用的HPLC方法可以定量该蛋白,但不能区分AE和BE这两种遗传变异体(图3),因为犏牛β-Lg在HPLC上既有显示单峰的,也有双峰的,且双峰分离不全,需要结合电泳方法才能准确对β-Lg进行基因分型(图4).本研究进行电泳检测也是为了探讨所用HPLC方法是否能区分犏牛乳β-Lg的遗传变异体.
β-Lg具有很多功能,但它是牛乳中最主要的过敏原,且耐胃酸、胃蛋白酶水解,消化后还会存在完整的分子或致敏肽段,易引起过敏反应[16].实验结果表明β-Lg在犏牛乳和全奶牦牛乳中的含量显著低于半奶牦牛乳,因此,尽管半奶牦牛乳营养成分含量高[13],但就β-Lg而言对过敏人群是不利的.犏牛乳类似于牦牛乳,也具有营养价值高、绿色无污染等优点.本研究表明其两种主要乳清蛋白总含量与牦牛乳接近(7.79 mg/mLvs7.98mg/mL),鉴于犏牛的产奶量显著高于牦牛[2],乳清蛋白含量接近,可把犏牛乳作为青藏高原地区的重要奶源.
4 结论
建立了HPLC检测牦牛和犏牛乳中α-La和β-Lg含量的方法,发现α-La在全奶牦牛、半奶牦牛和犏牛乳中含量接近,但β-Lg在半奶牦牛乳中含量显著高于全奶牦牛和犏牛;HPLC无法区分犏牛乳β-Lg的遗传变异体.

