HILIC-HPLC法检测三乙烯四胺铜的含量
廖欣怡,曹 雅,杨雅楠,仇丽颖
(西南民族大学药学院,四川 成都 610225)
三乙烯四胺铜(Triethylenetetramine copper,TETA-Cu)是一种由三乙烯四胺(triethylenetetramine,TETA)与二价铜经络合反应形成的金属络合物[1],化合物能通过自身的整体转运增加心肌细胞中铜的积累.很多动物及临床实验发现,病理性心肌肥大和心梗发生时存在铜从心脏流失的现象,补充铜后可逆转心肌肥大,也可部分恢复因心梗导致的心脏功能下降问题[12-13].TETA-Cu能促进心脏梗死区和边缘区的铜的积累,修复受损心肌细胞中铜的失衡状态[14].因此TETA-Cu对治疗心肌梗死等缺血性心脏疾病具有较大的潜力.
目前,该化合物正处于新药研发初始阶段,尚没有质量控制方法的相关报道.无论是原料药合成、制剂开发,还是药代动力学研究均需要一种对TETA-Cu准确定量的分析方法.截至目前,仅有一篇文献报道了TETA-Cu的检测方法[2].在这项研究中,采用超高分辨率飞行时间质谱法对TETA-Cu进行定性检测,却没有提到有关TETA-Cu的定量检测方法.该方法虽然灵敏度极高,但仪器价格昂贵,操作复杂且通常需要专人操作,因此不适用于药物的常规定量分析.
TETA-Cu在260 nm的紫外波长下有最大吸收,可采用紫外检测器以高效液相色谱法检测.此外,TETA-Cu是一种极性很强的水溶性化合物,难以通过RP-HPLC保留和分离,因此本文开发了一种HILIC-HPLC方法用于TETA-Cu的检测分析.HILIC全称亲水作用色谱(Hydrophilic interaction chromatography),是一种能将强极性物质保留下来的分离手段.它通过采用强极性的固定相,并利用水及与水互溶的有机相,如甲醇、乙腈等有机溶剂作为流动相实现对强极性物质的保留和分离.因为这一特性,HILIC色谱柱在有机酸、组胺、水溶性维生素等极性物质的分离有着广泛的应用.这一色谱技术的出现弥补了反相色谱对极性物质保留作用弱、保留时间短的现象.本文采用HILIC-HPLC法测定TETA-Cu的含量,方法简便,快速,准确,为今后TETA-Cu的新药研发提供有价值的质量控制方法.
1 实验与方法
1.1 试剂与仪器
实验试剂:乙腈(色谱纯,诺尔施科技有限责任公司)、甲醇(色谱纯,诺尔施科技有限责任公司)、戊烷磺酸钠(纯度99%,上海阿拉丁公司)、氢氧化钠(纯度95%,科隆化学试剂有限公司)、盐酸(分析纯,科隆化学试剂有限公司)、TETA-Cu供试品(自制)、TETA-Cu对照品(自制,含量大于99%),实验用水为超纯水.
实验仪器:高效液相色谱仪(岛津Essentia LC-16,配紫外检测器SPD-16,溶液输送单元LC-16);色谱柱Agilent ZORBAX RR HILIC Plus(4.6 × 100 mm,3.5 μm)(安捷伦科技有限公司);Agilent Polaris NH2HPLC column(4.6 × 250mm,5 μm)(安捷伦科技有限公司);Chromplus C18(4.6 × 150 mm,5 μm)(成都思为科学仪器有限公司);KQ5200DB超声波清洗仪(昆山市超声仪器有限公司);ME 55型电子分析天平(梅特勒托利多科技有限公司).
1.2 溶液的制备
对照品溶液:精密称定TETA-Cu对照品适量,用水溶解并稀释成不同浓度梯度的标准溶液(0.05、0.1、0.2、0.5、1 mg/mL).
供试品溶液:精密称取TETA-Cu供试品0.012 5 g,置于25 mL容量瓶中用水溶解并稀释至刻度,摇匀,得到浓度为0.5 mg/mL的供试品溶液,用于供试品溶液稳定性实验;取不同批次的TETA-Cu,分别精密量取0.007 5 g,置于25 mL容量瓶中用水溶解并定容至刻度,摇匀,得到浓度为0.3 mg/mL的溶液,用于含量测定.
1.3 色谱条件
色谱柱为;以乙腈-水为流动相,梯度洗脱程序为:0~10 min乙腈5 %~100 %,10~15 min乙腈;紫外检测波长为260 nm;进样量10 μL;流速为1 mL/min;柱温为室温;理论塔板数按TETA-Cu峰计应不低于5 000,外标法定量.
1.4 线性、范围、检测限和定量限
取“1.2”项下不同浓度梯度的对照品溶液,按照“1.3”项下的条件、按照低浓度至高浓度的顺序进行测定.以TETA-Cu的浓度为横坐标x,色谱峰面积为纵坐标y,绘制标准曲线,计算回归方程及相关系数;将对照品溶液稀释,以信噪比为10∶1时对应的浓度确定为定量限;信噪比为3∶1时对应的浓度确定为检测限.
1.5 加样回收试验
在已知浓度为0.3 mg/mL的TETA-Cu供试品溶液中,分别精密加入对照品适量,配制成低、中、高浓度为0.54、0.60、0.66 mg/mL的溶液,每个浓度平行制备三份,用“1.3”项下的条件进样检测,记录峰面积,计算回收率和RSD.
1.6 精密度考察
1.6.1 重复性
精密称取TETA-Cu对照品0.002 5、0.012 5、0.020 0 g,置于25 mL容量瓶中,用水溶解并稀释至刻度,摇匀,得到低、中、高浓度为0.1、0.5、0.8 mg/mL的对照品溶液.每个浓度平行制备三份,按照“1.3”项下的条件连续进样,记录色谱图和峰面积,计算峰面积的RSD来考察方法的重复性.
1.6.2 中间精密度
按照“1.6.1”项下方法连续五天配制低、中、高浓度的对照品溶液三份,按照“1.3”项下的条件进样,记录色谱图和峰面积,计算峰面积的RSD来考察方法的中间精密度.
1.7 专属性考察
1.7.1 酸水解试验
精密称取TETA-Cu供试品0.1 g,加入5 mL 0.1 mol/L盐酸溶解.室温放置15 min后,用稀氢氧化钠中和pH至中性,最后以水稀释至浓度约为1 mg/mL的溶液.按照“1.3”项下的条件进样,记录色谱图和峰面积.
1.7.2 碱水解试验
精密称取TETA-Cu供试品0.1 g,加入5 mL 0.1 mol/L氢氧化钠溶解.室温放置15 min后,用稀盐酸中和pH至中性,最后以水稀释至浓度约为1 mg/mL的溶液.按照“1.3”项下的条件进样,记录色谱图和峰面积.
1.7.3 高温、高湿、强光照射试验
分别将同一批次的TETA-Cu供试品,放置于高温(60 ℃)、高湿(环境湿度为95%)、强光(照射度4500±500lx)条件下3 d,称取适量,用水溶解并稀释至浓度为1 mg/mL的溶液.按照“1.3”项下的条件进样,记录色谱图和峰面积.
1.8 稳定性考察
1.8.1 供试品溶液的稳定性考察
按照“1.2”项下的方法,将新配制的浓度为0.5 mg/mL的供试品溶液置于室温下,分别于0、0.5、1、2、3、4、5、6、7、8 h取样,用“1.3”项下的条件进样检测,记录不同时间下供试品溶液的峰面积并计算RSD.
1.8.2 对照品溶液稳定性考察
按照“1.2”项下的方法,将新配制的浓度为0.5 mg/mL的对照品溶液置于4 ℃的环境中,分别在0.5、1、2、3、4 d取样,用“1.3”项下的条件进样检测,记录不同时间对照品溶液的峰面积并计算RSD.
1.9 TETA-Cu的含量测定
取三份不同批次的TETA-Cu供试品,按照“1.2”项下的方法分别配制成0.3 mg/mL的溶液进行含量测定.按照“1.3”项下的条件进样,记录峰面积带入标准曲线计算TETA-Cu含量.
2 结果与讨论
2.1 色谱条件的优化
TETA-Cu络合物具有高极性和强水溶性的特点.本实验采用3种不同类型的色谱柱对TETA-Cu的洗脱情况进行了筛选(见表1).首先采用C18柱,以甲醇-水为流动相,无论怎么改变流动相强度,TETA-Cu在色谱柱上均无保留;采用离子对色谱法在水相中添加离子配体(戊烷磺酸钠、辛烷磺酸钠),并对离子配体的浓度、流动相的pH以及强度进行筛选,TETA-Cu虽然在色谱柱上有保留,但分离度差,如图1a、图1b所示,因此不适用于定量分析.
其次,在氨基柱上分别采用甲醇-水、乙腈-水体系时,无论怎么改变流动相强度TETA-Cu的保留时间均在2 min左右,如图1e所示,说明氨基柱也不能用于TETA-Cu的保留和分离.
HILIC色谱柱对于极性强的物质有较好的保留性.本文参考谷胱甘肽的HPLC检测条件[15],以甲醇-0.05 mM甲酸铵水溶液(用甲酸调节pH至4.0),按照梯度0~10 min 5 %~100 %甲醇洗脱,结果如图1d所示.此条件下的TETA-Cu峰保留时间适中,但色谱峰很宽,调整梯度洗脱程序,仍不能改善峰型.以乙腈-水为流动相,洗脱程序为0~10 min 5 %~100 %乙腈进行洗脱,结果如图1c所示,在此条件下,TETA-Cu色谱峰保留时间为3.8 min,峰型尖锐,与杂质峰能有效分离,因此确定为TETA-Cu的色谱检测条件.

表1 色谱柱的选择Table 1 Selection of columns
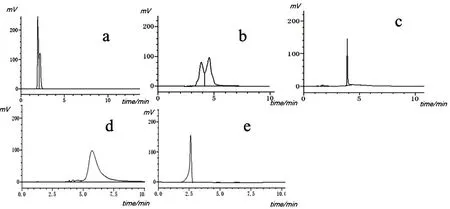
图1 TETA-Cu在不同色谱柱上的分离情况Fig.1 Chromatograms of TETA-Cu using different columns
2.2 方法学考察
2.2.1 线性范围、定量限及检测限
TETA-Cu的标准曲线如图2所示,回归方程为y=6×106x-34901,r为0.999 2.实验结果说明TETA-Cu在0.05~1 mg/mL范围内线性关系良好;测得定量限为0.05 mg(S/N=10);检测限为0.007 5 mg(S/N=3).
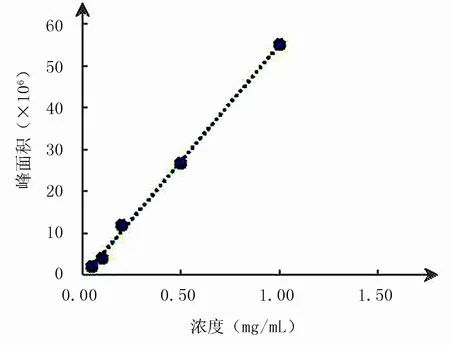
图2 TETA-Cu线性范围考察Fig.2 Calibration curves of TETA-Cu
2.2.2 加样回收试验
加样回收试验结果如表2所示,低、中、高三个水平的平均加样回收率为99.0%,RSD为1.43%,说明该方法准确度较好,能满足定量分析要求.
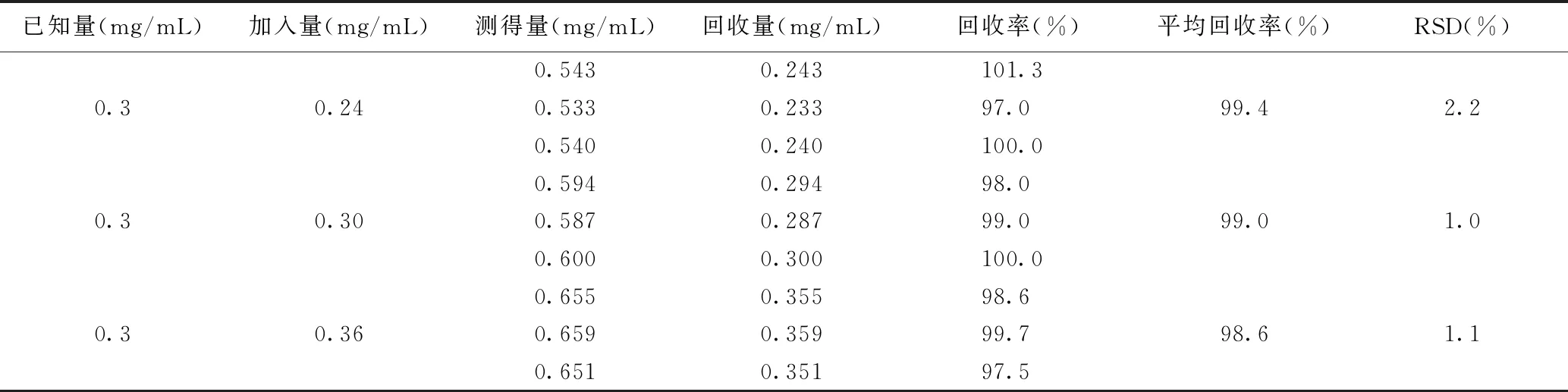
表2 加样回收试验结果Table 2 The recovery test of TETA-Cu
2.2.3 精密度考察
(1)重复性试验
低、中、高浓度的对照品溶液的峰面积及RSD结果见表3,在低、中、高浓度下峰面积的RSD均不高于2.5%,说明该方法的重复性良好.
(2)中间精密度
连续5 d对低、中、高浓度对照品溶液进行测量,各浓度下峰面积的RSD均低于3%(见表4),说明该方法中间精密度良好.
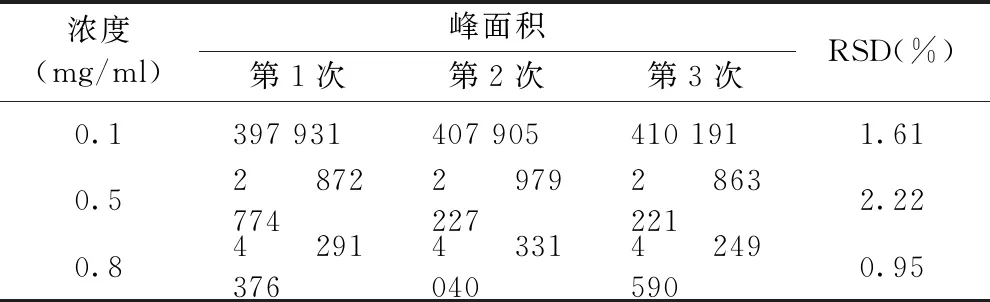
表3 重复性试验结果Table 3 The repeatability test of quantifying TETA-Cu
2.2.4 专属性考察
由图3的实验结果表明,各种降解实验中分解产物的存在,不影响TETA-Cu的检测.因此,本方法的专属性良好.
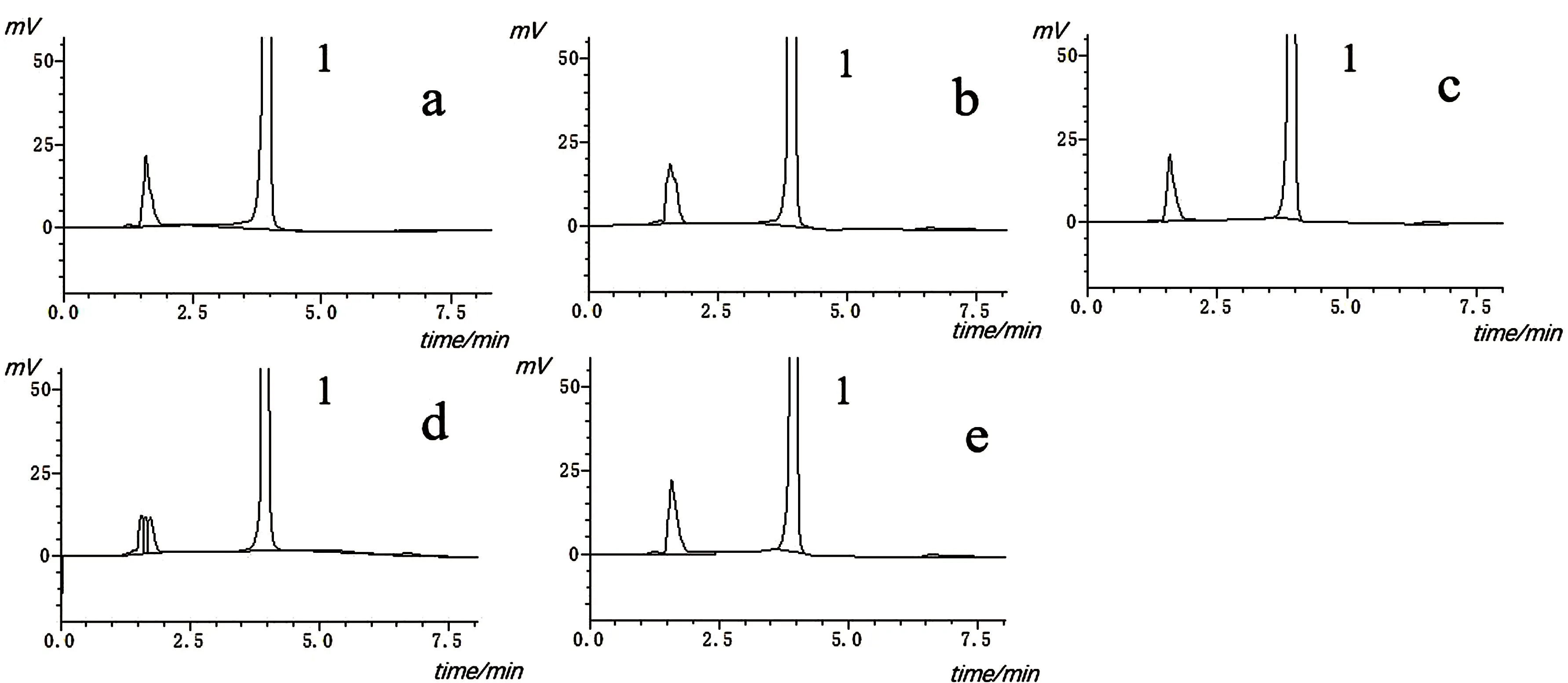
图3 专属性考察色谱图Fig.3 Chromatograms of specificity tests
2.2.5 稳定性考察
(1)供试品溶液的稳定性考察
供试品溶液在室温下稳定性考察结果如表5所示.室温下0~5 h,TETA-Cu供试品峰面积差异不大,RSD值为2.47%,溶液基本能保持稳定.在室温下放置超过6 h后,峰面积开始发生变化并且随着时间推移峰面积逐渐变得不稳定,6~8 h峰面积的RSD值为15.87%.

表5 供试品溶液室温下的稳定性试验Table 5 The stability test of TETA-Cu at room temperature
(2)对照品溶液稳定性考察
对照品溶液在4 ℃下稳定性考察结果如表6所示.对照品溶液在4 ℃环境下4 d内能保持稳定.

表6 对照品溶液在4 ℃下稳定性试验数据Table 6 The stability test of TETA-Cu at 4 ℃
2.2.6 TETA-Cu含量测定结果
选取不同批次合成的TETA-Cu按照上述方法进行含量测定,结果如表7所示.

表7 三个批次的TETA-Cu含量测定结果Table 7 Contents of three different batches of TETA-Cu
3 结论
TETA-Cu是一种极性很强的化合物,本文采用不同类别的色谱柱对其进行分离,发现TETA-Cu在C18柱和氨基柱上基本无保留,采用离子对色谱虽然有保留,但峰型展宽严重,也不适于TETA-Cu的定量分析.在本实验中,HILIC柱对TETA-Cu具有较合适的保留和分离作用,在使用乙腈-水作为流动相对化合物进行梯度洗脱后,保留时间约4 min,与杂质峰分离度良好,适用于TETA-Cu的分析检测.
因此,本文建立了一种采用HILIC-HPLC测定TETA-Cu含量的新方法,该方法采用乙腈-水的体系进行梯度洗脱,TETA-Cu保留时间适中,操作简单方便,不仅适用于常规检验,也具有与MS联合使用的潜力,为生物样品中针对该化合物的分析检测提供了参考并为今后该药物研发与临床应用提供一种可靠的定量分析方法.

