整合生物信息学与实验验证解析黄芪-莪术药对抗肝癌配伍机制
鲍 宁 ,陈子超,刘名玉,赵春芹,李 肖*,张 振*
1.山东中医药大学 中医药创新研究院,山东 济南 250355
2.山东中医药大学药学院,山东 济南 250355
3.山东中医药大学 实验中心,山东 济南 250355
原发性肝癌是我国第4 位常见恶性肿瘤及第2位肿瘤致死病因,其中约90%为肝细胞癌[1]。肝癌的发生、发展机制复杂,涉及多个原癌基因以及信号通路[2]。近年来,中药在肝癌的预防、控制转移与复发等方面所具有的优势,使其成为抗肝癌新药研发的热点和方向[3-5]。目前中医药界对于肝癌的理论及治疗研究逐渐增多,并形成了较为统一的认识,其病机在于气虚血瘀,其治法以益气活血为主[6]。黄芪-莪术是益气活血法代表性药对,源于张锡纯所著《医学衷中参西录》中的理冲汤,主治气虚血瘀证[7]。从中医理论讲,黄芪味甘性微温,可补气升阳,为“补中益气之要药”[8];莪术辛散苦泄,能破血散瘀,又能行气化积,是“破血化瘀之重药”[9];两药配伍使用“破中有补,补中有行,相得益彰”从而达到“补而不滞”之效,为益气活血配伍的典型代表[10]。孙桂芝教授擅用桃红芪术软肝煎起益气活血之效,认为黄芪-莪术配伍治疗肝癌时能够补脾胃、破癥消积,对肝癌有很好的抑制作用,在临床实践中运用此法与化疗联合使用,能够明显改善肝癌患者的生存质量,在提高肝癌远期疗效上具有一定优势[11-13]。黄芪-莪术药对配伍治疗肝癌的作用确切,在抗肝癌中药中具有重要地位,但是黄芪-莪术药对抗肝癌的配伍机制尚不明确。本研究整合生物信息学与网络药理学预测黄芪-莪术药对治疗肝癌的相关靶点和通路,将筛选得到的核心成分与靶点进行分子对接,探究黄芪-莪术药对的多成分、多靶点、多通路的配伍协同作用机制,并采用体外细胞实验对核心成分和靶点进行验证。系统研究黄芪-莪术药对抗肝癌配伍机制,不仅可为含有该药对的抗肝癌系列类方的研究提供参考,而且有利于指导中医临床的合理用药,同时为该类方的质量控制和新药研发提供重要的科学依据,为肝癌这一发病率日趋升高、严重威胁人类健康的重大疑难疾病治疗做出贡献。
1 材料
1.1 细胞株
人肝癌HepG2 细胞、人正常LO2 肝细胞购自中国科学院上海细胞库。
1.2 药品与试剂
DMEM 高糖培养基(批号G4511-500ML)、二甲基亚砜(dimethyl sulfoxide,DMSO,批号GC203002-100ml)购自武汉塞维尔生物科技有限公司;胰蛋白酶(批号C0208-500ml)、RIPA 强裂解液(批号P0013B)、MTT(批号ST316)购自上海碧云天生物科技有限公司;黄芪皂苷II(批号SJMN1426)、黄芪甲苷(批号SJ-MN0659)、芒柄花素(批号SJ-MN0281)、姜黄素(批号SJ-MN0060)、莪术醇(批号SJ-MN0198)、双去甲氧基姜黄素(批号SJ-MN1811)购自山东思科捷生物技术有限公司,质量分数均≥98%;细胞周期蛋白依赖性激酶1(cyclin-dependent kinase 1,CDK1)抗体(批号db12527)、细胞周期蛋白B1(cyclin B1,CCNB1)抗体(批号db13323)购自杭州戴格生物技术有限公司;β-actin 抗体(批号PTG81115-1-RR)购自武汉三鹰生物技术有限公司;HRP 标记的山羊抗兔单克隆抗体(批号AS014)购自武汉爱博泰克生物科技有限公司。
1.3 仪器
BB150 型CO2细胞恒温培养箱、NanoDrop™Lite 微量分光光度计、Multiskan SkyHigh 全波长酶标仪号(美国Thermo Fisher Scientific 公司);电泳仪、ChemiDoc XRS+凝胶成像仪(美国Bio-Rad 公司);Centrifuge 5425R 型低温高速离心机(德国Eppendorf 公司);Accuri C6 Plus 型流式细胞仪(美国BD 公司)。
2 方法
2.1 生物信息学分析
2.1.1 肝癌靶点筛选 以“ hepatocellular carcinoma”为关键词在NCBI(https://www.ncbi.nlm.nih.gov/)GEO 数据库中检索并下载与肝癌相关的GSE57957[14]、GSE60502[15]、GSE84402[16]基因表达谱,芯片平台分别为 GPL10558、GPL96[HGU133A]、GPL570[HG-U133_Plus_2],共收集142(78、36、28)例样本,其中肝癌组织样本71(39、18、14)例,癌旁组织样本71(39、18、14)例。将以上3 个基因表达谱通过归一化和基于log2转化进行定量,之后使用R 软件包stats(version 3.6.0)进行主成分分析(principal component analysis,PCA)[17],同时使用R 软件包“Limma”包[18](version 3.40.6)进行差异表达基因(differential expression genes,DEGs)筛选,筛选条件为|log2FC|>1[FC 表示倍数变化(fold change)]和P值<0.05,将3 组数据集筛选得到的DEGs 合并,作为肝癌靶点。
2.1.2 肝癌关键靶点筛选 通过STRING(https://cn.string-db.org/)数据库对“2.1.1”项下肝癌靶点进行分析,设置物种为“Homo sapiens”,所有参数选择默认值,导出tsv 格式的数据并输入到Cytoscape(version 3.9.1)软件中构建蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络,然后利用MCODE 插件对PPI 网络中联系紧密的功能模块进行分析,分析条件为“Degree Cutoff=2、Node Score Cutoff=0.2、k-Core=2、Max.Depth=100”。将得分最高的功能模块的子网中所含靶点作为肝癌关键靶点[19]。
2.1.3 黄芪、莪术化学成分收集及潜在活性成分筛选 在TCMSP(https://tcmspw.com/tcmsp.php)数据库中对黄芪、莪术成分进行检索;将人体口服生物利用度(oral bioavailability,OB)≥30%、药物相似性(drug-likeness,DL)≥0.18 的成分作为潜在活性成分,并结合文献报道,将具有体内外抗癌活性的黄芪、莪术成分补充到潜在活性成分中[20-21]。
2.1.4 黄芪、莪术活性成分靶点预测与抗肝癌靶点筛选 在PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库中检索“2.1.3”项下活性成分的Isomeric SMILES 数据,将该数据输入SEA(http://sea.bkslab.org/)和 SwissTargetPrediction(http://www.swiss targetprediction.ch/)2 个数据库,预测成分靶点,与TCMSP 数据库中的靶点取并集得到潜在活性成分作用靶点,并在Uniprot 数据库中对靶点基因名称进行校正,使蛋白质靶点信息标准化[22]。将成分作用靶点与“2.1.1”项下所筛选肝癌靶点取交集,得到黄芪、莪术抗肝癌靶点。
2.1.5 黄芪、莪术抗肝癌关键成分筛选 将“2.1.4”项下潜在活性成分靶点与“2.1.2”项下所筛选肝癌关键靶点取交集,采取疾病关键靶点“反向钩钓”关键潜在活性成分的方式,得到黄芪、莪术抗肝癌关键成分及其靶点。
2.1.6 黄芪、莪术抗肝癌靶点及关键靶点京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析 通过KEGG rest API(https://www.kegg.jp/kegg/rest/keggapi.html)获取最新KEGG 通路基因注释,使用R 软件包cluster Profiler(version 3.14.3)进行富集分析,设定阈值最小基因集为5、最大基因集为5 000、P<0.05、FDR<0.1,根据包含靶点数量筛选排名靠前的KEGG 富集信息[23]。
2.1.7 拓扑网络构建与分析 采用 Cytoscape(version 3.9.1)软件构建肝癌关键靶点的PPI 网络、成分-靶点网络、关键成分-靶点-通路网络。通过Network Analyzer 插件对关键成分-靶点-通路网络的拓扑性质进行分析,获取成分、靶点、通路相关介数值。
2.1.8 黄芪、莪术抗肝癌核心成分及其抗肝癌核心靶点筛选 通过1 种网络贡献指数(CI)评价黄芪-莪术抗肝癌成分发挥抗肝癌作用的贡献大小[24]。
i为成分的数量;j为靶点的数量;ωei为网络节点参数;Aij为根据ωei值确定的亲和力指数;CAi为黄芪关键成分-靶点-通路网络中每种抗肝癌成分的介数;CBi为莪术关键成分-靶点-通路网络中每种抗肝癌成分的介数,Ci为每种抗肝癌成分的介数;Pj为每种靶点的介数,以参数由关键成分-靶点-通路网络中获得;NEi为网络中1 种抗肝癌成分的网络贡献;CI 为抗肝癌成分发挥抗肝癌作用的贡献大小
以“hepatocellular carcinoma”和“liver cancer”及活性成分的常用名称用作为关键词,检索1990—2018 年出版于PubMed 和CNKI 数据库中的相关文献。如果前N个成分的CI 总和超过50%,则认为这些相关的N个成分对黄芪和莪术发挥抗肝癌作用的贡献最大;CI 总和超过90%,则认为这些相关的N个成分对黄芪和莪术发挥抗肝癌作用的贡献最主要。核心成分在关键成分-靶点-通路网络中所调节的介数大于5 的靶点为抗肝癌核心靶点。
2.1.9 黄芪、莪术抗肝癌核心成分与靶点分子对接验证 在PubChem 数据库中获得化合物的SDF 文件,然后通过Open Babel 3.1.1 软件将获得的SDF 文件转化为MOL2 格式;从AlphaFold 蛋白质结构数据库(AlphaFold Protein Structure Database,https://alphafold.ebi.ac.uk/)获取抗肝癌核心靶点的PDB 文件;靶蛋白与化合物均使用Auto Dock Tools1.5.6 去除水分子、加氢、计算电荷等前处理,转化为PDBQT格式;利用Autodock Vina 1.1.2 软件进行分子对接,分子对接的结合能越低表示构象越稳定,对结果进行分析,绘制分子对接结合能热图[21]。
2.1.10 核心基因在肿瘤及正常组织表达量差异分析 在癌症基因组图谱(cancer genome atlas,TCGA)网站中得到核心基因在肿瘤组织及正常组织中的表达量,进行差异表达分析[25]。
2.2 细胞实验验证
2.2.1 MTT 实验 将处于对数生长期的HepG2 和LO2 细胞分别以5 000 个/孔接种到96 孔板中,培养24 h 后,分别给予不同浓度的黄芪皂苷II、黄芪甲苷、芒柄花素、莪术醇、姜黄素、双去甲氧基姜黄素,对照组加入不含药物的培养基,同时设置调零孔(不接种细胞),处理24、48、72 h,处理后每孔加入10 μL MTT(5 mg/mL),37 ℃孵育4 h;去上清,加入100 μL DMSO 终止孵育,使用酶标仪测定570 nm 处的吸光度(A)值,计算细胞存活率。
细胞存活率=(A给药-A调零)/(A对照-A调零)
2.2.2 药物协同作用研究 根据“2.2.1”项结果,从黄芪、莪术各成分中各选1 个作用效果最佳的单体,进行药物协同作用研究。细胞存活率的结果通过Chou-Talalay 模型进行分析,以评价黄芪-莪术成分配伍的协同作用,明确最佳协同剂量,CompuSyn软件采用Chou-Talalay 模型计算药物组合的组合指数,组合指数=1 为加和效应,组合指数<1 为协同作用,组合指数>1 为拮抗作用[24]。
2.2.3 流式细胞术检测细胞周期 将HepG2 细胞以2.5×105个/孔接种于6 孔板中,培养24 h 后分别给予黄芪皂苷II(5 μmol/L)、双去甲氧基姜黄素(5 μmol/L)及黄芪皂苷II(2.5 μmol/L)+双去甲氧基姜黄素(2.5 μmol/L),以不含药液的培养基作为对照,处理24 h 后收集细胞,细胞密度调整为1×106个/mL,用预冷的PBS 洗涤2 次,然后加入500 μL预冷的70%乙醇固定,−4 ℃过夜,细胞离心后在沉淀中加入100 μL RNaseA 溶液,37 ℃孵育30 min,加入400 μL 碘化丙啶(PI)染色液,于4 ℃避光孵育30 min 后上机检测[26]。
2.2.4 Western blotting 法检测蛋白表达 选择“2.2.2”项单体对应的靶点在Pymol 软件中进行分子对接可视化,并通过Western blotting 实验验证单体对蛋白表达的影响。分组与给药同“2.2.3”项,收集药物作用后的HepG2 细胞,加入细胞裂解液提取总蛋白,使用Nanodrop lite 检测蛋白浓度,蛋白样品经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,经5%脱脂奶粉封闭后,加入一抗,4 ℃孵育过夜;加入二抗,37 ℃孵育2 h,使用ECL 化学发光试剂盒显影,采用Image J 软件分析条带灰度值。
2.2.5 统计学分析 数据使用Graphpad Prism 9.5软件处理,采用单因素方差分析进行组间统计。
3 结果
3.1 肝癌靶点及关键肝癌靶点
对GSE57957、GSE60502、GSE84402 肝癌基因表达数据进行PCA,结果显示在3 个数据集中,肝癌组织与癌旁组织基因表达均能明显区分(图1-A~C);进一步Limma 分析,结果显示在3 组数据中DEGs 分别有353 个(上调85 个,下调268 个)、1 241 个(上调575 个,下调666 个)、1 689 个(上调1 031 个,下调658 个,图1-D~F);将以上3 组数据中的DEGs 取并集,共得到肝癌靶点2 766 个(图1-G);进一步疾病关键靶点分析,结果显示PPI网络中得分最大为97.33 的MCODE 功能模块所含有的112 个靶点为肝癌关键靶点(图1-H)。
3.2 黄芪、莪术活性成分及其抗肝癌靶点和KEGG通路
通过检索TCMIP 数据库,得到黄芪化学成分87 种,经筛选潜在活性成分26 种,其中OB≥30%、DL≥0.18 的成分20 种(AR-1~AR-20),通过文献补充的成分6 种(AR-21~AR-26);得到莪术化学成分81 种,经筛选潜在活性成分13 种,其中OB≥30%、DL≥0.18 的成分3 种(CR-1~CR-3),通过文献补充的成分10 种(CR-4~CR-13),黄芪与莪术共有成分1 种(常春藤皂苷元),共得到黄芪-莪术药对潜在活性成分38 种(表1)。
采用TCMSP、SEA、SwisstargetPrediction 数据库预测得到38 种潜在活性成分靶点1 177 个,与“3.1”项下2 766 个肝癌靶点取交集,得到黄芪-莪术抗肝癌活性成分33 个,其中黄芪22 个(无AR-7、AR-13、AR-15、AR-20),莪术12 个(无CR-9),两者共有成分1 个(AR-3、CR-1),对应抗肝癌靶点180 个,其中黄芪独有靶点77 个、莪术独有靶点14 个、两者共有靶点89 个(图2-A)。

图2 黄芪-莪术抗肝癌成分-靶点网络 (A) 和KEGG 富集分析 (B)Fig.2 Anti-hepatocellular carcinoma component of Astragali Radix-Curcumae Rhizoma-target network (A) and KEGGenrichment analysis (B)
分别对黄芪166 个靶点、莪术103 个靶点进行KEGG 富集分析,根据包含靶点数量筛选排名前20的通路,结果显示,黄芪与莪术所调节的20 条通路中,共有通路有9 条;其中黄芪中排名前5 位的通路分别为代谢途径、癌症的通路、神经活性配体-受体相互作用、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)-蛋白激酶B(protein kinase B,Akt)信号通路、细胞周期,莪术中排名前5 位的通路分别为代谢途径、癌症的通路、类固醇激素生物合成、胆汁分泌、化学致癌(图2-B)。
3.3 黄芪、莪术抗肝癌关键成分及其靶点和KEGG通路
通过肝癌关键靶点进行“反向钩钓”,得到黄芪-莪术抗肝癌关键成分29 种,其中黄芪抗肝癌关键成分22 种、莪术抗肝癌关键成分8 种,两者共有抗肝癌关键成分1 种(常春藤皂苷元,图3-A)。29 种黄芪-莪术抗肝癌关键成分所调节抗肝癌关键靶点15 个,对以上靶点进行KEGG 富集分析,共得到17 条通路,其中最为重要的细胞过程包含细胞周期、细胞衰老、p53 信号通路、卵母细胞减数分裂、细胞凋亡-多个物种共5 条信号通路(图3-B)。

图3 黄芪-莪术抗肝癌关键成分-靶点-通路网络 (A) 和KEGG 富集分析 (B)Fig.3 Key component of Astragali Radix-Curcumae Rhizoma against hepatocellular carcinoma-target-pathway network (A)and KEGG enrichment analysis (B)
3.4 黄芪、莪术抗肝癌核心成分和靶点的分子对接
通过网络贡献指数模型,计算黄芪-莪术抗肝癌29 种关键成分的抗肝癌作用贡献指数。根据计算结果,CI 值合计为55.67%的前6 种成分均为黄芪成分,表明其抗肿瘤作用贡献最大;CI 值合计为90.64%的前17 种成分中莪术成分有2 种,在一定程度上表明黄芪-莪术配伍发挥协同抗肿瘤作用(图4-A)。根据成分CI 值及其所在中药中的相对特异性,选取黄芪中的黄芪皂苷II、黄芪甲苷、芒柄花素与莪术中的莪术醇、姜黄素、双去甲氧基姜黄素共6 种成分作为黄芪-莪术药对的核心代表性成分,与之相对应的 CDK1、DNA 拓扑异构酶 2A(topoisomerase 2A,TOP2A)、极光激酶B(aurora B,AURKB)、检查点蛋白激酶1(check point kinase 1,CHEK1)、AURKA 共5 个靶点为核心靶点。对分子对接得分进行热图分析,结果显示CDK1 与这6 个核心成分均有较好的结合活性(结合能均<−5 kJ/moL,图4-B)。将上述5 个靶点在肿瘤组织与正常组织之间的表达量差异进行分析,结果显示以上5 个靶点在肝癌组织及正常组织中的表达均有较大差异(图4-C)。
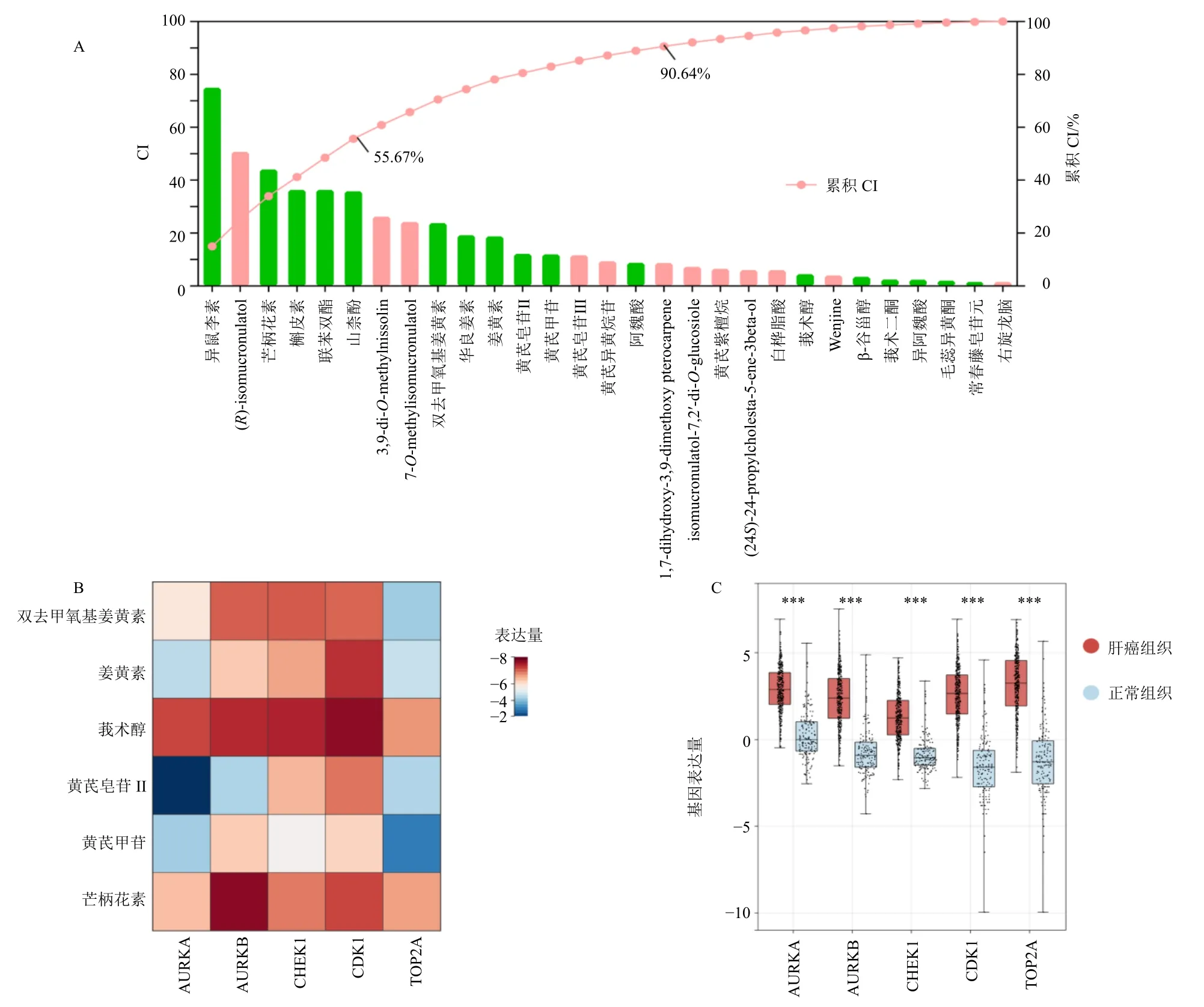
图4 黄芪-莪术抗肝癌关键成分贡献指数图 (A)、分子对接得分热图 (B)、正常组织和肿瘤组织核心靶点基因表达 (C)Fig.4 Contribution index plot of key components of Astragali Radix-Curcumae Rhizoma against hepatocellular (A),molecular docking score heat map (B), gene expressions of core targets between normal and tumor tissues (C)
3.5 黄芪、莪术活性成分对HepG2 细胞增殖的抑制作用
如图5 所示,不同浓度的黄芪皂苷II、黄芪甲苷、芒柄花素、姜黄素、莪术醇、双去甲氧基姜黄素对HepG2 细胞均有一定的抑制作用,且呈剂量相关性,应用Graphpad Prism 9.5 软件计算各单体作用于HepG2 细胞 24 h 的半数抑制浓度(half inhibitory concentration,IC50)分别为黄芪皂苷II 12.22 μmol/L、芒柄花素34.03 μmol/L、黄芪甲苷223.9 μmol/L、双去甲氧基姜黄素9.797 μmol/L、姜黄素46.31 μmol/L、莪术醇206.7 μmol/L。黄芪甲苷(0~25 μmol/L)、黄芪皂苷II(0~20 μmol/L)、芒柄花素(0~20 μmol/L)、姜黄素(0~20 μmol/L)、双去甲氧基姜黄素(0~20 μmol/L)、莪术醇(0~50 μmol/L)在一定的浓度范围内对LO2 细胞活性几乎无影响。
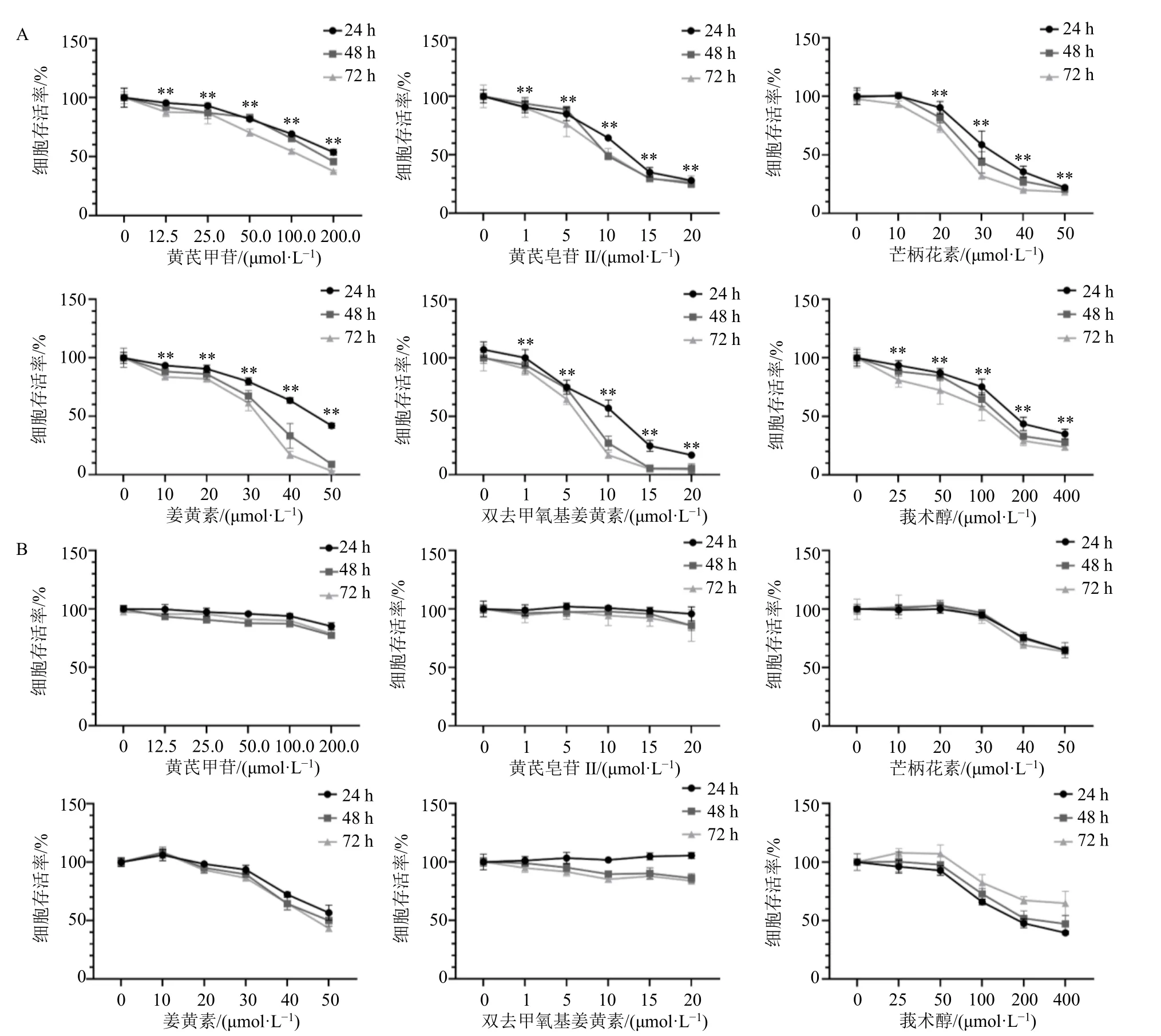
图5 黄芪-莪术药对活性成分对HepG2 (A) 及LO2 (B) 细胞活性的影响 (±s, n = 3)Fig.5 Effect of active ingredients of Astragali Radix-Curcumae Rhizoma herb pair on viability of HepG2 (A) and LO2 (B)cells (±s , n = 3)
3.6 药物协同作用研究
为了评价黄芪-莪术药对成分配伍的体外抗肿瘤协同作用,选择双去甲氧基姜黄素和黄芪皂苷II进行协同作用研究,通过Chou-Talalay 数学模型进行协同作用效果评价[27]。结果如图6 所示,与单独药物作用相比,联合组的细胞活力显著降低(P<0.05、0.01)。为了查明该组合是否起到加和作用或协同作用,使用CompuSyn 软件进一步分析细胞活性数据,结果表明各浓度的双去甲氧基姜黄素和黄芪皂苷II 在中位有效剂量(组合指数<1)时均表现出协同作用,其最佳协同剂量为0.625 μmol/L 黄芪皂苷II 和0.625 μmol/L 双去甲氧基姜黄素。

图6 双去甲氧基姜黄素和黄芪皂苷II 的协同抗肝癌作用 (±s, n = 3)Fig.6 Synergistic anti-hepatocellular carcinoma effect of bisdemethoxycurcumin and astragaloside II (±s, n = 3)
3.7 双去甲氧基姜黄素与黄芪皂苷II 对Hep G2 细胞周期的影响
细胞周期检测结果显示,黄芪皂苷II(5 μmol/L)和双去甲氧基姜黄素(5 μmol/L)以及联合给药(黄芪皂苷 II 2.5 μmol/L+双去甲氧基姜黄素 2.5 μmol/L)处理HepG2 细胞24 h 后可导致细胞周期异常。如图7 所示,与对照组比较,不同组别药物处理HepG2 细胞24 h 后,各组G2/M 期的细胞比例均升高。与单用黄芪皂苷II 和双去甲氧基姜黄素组相比,联合组G2/M 期细胞比例显著升高(P<0.01),上述结果提示黄芪皂苷II 与双去甲氧基姜黄素均能诱导HepG2 细胞周期停滞于G2/M 期,且联用效果更佳(P<0.01)。
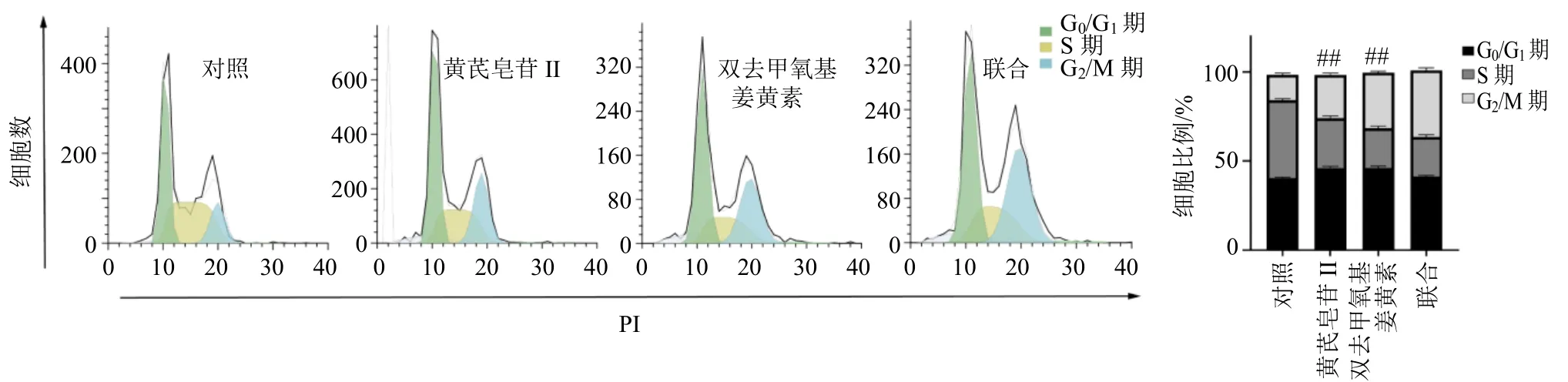
图7 双去甲氧基姜黄素、黄芪皂苷II 以及联合组对HepG2 细胞周期的影响 (±s , n = 3)Fig.7 Effect of bisdemethoxycurcumin, astragaloside II and combination group on cycle of HepG2 cells (±s , n = 3)
3.8 分子对接及Western blotting 法检测蛋白表达
利用Pymol 软件将“3.4”项的黄芪皂苷II、双去甲氧基姜黄素与CDK1 的对接情况进行可视化,结果如图8-A 所示,黄芪皂苷II 与CDK1 结合能力较强,分别在ASP-92、GLN-132、THR-14 形成H 键,结合能为−6.27 kJ/mol;双去甲氧基姜黄素与CDK1结合能力较强,分别在THR-14、THR-47 形成H 键,结合能为−7.04 kJ/mol。蛋白表达结果显示,黄芪皂苷II(5 μmol/L)组、双去甲氧基姜黄素(5 μmol/L)组以及联合组细胞CDK1 和CCNB1 蛋白表达水平均显著低于对照组(P<0.05、0.01),且联合组效果较单药组显著(P<0.05、0.01,图8-B)。

图8 双去甲氧基姜黄素、黄芪皂苷II 与CDK1 的分子对接 (A) 和双去甲氧基姜黄素、黄芪皂苷II 以及联合组对HepG2细胞周期蛋白表达 (B) 的影响 (±s , n = 3)Fig.8 Docking of bisdemethoxycurcumin and astragaloside II to CDK1 (A), effect of bisdemethoxycurcumin, astragaloside II and combination group on cyclin protein expressions (B) in HepG2 cells (±s , n = 3)
4 讨论
古今医家多认为正气亏虚为肝癌的发病内因和前提,瘀血凝滞是肝癌发病的基本病理因素,正气不足、瘀血阻滞始终伴随着肝癌的发生、发展和转移[28]。因此临床治疗肝癌常将黄芪、莪术等益气药与活血药配伍使用,不仅可辅助正气,同时能行气活血,两者兼顾,共凑扶正祛邪之效[11-13,29-30]。
本研究利用生物信息学结合网络药理学与分子对接技术探究黄芪-莪术药对治疗肝癌的活性成分、潜在靶点和信号通路,进而揭示其配伍机制。结果显示,黄芪-莪术抗肝癌活性成分33 种,其中黄芪22 种、莪术12 种、两者共有成分1 种;对应抗肝癌靶点180 个,其中黄芪调节77 个、莪术调节14个、两者共同调节89 个;KEGG 通路富集分析显示黄芪-莪术药对调节抗肝癌通路31 条,其中黄芪调节20 条、莪术调节20 条、共同调节9 条。以上结果从成分、靶点、通路3 个方面揭示了黄芪、莪术配伍协同抗肝癌的科学内涵。
KEGG 通路结果显示黄芪-莪术药对主要通过细胞周期、细胞衰老、p53 信号通路、细胞凋亡、代谢通路等发挥抗肝癌作用。其中细胞周期、p53 信号通路是与肿瘤发生发展密切相关的信号通路,在调控肝癌细胞周期、增殖、凋亡、细胞代谢等行为上发挥重要作用。p53 作为一种转录因子,通过调节其下游基因的表达来调控细胞周期阻滞、细胞衰老、DNA 修复和细胞凋亡等过程,p53 缺失不仅会引起细胞分裂的增加和细胞存活率的提高,还会引起更具侵袭性的行为和基因组不稳定性的增加[31]。p53 下游靶蛋白p21 和CDK2 调控细胞周期的进行,CDK2 与CCNA、CCNE 相互作用可使Rb 蛋白磷酸化,从而促进细胞从G1期进入S 期,p21 可以抑制其相互作用从而抑制细胞周期进程[32-33]。
经筛选得到的6 个核心成分(黄芪甲苷、黄芪皂苷II、芒柄花素、姜黄素、双去甲氧基姜黄素、莪术醇),均具有不同程度的抗肿瘤作用,其调控的5 个核心基因(CDK1、CHEK1、TOP2A、AURKA、AURKB),在肿瘤发生发展过程中同样具有重要的调控作用。研究表明,AURK 是一类丝/苏氨酸激酶,可以通过干扰中心体、纺锤体以及染色体的功能影响细胞的有丝分裂,AURKA 调节有丝分裂早期中心体成熟,参与建立双极纺锤体,其功能的有效发挥离不开周期蛋白B 与CDK 复合物(cyclin BCDK1)的正常作用,活化的cyclin B-CDK1 可以使蛋白磷酸酶1(protein phosphatase 1,PP1)失活,PP1 可以抑制AURKA 活性[34]。CDK1 是调控细胞周期的关键蛋白,CHEK1 为调控CDK 蛋白的上游蛋白,CHEK1 的磷酸化能够导致细胞分裂周期因子25A/C(cell division cyclin 25A/C,CDC25A/C)的磷酸化失活,从而抑制CDK1 进入有丝分裂G2/M期[35]。分子对接结果显示核心成分(黄芪甲苷、黄芪皂苷II、芒柄花素、姜黄素、双去甲氧基姜黄素、莪术醇)与核心靶点(CDK1、CHEK1、TOP2A、AURKB、AURKA)结合能较强,可能存在较好的结合活性。研究发现,芒柄花素通过环氧合酶-2/CCND 轴将人肝癌Bel-7402 细胞和HepG2 细胞阻滞于G0/G1期[36-37];莪术醇可以阻滞HepG2 细胞于G1期[38];黄芪甲苷能够上调具有低转移潜能和高转移潜能的人肝癌Huh7 细胞和人肝癌MHCC97-H 细胞中E-钙黏蛋白的蛋白水平并促进其在细胞膜上积累,使得细胞间连接更加紧密从而降低转移扩散能力;姜黄素能够通过激活Huh7 细胞内死亡受体介导的通路诱导凋亡[39];且黄芪甲苷与姜黄素联用对血管生长因子(vascular endothelial growth factor,VEGF)、基质金属蛋白酶2(matrix metallopeptidase 2,MMP2)、成纤维细胞生长因子-2(fibroblast growth factor-2,FGF-2)、肝细胞生长因子(hepatocyte growth factor,HGF)以及血栓形成相关因子组织因子(tissue factor,TF)和凝血因子VII 有协同抑制作用[40]。
通过体外细胞实验验证了黄芪-莪术药对6 个核心成分对HepG2 细胞的增殖均具有明显的抑制作用。协同作用分析结果显示,黄芪中的黄芪皂苷II 和莪术中的双去甲氧基姜黄素配伍有协同作用,其最佳协同剂量为黄芪皂苷II 0.625 μmol/L、双去甲氧基姜黄素0.625 μmol/L。2 个成分配伍使用可协同增效抑制周期调控蛋白CDK1 和CCNB1 的表达,进而诱导HepG2 细胞停滞于G2/M 期。
本研究基于生物信息学数据,结合网络药理学方法与分子对接技术及细胞实验证明了黄芪、莪术配伍能够通过多成分、多靶点、多通路在肝癌治疗中发挥协同作用,为更准确寻找、确认和优化黄芪、莪术发挥抗肝癌效应的有效成分与靶点的作用,推动临床应用提供新的见解。
利益冲突所有作者均声明不存在利益冲突

