吴茱萸碱磷脂复合物自微乳给药系统的胃溃疡靶向效应及保护作用评价
温 健,刘 文*,宋朔尧,李和蓉,金 阳, ,张 环,石惠云,王守莉
1.贵州医科大学药学院,贵州 贵阳 550025
2.易慧生物技术(上海)有限公司,上海 200120
3.贵州医科大学 贵州省药物制剂重点实验室,贵州 贵阳 550004
口服给药由于具备便捷性、顺应性等优势,是目前治疗胃溃疡最常用、最有效的给药方式[1-2],但在复杂的胃内环境中,药物常规剂型的治疗效果往往不太理想[3-6]。现代药理学研究表明[7-9],吴茱萸碱(evodiamin,Evo)对胃部疾病的治疗效果极为明显。但由于吴茱萸碱存在水溶性差,缺乏靶向治疗作用等缺点,极大地限制了其临床应用[10-11]。针对吴茱萸碱口服制剂在应用中存在的问题,本研究设计了吴茱萸碱磷脂复合物自微乳给药系统(evodiamine phospholipid complex self-emulsifying drug delivery system,Evo-PC-SMEDDS)以改善其性质,在前期实验中,确定了Evo-PC-SMEDDS 最佳的制备工艺,对所制得的药物进行了表征,并对其胃黏膜渗透性进行了评价[12],证实所制得的Evo-PC-SMEDDS 具备良好的稳定性,并可显著改善吴茱萸碱的体外释放能力和胃黏膜渗透性,具有进一步深入研究的潜力。
对于Evo-PC-SMEDDS 跨黏膜转运效应的评价仅仅只停留在体外水平,缺乏体内验证过程。关于Evo-PC-SMEDDS 是否具备胃溃疡靶向能力,能否实现在胃内的特异性富集仍然需要进行深入研究。同时,所制得制剂对胃溃疡的改善作用相比于原药与阳性药物是否存在优势,也需要通过动物体内实验进行验证。强渗透长滞留(enhanced permeability and retention,EPR)效应是指药物通过病灶部位血管的异常结构实现靶向递送与特异性富集的现象[13],其发现是最近数十年来被动靶向药物研发领域重要推动[14],有学者认为大分子靶向药物可以利用EPR效应实现相较于小分子药物更强的靶向,进而延长药物在病灶的富集时间,增强靶向疗效[15]。激光共聚焦显微镜(laser scanning confocal microscope,LSCM)是在药物传递系统中被广泛应用的近代生物医学成像仪器,在药物传递系统进入细胞及药物释放过程中,可以对递药系统在细胞内的分布情况进行观察,从而为递药系统的应用提供重要依据。因此,本研究旨在前期研究基础上,进一步探究Evo-PC-SMEDDS 在体内的胃滞留情况,并应用LSCM 技术对其胃溃疡靶向效应做出评价,探究Evo-PC-SMEDDS 对乙醇诱导的大鼠胃溃疡模型的保护作用,为胃溃疡新型递送系统的研究开发和合理应用提供参考。
1 仪器与材料
1.1 仪器
5810R 型台式高速冷冻离心机,德国Eppendorf公司;JEM-1400PLUS 型透射电子显微镜,日本电子株式会社;EMTP 型组织切片机,德国徕卡公司;Pannoramic 250 型数字切片扫描系统,济南丹吉尔电子有限公司;RS36 型全自动染色机,常州派斯杰医疗设备有限公司;XH-C 型漩涡混合器,金坛市白塔新宝仪器厂;T18 digital 型高速剪切机,德国IKA Ultra-Turrax 公司;驰久08-2G 型磁力搅拌器,上海梅颖浦仪器仪表制造有限公司;ME104/02 型万分之一电子天平,梅特勒-托利多仪器有限公司;IKA-10 型多功能组织匀浆器械,德国IKA 集团;PHY-III 型病理组织漂烘仪,常州市中威电子仪器有限公司;EXL800型多功能酶标仪,美国BLO-TEK公司;XP-75 型倒置荧光显微镜、FV1000-IX81 型激光共聚焦显微镜,日本Olympus 公司;IVIS Lumina LT 型PE 小动物活体光学成像系统,美国珀金埃尔默公司。
1.2 药品与试剂
Evo-PC-SMEDDS、Evo-PC 由实验室自制;无水乙醇(分子生物学专用,批号D2121155)购自上海阿拉丁试剂公司;4%多聚甲醛组织固定液(批号BL539A)和中性树胶(批号69120060 BL704A)购自Biosharp 生物试剂公司;羧甲基纤维素钠(批号20191021)购自光复精细化工研究所;苏木素、伊红染液(批号C200301)购自海贝索生物技术有限公司;丙二醛(malondialdehyde,MDA)、髓过氧化物酶(myeloperoxidase,MPO)、一氧化氮(nitric oxide,NO)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,GSH)、过氧化氢酶(catalase,CAT)检测试剂盒购自南京建成科技有限公司;Xenolight®DiR 荧光素购自美国珀金埃尔默公司;香豆素-6(coumarin-6,C6)购自上海谱振生物科技有限公司;胶体果胶铋胶囊,批号20200603,购自山西新宝源制药有限公司;异硫氰酸荧光素(fluorescein isothiocyanate,FITC)和4ʹ,6-二脒基-2-苯基吲哚二盐酸盐(4ʹ,6-diamidino-2-phenylindole dihydrochloride,DAPI)购自索莱宝生物科技有限公司。
1.3 动物
SPF 级雄性SD 大鼠,体质量(200±20)g,总计75 只,由贵州医科大学动物中心提供,实验动物生产许可证号为SCXK(黔)2021-0021。本研究动物实验方案通过贵州医科大学动物伦理委员会的审查(编号2020069),课题中所使用的动物严格按照批准的研究方案开展。大鼠饲养环境通风良好,饲养在温度23~25 ℃、湿度50%~60%环境下,并进行12 h 明暗循环。
2 方法与结果
2.1 Evo-PC-SMEDDS 的制备
参考本课题组前期优选出的方法制备Evo-PCSMEDDS[15]。将2.0 g 吴茱萸碱原料药与2.0 g 卵磷脂置于50 mL 乙醇-四氢呋喃混合有机溶液中反应,温度为55 ℃,时间为3 h;反应结束后,采用旋转蒸发仪减压回收有机溶剂,将残余混合物真空冷冻干燥48 h;将干燥后的混合物加入150 mL 氯仿中复溶至完全溶解,再抽滤过0.22 μm 有机膜去除未复合的杂质;所得滤液采用旋转蒸发仪减压回收氯仿,再真空冷冻干燥48 h,即得Evo-PC。固定SMEDDS 总质量为1 g,其中油酸乙酯25%、聚山梨酯80 和HS15 组成的混合乳化剂(质量比为2∶1)55%、无水乙醇20%。然后将40 mg Evo-PC 加入SMEDDS 中,超声30 min 助溶,再置于37 ℃水浴条件下搅拌,直至获得稳定的透明液体,即得Evo-PC-SMEDDS(载药量为 1.93%,包封率为95.28%)。
2.2 Evo-PC-SMEDDS 动物荧光成像实验
2.2.1 DiR-EPC 的制备 将25 mg 的DiR 染料溶于3 mL 无水乙醇,制备DiR 染料储备液(按照试剂商Xenolight®DiR 方案)。为使DiR 荧光染料与PC-SMDDES 组分结合,按照Evo-PC-SMEDDS 最优处方工艺,将DiR 染料储备液与“2.1”项中制备的混合乳化剂充分混匀,于避光状态下制备含DiR标记的Evo-PC-SMEDDS(DiR-EPC),在DiR-EPC中加入适量清水乳化分散即得。
2.2.2 动物分组与给药 将9 只雄性SD 大鼠随机分为3 组,即①正常大鼠DiR 游离染料组(Free-DiR);②正常大鼠DiR-EPC 组(DiR-EPC);③模型大鼠DiR-EPC 组(DiR-EPC+M),作为胃溃疡对照组。模型组大鼠按5 mL/kg 剂量ig 给予75%乙醇,以形成大鼠胃溃疡模型。每组大鼠DiR 给药量为5 mg/kg,ig 体积均为2 mL。利用动物荧光成像仪的IVIS 软件进行荧光强度定量分析,分析每张照片的荧光强度。固定每张照片的荧光强度的最小值,利用Origin 9.0 软件计算特定区域内荧光的轮廓所覆盖的面积和该区域内的最大荧光强度值[16-17]。每组大鼠在ig 药物后,分别于0、2、4、6 h 对大鼠活体DiR-EPC 分布进行成像分析。
2.2.3 荧光成像实验结果 每组大鼠在进行ig 给药及活体成像分析后,分别于0、2、4、6 h 将大鼠麻醉处死,取大鼠胃及其余全部消化道,随后沿胃大弯切开,将胃内残留物用生理盐水洗净后铺平,使用IVIS 成像技术对制剂消化道分布、制剂的胃内分布进行荧光成像分析[18]。为确定Evo-PC-SMEDDS在病理状态下的胃溃疡的特异性分布,利用亲脂性染料DiR 追踪和显示Evo-PC-SMEDDS 在大鼠体内的位置[16]。
根据图1 的动物活体荧光成像结果可知,在ig给药0~6 h,DiR-EPC 在大鼠的胃部聚集,表明Evo-PC-SMEDDS 存在胃滞留效应。Free-DiR 正常组的荧光强度由于受到胃排空效应和复杂胃内环境的影响,ig 给药后,大鼠体内的荧光强度逐渐衰减,而ig 给予DiR-EPC 的胃溃疡模型大鼠胃内的荧光保留强度高于Free-DiR 正常组和DiR-EPC 非溃疡组,表明Evo-PC-SMEDDS 可能对胃溃疡状态下的局部病灶部位具有特异性滞留作用。
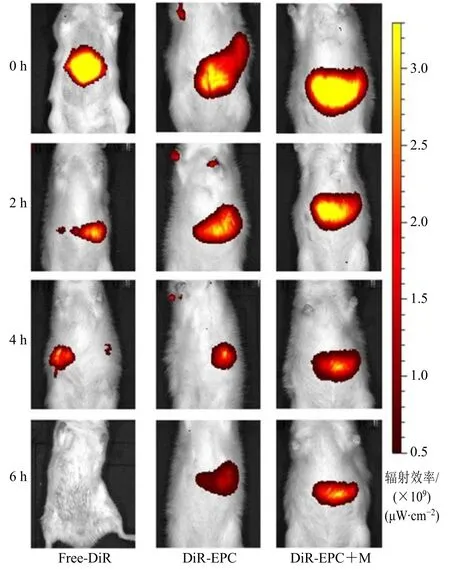
图1 大鼠活体荧光强度分布 (n = 3)Fig.1 Fluorescence intensity distribution in vivo of rats(n = 3)
根据大鼠消化道荧光强度分布(图2)可知,DiR-EPC+M 组胃中荧光强度在整个消化道中最为明显,而在小肠和结肠部位出现的荧光强度可忽略不计。且Free-DiR 组和DiR-EPC 非溃疡组受胃排空效应的干扰,荧光强度较弱,且随时间向下消化道移动,胃部滞留性弱。Evo-PC-SMEDDS 即使在胃排空作用和胃蛋白酶降解作用下,仍能够在胃中滞留较长时间,这有利于促进胃黏膜保护屏障黏膜修复和伤口愈合,起到胃黏膜保护作用。
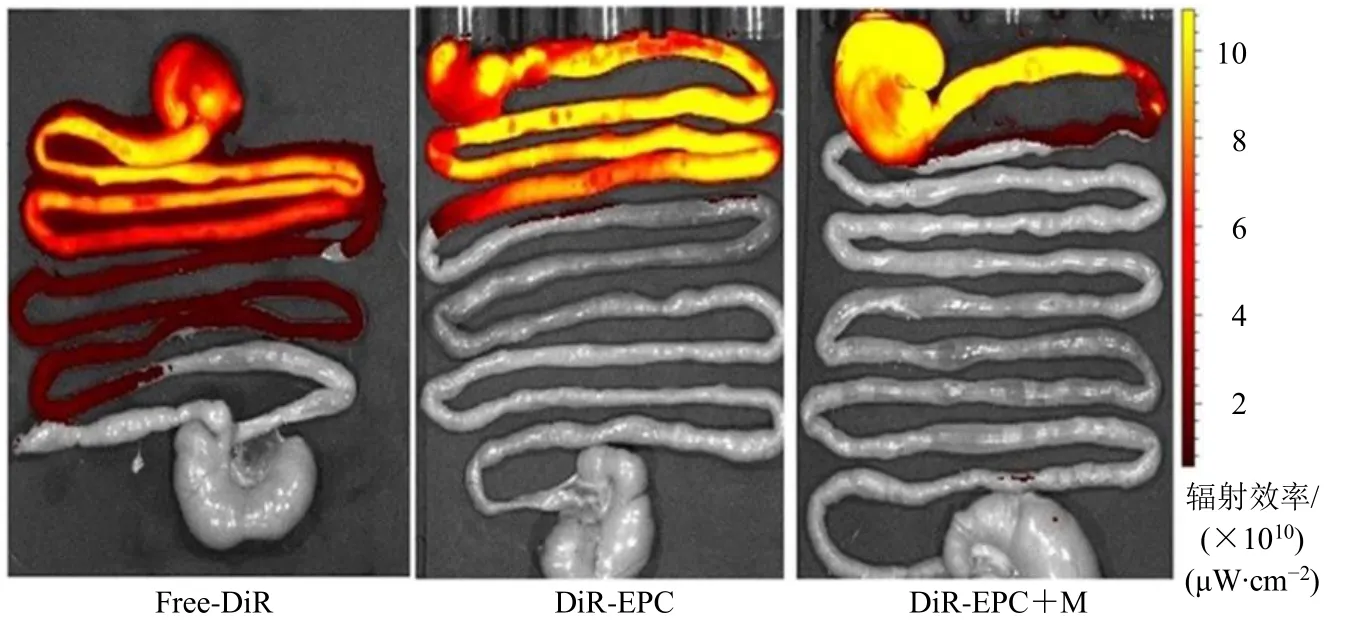
图2 给药后6 h 后的大鼠消化道荧光强度分布 (n = 3)Fig.2 Distribution of fluorescence intensity in digestive tract of rats after 6 h administration (n = 3)
根据大鼠胃组织荧光强度分布(图3)可知,在生理盐水清洗胃内容物后,仍能观察到胃黏膜表层有明显的荧光滞留,这可能是由于 Evo-PCSMEDDS 凭借的粒径和负电荷优势在溃疡暴露的胃黏膜层表面富集[17,19]。根据大鼠胃组织荧光强度定量分析结果(表1)可知,DiR-EPC+M 组4 h的胃组织的荧光强度是Free-DiR 组的79 倍;DiREPC+M 组6 h 时的胃组织的荧光强度是DiR-EPC组的9.3 倍;同样证明了Evo-PC-SMEDDS 对胃溃疡状态局部病灶部位具有特异性滞留作用。通过动物活体荧光成像系统观察,无论是在活体动物还是离体组织中均显示,Evo-PC-SMEDDS 对胃溃疡状态局部病灶部位具有特异性滞留作用。
表1 胃组织荧光定量分析 (±s, n = 3)Table 1 Fluorescence quantitative analysis of gastric tissue(±s, n = 3)
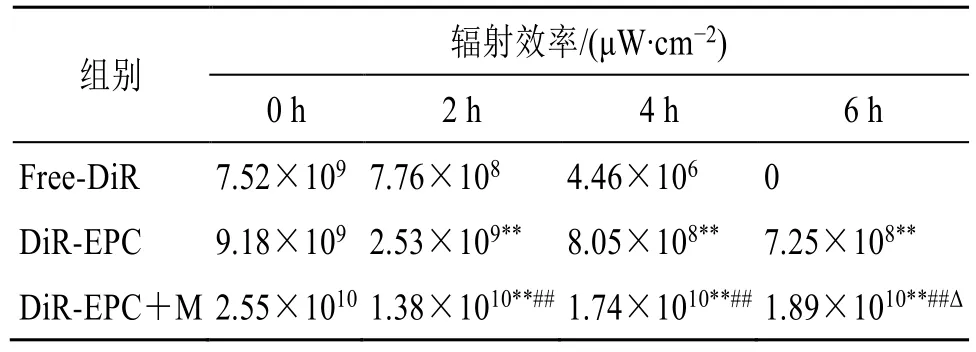
表1 胃组织荧光定量分析 (±s, n = 3)Table 1 Fluorescence quantitative analysis of gastric tissue(±s, n = 3)
与相同时间Free-DiR 组比较:**P<0.01;与相同时间DiR-EPC组比较:##P<0.01;与同组4 h 时比较:ΔP<0.05。**P < 0.01 vs Free-DiR group at the same time; ##P < 0.01 vs DiR-EPC group at the same time; ΔP < 0.05 vs same group 4 h.
组别辐射效率/(μW∙cm−2)0 h 2 h 4 h 6 h Free-DiR 7.52×109 7.76×108 4.46×106 0 DiR-EPC 9.18×109 2.53×109** 8.05×108** 7.25×108**DiR-EPC+M 2.55×1010 1.38×1010**## 1.74×1010**## 1.89×1010**##Δ
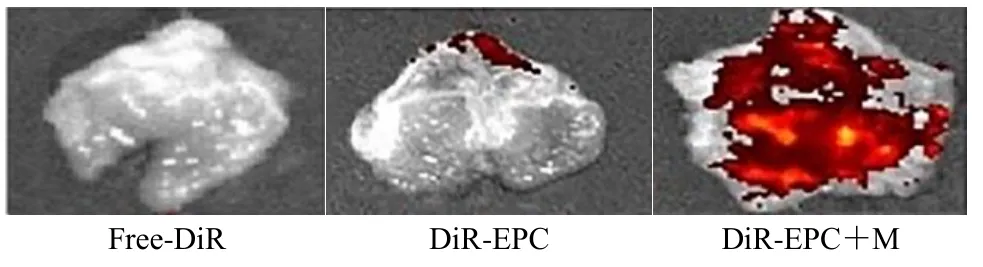
图3 胃组织荧光分布 (n = 3)Fig.3 Fluorescence distribution in gastric tissue (n = 3)
2.3 Evo-PC-SMEDDS 胃黏膜层分布
2.3.1 FITC-EPC 的制备 FITC-EPC 的制备及操作方法与“2.2.1”项中DiR-EPC 的制备过程类似。
2.3.2 动物分组及给药 设置3 只正常SD 大鼠为FITC-EPC 组,3 只胃溃疡SD 大鼠为FITC-EPC+M 组,2 组同时ig 相同剂量的FITC 标记的Evo-PC-SMDDES。给药2 h 后取大鼠胃窦部位进行冷冻切片,石蜡包埋处理,脱蜡后PBS 洗5 min;放入10% BSA 封闭1 h,PBS 漂洗5 min;加DAPI 核染3 min,漂洗后50%甘油封片,在激光共聚焦显微镜下观察。分别以激发光488 nm(观察FITC 在518 nm的绿色荧光)和425 nm(观察DAPI 在425 nm 的蓝色荧光)在激光共聚焦显微镜下观察并拍照。观察时采用10 倍和40 倍物镜,使用NIS 软件进行图像分析[20]。
2.3.3 激光共聚焦显微镜荧光成像结果 DAPI 可与DNA 结合,广泛应用于活细胞和固定细胞的染色,FITC 为荧光染料,用于标记Evo-PC-SMEDDS在胃黏膜内的位置。2 种荧光信号相结合可以验证Evo-PC-SMEDDS 是否可以在胃溃疡处靶向聚集。
根据激光共聚焦显微镜荧光成像的实验结果(图4)显示,在10 倍镜下,FITC-EPC 组正常大鼠的胃组织可以观察到FITC-EPC 在胃上皮细胞外边缘的黏液层分布较多,荧光强度较强,但在胃上皮细胞区域的荧光强度较弱,且胃黏膜组织表面的胃壁细胞的轮廓模糊;在40 倍镜下,仅能观察到FITCEPC 在胃上皮细胞中心区域有较弱的制剂荧光分布。这可能是因为正常大鼠胃组织的黏液层较厚,与上皮细胞连接紧密,黏液屏障一定程度上阻碍了Evo-PC-SMEDDS 进入胃上皮细胞。

图4 Evo-PC-SMEDDS 在胃溃疡组织中的分布Fig.4 Distribution of Evo-PC-SMEDDS in gastric ulcer tissue
FITC-EPC+M 组在10 倍镜下可明显观察到,FITC 标记的Evo-PC-SMEDDS 纳米粒子在外层黏液层和内层胃上皮细胞中均有明显分布;在40 倍镜下可明显观察到溃疡大鼠胃上皮细胞轮廓清晰,相较于FITC-EPC 组,制剂荧光在胃上皮细胞中分布更多,且荧光强度较高;亦可明显观察到FITC 标记的Evo-PC-SMEDDS 细小纳米粒子在胃壁膜内及膜外呈现颗粒状分布。推测其可能是由于乙醇诱导的胃溃疡模型表层胃黏液层缺失,且在乙醇的刺激作用下,胃上皮细胞的连接变疏松,细胞间隙及细胞膜的流动性增加,直径小于100 nm 的纳米乳则更容易以简单扩散或细胞胞吞的方式进入胃上皮细胞[17]。结果表明,Evo-PC-SMEDDS 对胃溃疡状态下的胃上皮组织具有更高的递送效率。
2.4 Evo-PC-SMEDDS 对乙醇诱导的胃溃疡保护作用的研究
2.4.1 分组、给药与造模 实验前60 只雄性SD 大鼠适应性喂养1 周,期间自由进食和饮水[21]。将大鼠随机分为空白组、模型组、胶体果胶铋组(493.7 mg/kg,CBP)、吴茱萸碱混悬液组(100 mg/kg,1%羧甲基纤维素钠混悬液,Evo-S)、Evo-PC 组(100 mg/kg)、Evo-PC-SMEDDS 组(100 mg/kg),每组6只。各组ig 体积均为10 mL/kg。空白组和模型组大鼠ig 等体积生理盐水,每天给药1 次,其余各组大鼠分别ig 等体积药物。连续给药7 d 后,动物禁食24 h,禁水4 h,排除食物和胃排空效应的干扰[22]。最后一次给药2 h 后,除空白组,其余各组大鼠给予同体积75%乙醇ig造模,以形成大鼠胃溃疡模型,造模剂量为5 mL/kg[23-24]。
2.4.2 胃溃疡形态学评价 如图5 所示,大鼠乙醇ig 造模后,解剖时发现,模型组的大鼠胃肠胀气严重,个别胀气程度较重的胃壁明显变薄,部分出血严重,胃体颜色瘀紫。各给药组的大鼠胀气程度有所减轻,胃内表面出血情况较轻。空白组大鼠胃黏膜完好,色泽匀净,无水肿,无出血点,而模型组的大鼠胃损伤程度严重,黏膜呈现出血、糜烂、充血、水肿以及形态改变,损伤部位出血呈现明显的块状、线状分布,严重者接连成片。各给药组与模型组相比,大鼠胃溃疡情况均有减轻,胃溃疡损伤主要呈条状和点状、偶有块状;其中 Evo-PCSMEDDS 组胃损伤部位最少,胃黏膜表层完整无损伤,几乎无块状出血,溃疡部位仅零星分布。结果表明,Evo-PC-SMEDDS 预保护可以有效减轻胃溃疡。这可能与Evo-PC-SMEDDS 中油酸乙酯和磷脂具有良好的生物相容性有关;油酸乙酯可增强胃黏膜层的流动性,减轻了乙醇对胃黏膜层的侵蚀;磷脂与防御和修复屏障-黏液/碳酸氢盐层成分相似相容,提高了胃黏膜保护屏障的结构刚性[25]。
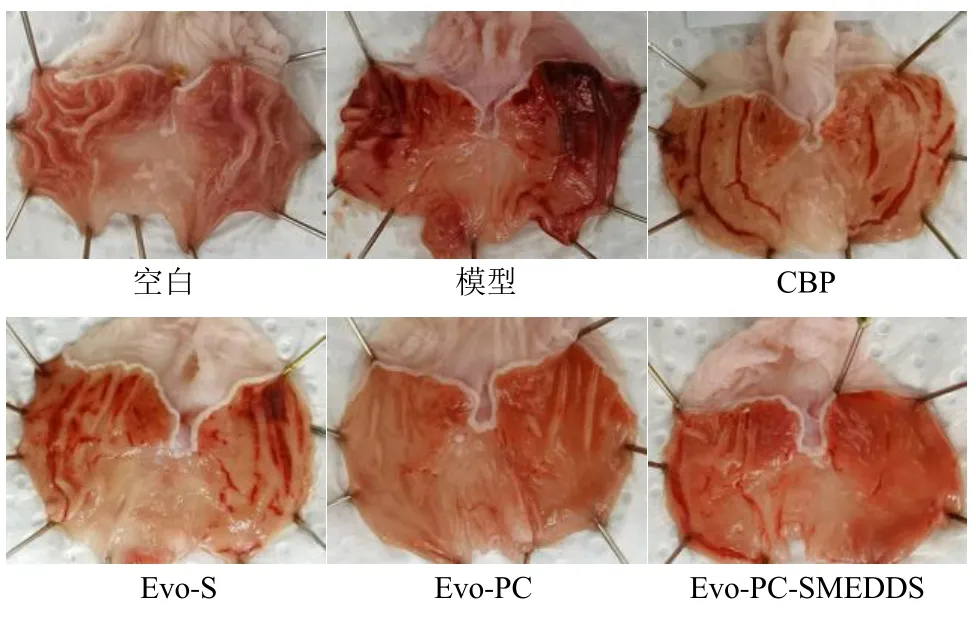
图5 各组大鼠胃溃疡组织图Fig.5 Histopathology of rat gastric ulcer in each group
2.4.3 胃溃疡指数及溃疡抑制率评估 根据参考文献中的“Guth”标准[26],对大鼠的胃溃疡指数和溃疡抑制率进行计算,并对各组大鼠胃溃疡情况进行量化评分,利用光学相机观察各组大鼠胃组织病理形态,并用微距镜头拍照记录胃黏膜表面的损伤情况,以游标卡尺测定溃疡病灶长度和宽度,计算溃疡指数。评估标准如表2 所示,病灶宽度[0,1] mm计为1 分,宽度(1,2] mm 计2 分,宽度(2,3] mm计3 分,宽度(3,4] mm 计4 分,病灶宽度>4 mm计为5 分;如果病灶宽度≤2 mm,按上述方法记分;当病灶发生穿孔且宽度>2 mm 时,加倍计分。

表2 胃溃疡指数评分标准Table 2 Gastric ulcer index scoring criteria
以胃溃疡指数评价胃溃疡的程度,溃疡抑制率(ulcer inhibition rate,UIR)表示某种治疗药物对溃疡或黏膜损伤的修复效果,抑制率越高,则说明药物的保护效果越好[27]。胃溃疡抑制率(gastric ulcer inhibition rate,UIR)计算公式如下。
UIR=(模型组的溃疡指数-预防给药组的溃疡指数)/模型的溃疡指数
评估结果表3 所示。与正常组相比,模型组胃溃疡指数显著升高(P<0.01),提示胃溃疡造模成功。各给药组与模型组相比,各给药组的胃溃疡指数显著降低(P<0.05)。其中Evo-PC-SMEDDS 组的胃溃疡指数最低,且相较于阳性药物组,溃疡指数也有明显降低(P<0.05)。
表3 各组大鼠胃溃疡指数和胃溃疡抑制率的情况(±s, n = 6)Table 3 Gastric ulcer index and gastric ulcer inhibition rate of rats in each group (±s , n = 6)
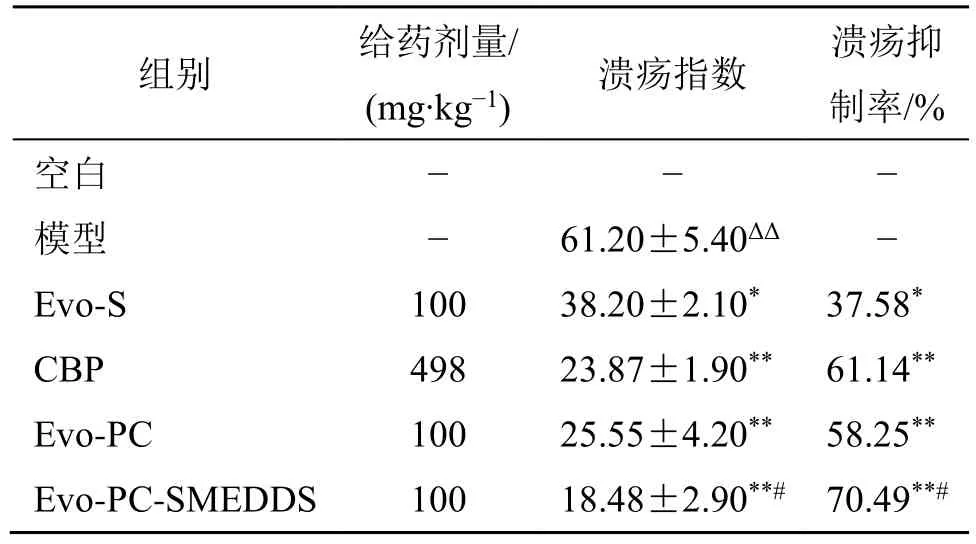
表3 各组大鼠胃溃疡指数和胃溃疡抑制率的情况(±s, n = 6)Table 3 Gastric ulcer index and gastric ulcer inhibition rate of rats in each group (±s , n = 6)
与空白组比较:ΔP<0.05 ΔΔP<0.01;与模型组比较:*P<0.05**P<0.01;与CBP 组比较:#P<0.05。ΔP < 0.05 ΔΔP < 0.01 vs blank group; *P < 0.05 **P < 0.01 vs model group; #P < 0.05 vs CBP group.
组别 给药剂量/(mg∙kg−1) 溃疡指数 溃疡抑制率/%空白 − − −模型 − 61.20±5.40ΔΔ −Evo-S 100 38.20±2.10* 37.58*CBP 498 23.87±1.90** 61.14**Evo-PC 100 25.55±4.20** 58.25**Evo-PC-SMEDDS 100 18.48±2.90**# 70.49**#
表3 结果提示,各组给药对乙醇诱导的大鼠胃溃疡均具有一定的保护作用。其中,与阳性药物组相比,Evo-PC-SMEDDS 胃溃疡抑制效果更加明显(P<0.05),抗胃溃疡药效在所有组中最佳。结果表明,Evo-PC-SMEDDS 对乙醇诱导的大鼠胃溃疡具有良好的保护作用,这可能与纳米级自微乳的分散度高,与溃疡部位接触面积大有关。此外,磷脂也具有修复胃黏膜损伤的功能,这可能进一步增强了胃黏膜保护的效果[27]。
2.4.4 胃溃疡病理学评估 大鼠胃组织HE 染色病理如图6 所示,空白组大鼠的胃黏膜平整,表面光滑,有大量胃腺的开口,胃表面可见完整的胃小凹。上皮细胞排列整齐完好,无黏膜缺损,组织各层分界清楚,未见炎性细胞浸润。模型组大鼠胃黏膜破损严重,凹凸不平,出血点明显甚至可见片状瘀斑,表面可见火山口样损伤,胃小凹消失,腺体结构紊乱,组织黏膜各层松散,有明显的表层上皮细胞脱落、坏死,炎性细胞浸润,黏膜下水肿,结构变宽,血管扩张充血,血细胞溢出至胃黏膜各层。与模型组相比,各给药组大鼠胃黏膜病理损伤得到明显改善,大鼠胃黏膜上皮细胞排列更整齐,黏膜缺损减少,黏膜下水肿也相对减轻。其中CBP 组较模型组胃黏膜上皮细胞相对排列整齐,缺损撕裂脱落情况减少,但有明显的火山口样损伤和大片状出血瘀斑,炎性细胞浸润虽有所减少但仍明显,损伤大多局限于黏膜表层。吴茱萸碱组出现胃黏膜相关损伤如出血、黏膜水肿和炎性细胞浸润等也可明显观察到,但较模型组稍有减弱。Evo-PC 组出现胃黏膜情况和特征阳性药组相似,仅少量壁细胞坏死,病变程度也较轻。Evo-PC-SMEDDS 组的黏膜下血细胞溢出最少,仅见零星血细胞,胃黏膜表面有黏液层保护,黏膜表面基本完整,炎性细胞较少,呈散乱分布,以淋巴细胞为主,黏膜下层水肿最轻,血管轻微扩张,损伤仅局限于黏膜上皮层和固有层,接近正常大鼠的胃黏膜层情况。实验结果表明,Evo-PCSMEDDS 通过抑制炎症聚集和减轻黏膜下损伤抑制乙醇诱导的大鼠胃溃疡。

图6 各组大鼠胃黏膜组织病理变化 (HE, ×200)Fig.6 Histopathological changes of gastric mucosa of rats in each group (HE, × 200)
2.4.5 胃分泌物的测定 采用pH 计测定胃液的pH值,将采集的胃液置于离心机,以4 000 r/min 离心10 min,收集上清液,平行测定3 份。测定总游离酸度采用酸碱滴定法总原理:加入适量托弗氏酚酞指示剂,若显色为红色,则含有未反应游离H+;若显色为黄色,则无游离H+,反应完全。取澄清胃液2 mL 置三角烧瓶中,用滴定管慢慢用0.02 mol/L 的NaOH 滴定,同时不断摇动,至红色消失,出现姜黄色为止,即为游离酸滴定终点,记录消耗NaOH溶液的总体积。胃液总酸度计算公式如下。
总酸度=氢氧化钠溶液的体积×氢氧化钠浓度×1 000
胃液酸度检测结果如表4 所示,胃溃疡模型大鼠胃液酸度明显低于空白组大鼠(P<0.05),表明乙醇诱导的溃疡大鼠胃黏膜H+的释放明显增加,胃液呈强酸性。与模型组比较,给予的CBP、Evo-PC和Evo-PC-SMEDDS 预保护的胃溃疡大鼠胃液pH值均显著升高(P<0.01);其中Evo-PC-SMEDDS组胃液pH 值更加接近中性。结果表明,CBP、Evo-PC和Evo-PC-SMEDDS 可抑制或中和胃溃疡大鼠胃酸,降低胃液酸性。
表4 各组大鼠分泌胃液各项指标 (±s, n = 6)Table 4 Various indexes of gastric juice secretion of rats in each group (±s , n = 6)
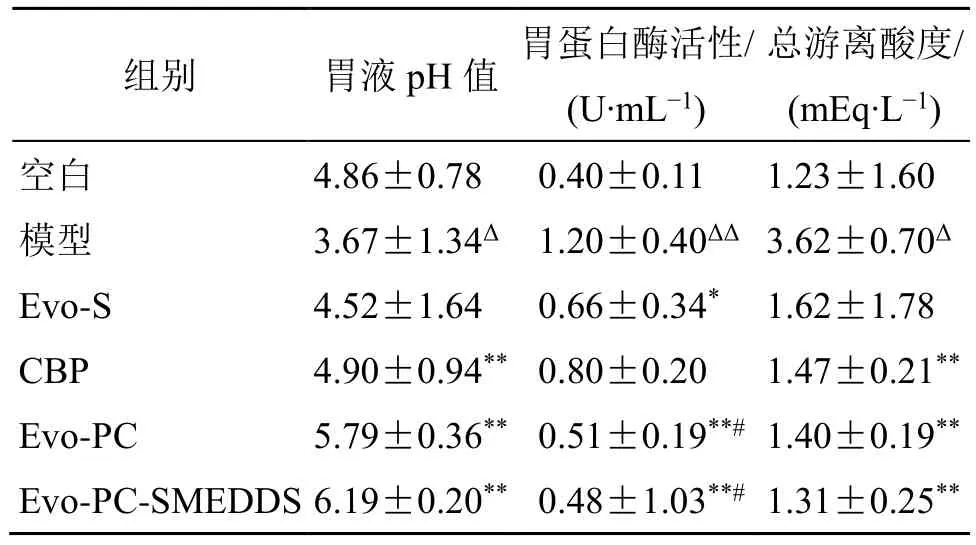
表4 各组大鼠分泌胃液各项指标 (±s, n = 6)Table 4 Various indexes of gastric juice secretion of rats in each group (±s , n = 6)
与空白组比较:ΔP<0.05 ΔΔP<0.01;与模型组比较:*P<0.05**P<0.01;与CBP 组比较:#P<0.05。ΔP < 0.05 ΔΔP < 0.01 vs blank group; *P < 0.05 **P < 0.01 vs model group; #P < 0.05 vs CBP group.
组别 胃液pH 值 胃蛋白酶活性/(U∙mL−1)总游离酸度/(mEq∙L−1)空白 4.86±0.78 0.40±0.11 1.23±1.60模型 3.67±1.34Δ 1.20±0.40ΔΔ 3.62±0.70Δ Evo-S 4.52±1.64 0.66±0.34* 1.62±1.78 CBP 4.90±0.94** 0.80±0.20 1.47±0.21**Evo-PC 5.79±0.36** 0.51±0.19**# 1.40±0.19**Evo-PC-SMEDDS 6.19±0.20** 0.48±1.03**# 1.31±0.25**
胃蛋白酶活性测定采用改良“Mett 氏”法[25]。将12 cm 长,内径l mm 毛细玻璃管洗净烤干。将上述毛细玻璃管置于新鲜蛋清液中,利用虹吸作用,灌满至管内无气泡,放在85 ℃热水中使蛋白凝固,冷却后,将制好的蛋白管裁成4 cm 长,用石蜡将其两端封固,置冰箱中备用。取胃液1 mL 放于50 mL的三角烧瓶中,加0.05 mol/L 盐酸溶液15 mL 摇匀,放进2 根蛋白管中,塞好瓶口,在37 ℃恒温水浴装置中孵育24 h,取出蛋白管,用游标卡尺测量蛋白管两端透明部分的长度,以四端之值求其平均值。胃蛋白酶活性计算公式如下。
胃蛋白酶活性=蛋白管两端透明部分长度平均值2×16
胃蛋白酶检测结果(表4)显示,与空白组相比,模型大鼠胃液中胃蛋白酶活性明显增加(P<0.01),表明乙醇诱导模型大鼠的胃蛋白酶分泌增加。与模型组比较,给予的CBP、Evo-PC 和Evo-PCSMEDDS 预保护的胃溃疡大鼠胃蛋白活性均明显降低(P<0.01),提示Evo-PC-SMEDDS 可通过降低胃液中胃蛋白酶活性保护胃黏膜。结果表明,Evo-PC-SMEDDS 通过中和胃溃疡大鼠H+释放,抑制胃蛋白活性来缓解乙醇诱导大鼠胃溃疡损伤。
2.4.6 氧化应激相关因子测定 各项指标均使用试剂盒按照说明书进行相应检测。大鼠胃溃疡组织氧化应激相关指标检测结果如表5 所示,与空白组相比,模型组大鼠GSH、CAT 和SOD 水平降低,MDA、NO 和MPO 含量显著增加(P<0.01),表明乙醇ig造模后大鼠胃部出现氧化应激现象。与模型组大鼠相比,Evo-S 组、CBP 组、Evo-PC 组和Evo-PCSMEDDS 组预保护后大鼠胃部MDA 含量显著降低(P<0.01),且Evo-PC-SMEDDS 相较于其他组对过氧化脂质产物MDA 具有更强的回调能力。
表5 各组大鼠胃组织氧化应激指标的情况 (±s, n = 6)Table 5 Indexes of oxidative stress in gastric tissue of rats in each group (±s , n = 6)

表5 各组大鼠胃组织氧化应激指标的情况 (±s, n = 6)Table 5 Indexes of oxidative stress in gastric tissue of rats in each group (±s , n = 6)
与空白组比较:ΔΔP<0.01;与模型组比较:*P<0.05 **P<0.01;与CBP 组比较:#P<0.05 ##P<0.01。ΔP < 0.05 ΔΔP < 0.01 vs blank group; *P < 0.05 **P < 0.01 vs model group; #P < 0.05 ##P < 0.01 vs CBP group.
组别 MDA/(nmol∙mL−1) MPO/(nmol∙mL−1) NO/(U∙mL−1) SOD/(U∙mL−1) GSH/(μmol∙g−1 protein) CAT/(U∙mL−1)空白 3.76±0.62 3.54±0.17 1.78±0.25 386.43±46.51 42.78±3.68 3.68±0.30模型 13.65±1.39ΔΔ 0.85±0.33ΔΔ 3.86±0.71ΔΔ 156.87±49.46ΔΔ 20.85±3.57ΔΔ 0.96±0.37ΔΔ CBP 10.26±0.45** 0.74±0.23 2.94±0.24 185.59±39.17* 27.91±1.93 1.31±0.48 Evo-S 9.73±0.98** 0.57±0.25 2.25±0.24 306.00±24.18 28.18±1.61 1.45±0.34 Evo-PC 6.08±1.30** 0.42±0.13* 2.06±0.56 286.80±18.41 35.84±3.50 1.40±0.43 Evo-PC-SMEDDS 5.07±0.30**# 0.62±0.14** 1.84±0.49** 330.12±31.02** 37.81±1.40** 2.35±0.20**##
与模型组大鼠相比,Evo-PC-SMEDDS 预处理后大鼠胃部MPO 和NO 含量显著降低(P<0.01),说明Evo-PC-SMEDDS 能明显改善炎症因子和炎性细胞浸润造成的胃组织氧化损伤。Evo-PC-SMEDDS处理后大鼠胃SOD 和CAT 活力增加,且大鼠胃MDA 含量显著降低(P<0.01)。与吴茱萸碱原料药组相比,Evo-PC-SMEDDS 给药后胃组织中GSH 水平显著提高,Evo-PC-SMEDDS 组SOD 活力更强,且MDA 含量更低。结果表明Evo-PC-SMEDDS 具有提高吴茱萸碱原料药抑制乙醇诱导大鼠胃组织处氧化应激损伤的能力。
3 讨论
吴茱萸碱具有镇痛抗炎、抗菌、抗胃溃疡、保护胃黏膜等多重药理活性,但由于水溶性极差、口服生物利用度低,限制了其在临床中的应用。SMEDDS 是由油相、乳化剂和助乳化剂组成的液体制剂,具有良好的黏膜渗透性和生物相容性,可以在一定程度上改善药物的溶解性,提高药物的生物利用度。本课题组在前期实验中确定了Evo-PCSMEDDS 的最佳制备条件,并对制得的药物表征及体外胃黏膜渗透性进行了评价,发现其在体外较原药具有更强的胃黏膜渗透能力。
在课题组前期研究基础上,本研究进一步应用荧光成像技术与激光共聚焦技术,从体内维度以及动物整体和器官分布不同水平探究了该制剂的胃溃疡靶向性。结果表明,Evo-PC-SMEDDS 对乙醇导致的胃溃疡具有明显的靶向递送性,并以胃溃疡靶向方式实现了吴茱萸碱在溃疡氧化应激损伤部位的靶向聚集。推测是由于其在胃溃疡处发生了EPR 效应,从而形成了靶向聚集。药效学结果表明Evo-PCSMEDDS 对乙醇诱导的胃溃疡具有一定的预防性保护作用,并增强了吴茱萸碱的胃黏膜保护作用。
目前构建大鼠胃溃疡模型的方法主要有非损伤应激性胃溃疡模型、损伤应激性胃溃疡模型、药物胃溃疡模型、乙醇胃溃疡模型、幽门结扎型大鼠胃溃疡模型等[28]。其中,乙醇胃溃疡模型的溃疡外形、组织学特点、愈合和复发过程与人胃黏膜损伤类似,且制作方便,重复性好。因此本实验选用乙醇诱导的大鼠胃溃疡模型。
有报道指出[29],胃溃疡常发生在暴露于攻击性因素(例如酸和胃蛋白酶)的胃黏膜处,这种暴露可能是由于胃粘膜中的破坏因子与防御因子的不平衡造成的。保护因素包括碳酸氢盐和前列腺素的分泌,抗氧化剂水平的提高和低水平的NO。研究表明[30],脂质过氧化和MDA 升高与乙醇诱发的大鼠胃溃疡有关。有研究表明[31],吴茱萸碱与姜黄素制备的纳米乳(EJPCN)可通过提高胃粘膜中SOD 含量,降低MDA 含量来减少氧化应激,以及降低促炎性细胞因子(IL-6、TNF-α)水平,提高抗炎因子IL-4 水平发挥胃黏膜保护作用。
由此,推测Evo-PC-SMEDDS 发挥改善胃溃疡及胃黏膜保护作用的机制一方面是通过提高胃黏膜中SOD、CAT 以及GSH 含量,降低胃黏膜MDA含量来减少氧化应激;另一方面是通过抑制胃酸以及胃蛋白酶分泌,抑制NO、MPO 炎症信号因子水平来减少炎性细胞浸润。
综上所述,本研究证明了Evo-PC-SMEDDS 具备较好的胃溃疡靶向能力,且对胃溃疡有较为良好的治疗效果,为其日后可能的开发与应用提供了一定的数据支撑,为验证药物的胃溃疡靶向能力的实验设计提供了较为全面的参考方案。
利益冲突所有作者均声明不存在利益冲突

