中华枸杞中1 个新的香豆素葡萄糖苷
范雨欣,徐瑞雯,张晓祎,朱研洁,代向阳,孙彦君, ,李 孟, ,冯卫生, *,陈 辉, *
1.河南中医药大学药学院,河南 郑州 450046
2.呼吸疾病中医药防治省部共建协同创新中心,河南 郑州 450046
茄科(Solanaceae)枸杞属LyciumL.植物全世界约有80 种,我国有7 种3 变种,其中宁夏枸杞L.barbarumL.和中华枸杞L.chinenseMill.为我国枸杞属重要的2 个种[1]。中华枸杞,又名枸杞、狗奶子、狗牙根,主要分布在我国东北、华北、华中、华南和西南地区,最早记载于《神农本草经》,列为上品,其果实(中药称枸杞子),药用功能与宁夏枸杞类似,用于虚劳精亏、腰膝酸痛、眩晕耳鸣、内热消渴等症的治疗[2-4];枸杞根皮为《中国药典》2020年版地骨皮药材来源之一,是临床上治疗内热消渴等症的常用中药[4]。目前,关于枸杞属植物的研究报道多集中于宁夏枸杞,而关于中华枸杞的研究报道较少,且主要集中于其根皮(中药称地骨皮)[5]。
糖尿病在中医又称消渴病,是以高血糖为特征的慢性代谢性疾病。α-葡萄糖苷酶是体内将淀粉转化为葡萄糖的关键酶,而抑制α-葡萄糖苷酶是控制餐后血糖升高的有效途径[6]。目前,从天然产物中发现新型α-葡萄糖苷酶抑制剂已成为抗糖尿病药物研究的一个热点领域[7]。本课题组前期已对宁夏枸杞果实的化学成分进行了系统研究,部分化合物显示出较强的α-葡萄糖苷酶抑制作用[8]。已有文献研究表明,中华枸杞果实醇提物对糖尿病小鼠具有显著的降血糖效果,并对α-葡萄糖苷酶亦表现出较强的抑制作用[9],但缺乏相应的化学成分研究基础。为进一步完善中华枸杞的药效物质基础,促进枸杞属药用植物资源的开发利用,本实验对中华枸杞果实醋酸乙酯部位进行化学成分研究,共分离得到11个化合物,分别鉴定为7-O-(6-O-3-羟基异丁酰基-β-D-吡喃葡萄糖基)-6-甲氧基香豆素 [7-O-(6-O-3-hydroxyisobutyroyl-β-D-glucopyranosyl)-6-methoxycoumarin,1]、东莨菪苷(scopolin,2)、东莨菪素(scopoletin,3)、反式对香豆酰基-β-D-葡萄糖苷(trans-p-coumaroyl β-D-glucoside,4)、cassoside I(cassoside I,5)、对羟基苯乙酮-4-O-β-D-吡喃葡萄糖苷(4-hydroxy-acetophenone-4-O-β-D-glucopyranoside,6)、苯甲醇吡喃葡萄糖苷(benzyl alcohol glucopyranoside,7)、苯乙基-β-D-吡喃葡萄糖苷(phenethyl-β-D-glucopyranoside,8)、柚皮素-7-Oβ-D-葡萄糖苷(naringenin-7-O-β-D-glucoside,9)、5-O- 对香豆酰奎尼酸甲酯( methyl 5-O-pcoumaroylquinic acid,10)、绿原酸甲酯(methyl chlorogenate,11)。其中化合物1 为1 个新化合物,命名为枸杞苷E;化合物10 和11 为首次从枸杞属植物中分离得到,化合物4~11 为首次从中华枸杞中分离得到,并评价了部分化合物对α-葡萄糖苷酶的抑制活性。
1 仪器与材料
Bruker AVANCE Ⅲ 500 MHz 型核磁共振仪谱用超导核磁共振仪(TMS 做内标,德国Bruker 公司);TripleTOF 6600 型高效液相色谱-高分辨质谱联用仪(AB SCIEX);Autopol IV 全自动旋光仪(美国,鲁道夫公司);LC52 型高压制备液相色谱仪(赛谱锐思北京科技有限公司,SP-5030 型半制备型高压输液泵,UV200 型紫外检测器,Easychrom 型色谱工作站);色谱柱为YMC-Pack ODS-A(250 mm×20 mm,5 μm);Thermo EVO 300 紫外分光光度计和Thermo Nicolet IS10 红外光谱仪(美国,Thermo Scientific);薄层色谱硅胶GF254、柱色谱硅胶(200~300 目,青岛海洋化工厂);大孔吸附树脂D101(西安蓝晓科技新材料股份有限公司);ODS填料(日本YMC 公司);色谱纯及分析纯试剂(天津四友精细化学品有限公司);α-葡萄糖苷酶来源于酿酒酵母(Sigma 公司,货号 G5003,批号BCBX8794);底物对硝基苯基-α-D-吡喃葡萄糖苷(PNPG,Sigma 公司,货号 N1377,批号BCBP4536V);阳性对照槲皮素(quercetin,Sigma公司,货号PHR1488)。
中华枸杞于2021 年11 月采自吉林省白山市抚松县,经河南中医药大学药学院陈随清教授鉴定为茄科枸杞属植物中华枸杞L.chinenseMill.的干燥成熟果实。凭证样本(20211106A)存放于河南中医药大学中药化学研究室。
2 方法
2.1 提取与分离
中华枸杞干燥果实30.0 kg,用95%乙醇加热回流提取3 次,每次2.0 h,合并提取液,减压浓缩,得到总浸膏10.0 kg。总浸膏经大孔吸附树脂D101柱色谱分离,依次用水、95%乙醇-水进行洗脱,得到95%乙醇-水洗脱部位1.0 kg。95%乙醇-水洗脱部位水溶后,使用醋酸乙酯萃取,得到醋酸乙酯部位158.0 g。醋酸乙酯部位使用硅胶柱色谱分离,依次用石油醚-醋酸乙酯(1∶0、50∶1、30∶1、20∶1、10∶1、5∶1、2∶1、1∶1)、二氯甲烷-甲醇(30∶1、20∶1、10∶1、5∶1、2∶1、1∶1、0∶1)梯度洗脱,合并相同或相似后,得到10 个组分(G1~G10)。
G6(5.0 g)经ODS 柱色谱分离,依次用甲醇-水(10%、30%、50%、70%、100%)梯度洗脱,得到5 个亚组分(G6-1~G6-5)。G6-2(30%甲醇-水洗脱部位,2.7 g)经硅胶柱色谱分离,依次用二氯甲烷-甲醇(100∶1→0∶1)梯度洗脱,合并得到3 个流分(G6-2-g1~G6-2-g3)。G6-2-g2(1.9 g)经半制备液相色谱,用40%甲醇-水洗脱,得到化合物3(1080.0 mg,tR=13.4 min)。
G7(15.0 g)经ODS 柱色谱分离,依次用甲醇-水(10%、30%、50%、70%、100%)梯度洗脱,得到5 个亚组分(G7-1~G7-5)。G7-1(10%甲醇-水洗脱部位,0.7 g)经半制备液相色谱,用10%甲醇-水洗脱,得到化合物6(9.1 mg,tR=20.9 min)。G7-2(30%甲醇-水洗脱部位,4.0 g)经硅胶柱色谱分离,依次用二氯甲烷-甲醇(100∶1→0∶1)梯度洗脱,合并得到7 个流分(G7-2-g1~G7-2-g7)。G7-2-g5(415.0 mg)经半制备液相色谱,用36%甲醇-水洗脱,得到化合物1(2.2 mg,tR=33.0 min)、5(4.2 mg,tR=27.3 min)、7(6.8 mg,tR=17.4 min)、8(4.2 mg,tR=38.7 min)。G7-2-g6(108.0 mg)经半制备液相色谱,用34%甲醇-水洗脱,得到化合物9(4.1 mg,tR=22.9 min)。G7-2-g7(212.0 mg)经半制备液相色谱,用24%甲醇-水洗脱,得到化合物2(4.2 mg,tR=14.4 min)和4(10.2 mg,tR=19.6 min)。
G8(13.0 g)经ODS 柱色谱分离,依次用甲醇-水(10%、30%、50%、70%、100%)梯度洗脱,得到5 个亚组分(G8-1~G8-5)。G8-2(30%甲醇-水洗脱部位,1.7 g)经硅胶柱色谱分离,依次用二氯甲烷-甲醇(100∶1→0∶1)洗脱,得到6 个流分(G8-2-g1~G8-2-g6)。G8-2-g4(15.0 mg)经半制备液相色谱,用35%甲醇-水洗脱,得到化合物10(3.8 mg,tR=31.9 min)。G8-2-g5(111.0 mg)经半制备液相色谱,用38%甲醇-水洗脱,得到化合物11(13.6 mg,tR=31.1 min)。
2.2 化合物1 的酸水解及糖的鉴定
化合物1(1.2 mg)溶于2.0 mol/L 盐酸溶液3.0 mL 中,在90 ℃水浴加热2.5 h。将混合物干燥后,以醋酸乙酯和水进行萃取。水层浓缩干燥得到糖部分。糖部分加入1 mL 吡啶、1 mgL-半胱氨酸甲酯盐酸盐,在60 ℃水浴加热1.5 h,然后加入0.02 mL邻甲苯异硫氰酸酯,在60 ℃水浴再加热1.5 h,得到糖部分的衍生物。通过LC-MS [Kinetex C18色谱柱(50 mm×2.1 mm,2.6 µm)],经0.1%甲酸水(A)-甲醇(B)梯度洗脱(0~20 min,5%~95% B),柱温40 ℃,体积流量为0.3 mL/min,进样量为10 μL,比较水解产物糖部分衍生物(tR=12.47 min,m/z447.152 0 [M+H]+)和其标准糖衍生物(tR=12.47 min,m/z447.152 3 [M+H]+)的保留时间和质谱数据,确定水解产物糖部分为D-葡萄糖[10]。
2.3 α-葡萄糖苷酶抑制活性筛选
采用PNPG 法[8]筛选化合物1、4、6、7、9~11 对α-葡萄糖苷酶的抑制作用,槲皮素为阳性对照药。将实验组样品(50 µmol/L)与酶溶液(0.025 U/mL)、磷酸盐(PBS)缓冲液(0.1 mol/L,pH 6.8)、底物PNPG 溶液(1 mmol/L)依次加入96 孔酶标板中,充分混匀,设置3 孔重复。同时设置不含药物的空白对照和槲皮素阳性对照。37 ℃温育50 min,酶标仪测定405 nm 处的A值,计算得出α-葡萄糖苷酶活性的抑制率。
抑制率=1-A样品/A空白
3 结构鉴定
化合物1:白色粉末,[α]20D−117.6°(c0.04,MeOH)。紫外光谱(UV)显示该化合物在207、226、288 和338 nm 处有特征吸收。红外光谱(IR)显示有羟基(3 411 cm−1)和羰基(1 719 cm−1)的特征吸收。HR-ESI-MS 谱给出准分子离子峰m/z441.139 2 [M+H]+(计算值为441.139 1),确定化合物1 的分子式为C20H24O11。1H-NMR 谱中(表1),低场区显示1 组香豆素上顺式烯烃质子的特征信号δH7.96 (1H, d,J= 9.5 Hz, H-4), 6.33 (1H, d,J= 9.5 Hz, H-3);2 个孤立的芳香环质子信号δH7.30 (1H, s,H-5),7.14 (1H, s, H-8),以上提示香豆素母核C-6位和C-7 位被取代。1 个糖端基质子信号δH5.15(1H, d,J= 7.3 Hz, H-1′);1 个甲氧基质子信号δH3.82 (3H, s, 6-OCH3);1 个次甲基质子信号δH2.52(1H, m, H-2′′);1 个甲基质子信号δH1.02 (3H, d,J=7.0 Hz, H-4′′)。13C-NMR 谱中共显示20 个碳信号,结合HSQC,归属为1 个羰基碳δC174.3 (C-1′′);1组香豆素母核上的碳δC160.4~112.3 (C-2~10);1个甲氧基碳δC56.0 (6-OCH3);1 个次甲基碳δC42.1(C-2′′);1 个甲基碳δC13.4 (C-4′′)。除去以上碳信号,化合物1 的结构中还剩7 个碳信号,结合HMBC 谱(图1),推测这7 个碳信号为1 组葡萄糖基上的碳δC99.2~63.4 (C-1′~6′) 和1 个连氧亚甲基碳δC63.2(C-3′′)。对化合物1 的以上信息分析,发现其与已知化合物7-O-(6-O-syringoyl-β-D-glucopyranosyl)-6-methoxycoumarin[11]相似,提示化合物1 为1 个香豆素葡萄糖苷类化合物,不同之处在于,化合物1缺少了1 组紫丁香酰基(syringoyl)信号,而在高场区出现了1 组3-羟基异丁酰基信号。
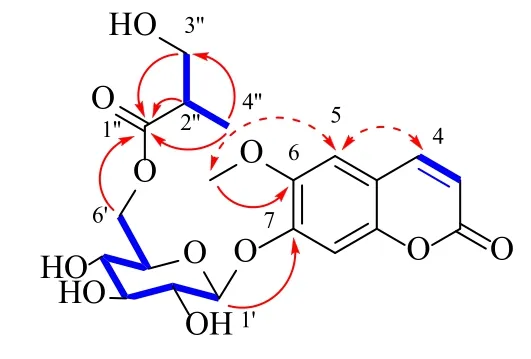
图1 化合物1 的1H-1H COSY ()、HMBC () 和NOESY () 关键相关Fig.1 Key 1H-1H COSY (), HMBC () and NOESY () correlations of compound 1

表1 化合物1 的1H-和13C-NMR 数据 (500/125 MHz,DMSO-d6)Table 1 1H- and 13C-NMR data of compound 1 (500/125 MHz, DMSO-d6)
化合物1 的HMBC 谱中,H-4′′与C-1′′、C-3′′存在明显3 键远程相关,H-2′′、H-3′′与C-1′′存在明显相关,结合1H-1H COSY 谱(图1),证实化合物1 中存在1 个3-羟基异丁酰基片段。葡萄糖基上H-6′与C-1′′存在明显远程相关,说明葡萄糖基C-6′位与C-1′′位通过酯键相连;葡萄糖端基H-1′与香豆素母核C-7 存在明显相关,提示香豆素C-7 位被葡萄糖基取代。此外,HMBC 谱中,C-6-OCH3与C-6 有明显远程相关,进一步结合NOESY 谱中H-5 与H-4以及H-5 与C-6-OCH3的NOE 相关,证明香豆素母核C-6 位被甲氧基取代。从以上信息,确定了化合物1 的平面结构(图2)。根据葡萄糖基端基质子的偶合常数(JH-1′= 7.3 Hz)可确定其相对构型为β 构型。将化合物1 进行酸水解及衍生化实验,确定葡萄糖基绝对构型为D型。由于化合物1 酸水解产物中3-羟基异丁酸含量较少,其C-2′′位的构型尚未确定。综上,化合物1 的结构鉴定为7-O-(6-O-3-羟基异丁酰基-β-D-吡喃葡萄糖基)-6-甲氧基香豆素。经Scifinder 数据库检索未见报道,确定为新化合物,命名为枸杞苷E(lyciumoside E)。

图2 化合物1 的化学结构Fig.2 Chemical structure of compound 1
化合物2:白色粉末,ESI-MSm/z: 355 [M+H]+,分子式为C16H18O9。1H-NMR (500 MHz, DMSO-d6)δ: 7.97 (1H, d,J= 9.5 Hz, H-4), 7.30 (1H, s, H-5),7.16 (1H, s, H-8), 6.33 (1H, d,J= 9.5 Hz, H-3), 5.09(1H, d,J= 7.2 Hz, H-1′), 3.82 (3H, s, 6-OCH3),3.70~3.13 (6H, m, H-2′~6′);13C-NMR (125 MHz,DMSO-d6)δ: 160.5 (C-2), 149.9 (C-7), 148.9 (C-9),146.0 (C-6), 144.2 (C-4), 113.3 (C-3), 112.3 (C-10),109.7 (C-5), 103.0 (C-8), 99.6 (C-1′), 77.1 (C-3′), 76.7(C-5′), 73.1 (C-2′), 69.6 (C-4′), 60.6 (C-6′), 56.0(6-OCH3)。以上数据与文献报道一致[12],并进一步经NOESY 谱证实,故鉴定化合物2 为东莨菪苷。
化合物3:无色针晶(甲醇),ESI-MSm/z: 193[M+H]+,分子式为C10H8O4。1H-NMR (500 MHz,CD3OD)δ: 7.86 (1H, d,J= 9.4 Hz, H-4), 7.11 (1H, s,H-5), 6.78 (1H, s, H-8), 6.21 (1H, d,J= 9.4 Hz, H-3),3.92 (3H, s, 6-OCH3);13C-NMR (125 MHz, CD3OD)δ: 164.1 (C-2), 152.9 (C-7), 151.4 (C-9), 147.1 (C-6),146.1 (C-4), 112.5 (C-3, 10), 109.9 (C-5), 103.9 (C-8),56.8 (6-OCH3)。以上数据与文献报道基本一致[13],故鉴定化合物3 为7-羟基6-甲氧基香豆素,又称东莨菪素。
化合物4:白色粉末,ESI-MSm/z: 349 [M+Na]+,分子式为C15H18O8。1H-NMR (500 MHz,DMSO-d6)δ: 7.64 (1H, d,J= 15.9 Hz, H-7), 7.58(2H, d,J= 8.3 Hz, H-2, 6), 6.80 (2H, d,J= 8.3 Hz,H-3, 5), 6.39 (1H, d,J= 15.9 Hz, H-8), 5.46 (1H, d,J= 8.0 Hz, H-1′), 3.70~3.09 (6H, m, H-2′~6′);13C-NMR (125 MHz, DMSO-d6)δ: 165.4 (C-9), 160.2(C-4), 146.0 (C-7), 130.6 (C-2, 6), 124.9 (C-1), 115.9(C-3, 5), 113.6 (C-8), 94.2 (C-1′), 77.9 (C-5′), 76.5(C-3′), 72.5 (C-2′), 69.5 (C-4′), 60.6 (C-6′)。以上数据与文献报道一致[14],故鉴定化合物4 为反式对香豆酰基-β-D-葡萄糖苷。
化合物5:白色粉末,ESI-MSm/z: 371 [M+H]+,分子式为C17H22O9。1H-NMR (500 MHz, CD3OD)δ:7.76 (1H, d,J= 1.6 Hz, H-2), 7.19 (1H, overlapped,H-6), 7.15 (1H, overlapped, H-5), 6.93 (1H, d,J=12.8 Hz, H-7), 5.90 (1H, d,J= 12.8 Hz, H-8), 4.99(1H, d,J= 7.4 Hz, H-1′), 3.92 (1H, m, H-6′a), 3.89(3H, s, 3-OCH3), 3.74 (3H, s, 9-OCH3), 3.71 (1H, m,H-6′b), 3.56~3.37 (4H, m, H-2′~5′);13C-NMR (125 MHz, CD3OD)δ: 168.5 (C-9), 150.0 (C-3), 149.0(C-4), 144.5 (C-7), 130.9 (C-1), 125.8 (C-6), 118.2(C-8), 116.7 (C-5), 115.5 (C-2), 102.3 (C-1′), 78.3(C-3′), 77.9 (C-5′), 74.8 (C-2′), 71.3 (C-4′), 62.5(C-6′), 56.7 (3-OCH3), 51.8 (9-OCH3)。以上数据与文献报道一致[15],鉴定化合物5 为cassoside I。
化合物6:白色粉末,ESI-MSm/z: 299 [M+H]+,分子式为C14H18O7。1H-NMR (500 MHz, DMSO-d6)δ: 7.92 (2H, d,J= 8.8 Hz, H-2, 6), 7.11 (2H, d,J= 8.8 Hz, H-3, 5), 4.99 (1H, d,J= 7.2 Hz, H-1′′), 3.71~3.17 (6H, m, H-2′~6′), 2.52 (3H, s, H-2′);13C-NMR(125 MHz, DMSO-d6)δ: 196.5 (C-1′), 160.0 (C-4),130.8 (C-1), 130.3 (C-2, 6), 115.9 (C-3, 5), 99.8(C-1′′), 77.2 (C-3′′), 76.5 (C-5′′), 73.2 (C-2′′), 69.6(C-4′′), 60.6 (C-6′′), 26.5 (C-2′)。以上数据与文献报道一致[16],故鉴定化合物6 为对羟基苯乙酮-4-O-β-D-吡喃葡萄糖苷。
化合物7:白色粉末,ESI-MSm/z: 293 [M+Na]+,分子式为C13H18O6。1H-NMR (500 MHz,CD3OD)δ: 7.42 (2H, d,J= 7.4 Hz, H-2, 6), 7.33 (2H,t,J= 7.4 Hz, H-3, 5), 7.27 (1H, t,J= 7.4 Hz, H-4),4.93 (1H, d,J= 11.8 Hz, H-7a), 4.67 (1H, d,J= 11.8 Hz, H-7b), 4.36 (1H, d,J= 7.7 Hz, H-1′), 3.90 (1H,dd,J= 12.0, 8.9 Hz, H-6′a), 3.69 (1H, dd,J= 12.0,5.6 Hz, H-6′b), 3.38~3.23 (4H, m, H-2′~5′);13C-NMR (125 MHz, CD3OD)δ: 139.0 (C-4), 129.3(C-1), 129.2 (C-2, 6), 128.7 (C-3, 5), 103.3 (C-1′),78.1 (C-5′), 78.0 (C-3′), 75.1 (C-2′), 71.8 (C-7′), 71.6(C-4′), 62.8 (C-6′)。以上数据与文献报道一致[17],故鉴定化合物7 为苯甲醇吡喃葡萄糖苷。
化合物8:白色粉末,ESI-MSm/z: 285 [M+H]+,分子式为C14H20O6。1H-NMR (500 MHz, CD3OD)δ:7.27 (4H, d,J= 4.4 Hz, H-2, 3, 5, 6), 7.19 (1H, m,H-4), 4.32 (1H, d,J= 7.8 Hz, H-1′), 4.11 (1H, m,H-8a), 3.88 (1H, dd,J= 12.4, 1.7 Hz, H-8b), 3.78(1H, m, H-6′a), 3.68 (1H, dd,J= 12.0, 5.2 Hz, H-6′b),3.39~3.17 (4H, m, H-2′~5′), 2.95 (2H, m, H-7);13C-NMR (125 MHz, CD3OD)δ: 140.1 (C-1), 130.0(C-3, 5), 129.3 (C-2, 6), 127.2 (C-4), 104.4 (C-1′),78.1 (C-3′), 78.0 (C-5′), 75.1 (C-2′), 71.7 (C-4′), 71.6(C-8), 62.7 (C-6′), 37.2 (C-7)。以上数据与文献报道基本一致[18],故鉴定化合物8 为苯乙基-β-D-吡喃葡萄糖苷,又称2-苯乙基-O-β-D-吡喃葡萄糖苷。
化合物9:黄色粉末,ESI-MSm/z: 435 [M+H]+,分子式为C21H22O10。1H-NMR (500 MHz, CD3OD)δ:7.33 (2H, d,J= 8.4 Hz, H-2′, 6′), 6.84 (2H, d,J= 8.4 Hz, H-3′, 5′), 6.22 (1H, s, H-8), 6.20 (1H, s, H-6), 5.40(1H, m, H-2), 4.99 (1H, d,J= 6.9 Hz, H-1′′), 3.89(1H, brd,J= 11.9 Hz, H-6′′a), 3.70 (1H, dd,J= 11.9,4.7 Hz, H-6′′b), 3.49~3.34 (4H, m, H-2′′~5′′), 3.18(1H, dd,J= 17.2, 13.0 Hz, H-3a), 2.77 (1H, dd,J=17.2, 3.3 Hz, H-3b);13C-NMR (125 MHz, CD3OD)δ:198.6 (C-4), 167.1 (C-7), 165.0 (C-5), 164.6 (C-9),159.1 (C-4′), 130.8 (C-1′), 129.1 (C-2′, 6′), 116.3(C-3′, 5′), 105.0 (C-10), 101.2 (C-1′′), 98.0 (C-6), 96.9(C-8), 80.6 (C-2), 78.3 (C-5′′), 77.8 (C-3′′), 74.6(C-2′′), 71.1 (C-4′′), 62.3 (C-6′′), 44.2 (C-3)。以上数据与文献报道一致[19],故鉴定化合物9 为柚皮素-7-O-β-D-葡萄糖苷。
化合物10:黄色油状物,ESI-MSm/z: 353 [M+H]+,分子式为 C17H20O8。1H-NMR (500 MHz,CD3OD)δ: 7.61 (1H, d,J= 16.0 Hz, H-7′), 7.47 (2H,d,J= 8.5 Hz, H-2′, 6′), 6.82 (2H, d,J= 8.5 Hz, H-3′,5′), 6.29 (1H, d,J= 16.0 Hz, H-8′), 5.29 (1H, m, H-5),4.15 (1H, m, H-3), 3.74 (1H, m, H-4), 3.70 (3H, s,7-OCH3), 2.26~1.97 (4H, m, H-2, 6);13C-NMR (125 MHz, CD3OD)δ: 175.4 (C-7), 168.3 (C-9′), 161.6(C-4′), 146.8 (C-7′), 131.2 (C-2′, 6′), 127.0 (C-1′),116.9 (C-3′, 5′), 115.0 (C-8′), 75.9 (C-1), 72.7 (C-4),72.1 (C-5), 70.4 (C-3), 53.0 (7-OCH3), 38.1 (C-2),37.8 (C-6)。以上数据与文献报道一致[20],故鉴定化合物10 为5-O-对香豆酰奎尼酸甲酯。
化合物11:黄色油状物,ESI-MSm/z: 369 [M+H]+,分子式为 C17H20O9。1H-NMR (500 MHz,CD3OD)δ: 7.53 (1H, d,J= 15.9 Hz, H-3′), 7.05 (1H,d,J= 2.0 Hz, H-5′), 6.95 (1H, dd,J= 8.2, 2.0 Hz,H-9′), 6.79 (1H, d,J= 8.2 Hz, H-8′), 6.22 (1H, d,J=15.9 Hz, H-2′), 5.28 (1H, m, H-3), 4.14 (1H, m, H-5),3.74 (1H, m, H-4), 3.70 (3H, s, 7-OCH3), 2.24~1.98(4H, m, H-2, 6);13C-NMR (125 MHz, CD3OD)δ:175.4 (C-7), 168.3 (C-1′), 149.7 (C-7′), 147.2 (C-3′),146.9 (C-6′), 127.6 (C-4′), 123.0 (C-9′), 116.5 (C-8′),115.1 (C-5′), 115.0 (C-2′), 75.8 (C-1), 72.6 (C-4), 72.1(C-3), 70.4 (C-5), 53.0 (7-OCH3), 38.0 (C-6), 37.7(C-2)。以上数据与文献报道一致[20],故鉴定化合物11 为绿原酸甲酯。
4 α-葡萄糖苷酶抑制作用
实验结果表明在终浓度为50.0 μmol/L 时,化合物11 具有弱的α-葡萄糖苷酶抑制活性,其抑制率为(15.19±2.20)%,其余化合物(1、4、6、7、9、10)的抑制率均小于5.00%。阳性对照药槲皮素在终浓度为10.0 μmol/L 时,抑制率为(56.00±2.46)%。
5 讨论
本研究从中华枸杞果实醋酸乙酯萃取部位中共分离鉴定了11 个化合物,包括1 个新的香豆素葡萄糖苷类化合物,2 个化合物为首次从该属植物中分离得到,8 个化合物为首次从该植物中分离得到,并评价了其中7 个化合物的α-葡萄糖苷酶抑制活性。尽管这7 个化合物,只有化合物11 表现出了弱的α-葡萄糖苷酶抑制活性,但其余4 个本次未进行活性测试的化合物中,化合物2、3 和8 的α-葡萄糖苷酶抑制活性已有相关文献报道[21-22],其中化合物3 对α-葡萄糖苷酶的IC50为43.7 µg/mL,强于阳性药阿卡波糖(IC50为183.5 µg/mL),化合物2对α-葡萄糖苷酶无抑制活性,化合物8 具有弱的抑制活性。从结构上分析,化合物1~3 均为香豆素类化合物,其主要区别在于化合物3 中C-7 位为羟基取代,而化合物1 和2 中C-7 上的羟基与葡萄糖结合成苷。结合以上活性测试结果,推测香豆素母核上的C-7 位羟基对于α-葡萄糖苷酶抑制活性具有关键作用。此外,从含量上分析,这11 个化合物中化合物3 在中华枸杞果实中含量最高,可能是发挥降糖活性的主要成分。近期,国内学者对化合物11在胰岛素抵抗的HepG2 细胞模型也进行了降糖活性研究,结果显示该化合物在浓度20.0 μmol/L 时可以提高胰岛素抵抗模型细胞的葡萄糖消耗量[23],结合本课题组的实验结果,从不同的实验模型上均证实了该化合物的降糖活性。中华枸杞在我国野生资源极为丰富,具有较大的研究和开发价值。本研究丰富了枸杞属植物的化学成分结构类型,同时也为枸杞属药用植物资源开发利用提供了一定的参考价值。
利益冲突所有作者均声明不存在利益冲突

