脑-肠交互视域下抑郁症与胃肠疾病共病的中西药调节及其机制研究进展
王慧敏,秦雪梅,刘晓节
山西大学 中医药现代研究中心,地产中药功效物质研究与利用山西省重点实验室,化学生物学与分子工程教育部重点实验室,山西 太原 030006
抑郁症和胃肠疾病属2 种不同的疾患形式,但其临床中常伴随发生[1]。随着现代医学理论的不断发展及研究技术的革新,对2 类疾病的认识越来越全面、深入。西医“脑-肠轴”理论中“脑-肠轴”和“肠-脑轴”的交互对话研究表明抑郁症和胃肠疾病的发生发展密切相关。基于中医的整体观及脏腑相关理论,胃肠与脑经络相连,“阳明胃经”将脾胃生化的血气与精微物质循行入脑以滋养脑;脑精髓充足,则胃肠传化及时,排毒清窍[2]。而外邪入侵胃肠导致正盛邪实之实热,精气循环受阻,脑部津液不足,进而影响心神,是“阳明胃经”病变引发神志疾病的重要病机;脑位最高,火邪入侵不得宣泄而趋下,胃肠为阳腑,易感火邪,诱发便秘等胃肠疾病。因此,中医辨证治疗2 类疾病的原则为“脑病问肠”和“肠病询脑”[3]。这些理论将脑与胃肠的功能紧密联系在一起,为全面、深入揭示抑郁症与胃肠疾病共病的生理病理机制奠定基础,为临床合理、有效用药提供理论依据与思路,有助于“脑肠同治”理论的发展与完善。
中、西医理论为阐释抑郁症和胃肠疾病共病的发病机制提供了新思路和新视角。而药物是临床治疗疾病不可或缺的手段,中药和化学药及其联合用药,及抗抑郁药物和治疗胃肠疾病药物的交叉使用或联合使用,不仅能显著提高2 类疾病的治疗效果,改善患者生活质量,亦验证了“脑-肠”交互作用在抑郁症、胃肠疾病及其共病中的重要机制,扩展了抑郁症和胃肠疾病共病的临床治疗。
现有抑郁症和胃肠疾病研究结果和临床观察表明:(1)抑郁症患者机体内部变化,容易诱发胃肠疾病的发生;抑郁部分症状与胃肠疾病相关;抑郁患者在治疗过程中由于药物作用,常出现胃肠疾病。(2)由于病程长和病情反复,胃肠疾病患者在治疗过程中常出现抑郁或焦虑的情绪,不利于患者的治疗和预后恢复;胃肠疾病引起身体稳态紊乱,对大脑产生影响,诱发抑郁症发生或加重其发展。临床常交叉使用或联合应用2 类疾病的药物,亦有将心理干预加入胃肠疾病的疗程中,抑郁症和胃肠疾病的治疗效果均有明显改善[4-5]。
通过在中国知网、维普、万方、PubMed 和Web of Science 等数据库,以“脑-肠轴”“脑肠同治”“肠药治脑”和“脑药治肠”为关键词,对2010—2023年相关文献进行检索和筛选,同时参考流行病学数据、国家白皮书文件及世界卫生组织数据库,分析归纳抑郁症与胃肠疾病共病产生的生理病理机制,探讨抑郁症与胃肠疾病间的脑-肠交互机制及其用药规律,为抑郁症与胃肠疾病共病归纳相应的生物学机制,为寻找、制定新的治疗管理策略与措施提供思路;为临床科学、合理用药提供理论依据;为2 类慢性疾病的有效治疗和痊愈奠定基础;为改善抑郁患者和胃肠疾病患者,特别是共病患者的临床症状,提升自我效能感,改善生命质量提供理论支持。
1 神经系统-免疫机制
抑郁症与胃肠疾病共病涉及神经系统机制与免疫机制。本文从下丘脑-垂体-肾上腺(hypothalamicpituitary-adrenal,HPA)轴、自主神经系统、神经递质和炎症因子4 个方面展开论述,以表征二者共病的神经生物学特点,解析其机制。
1.1 HPA 轴
HPA 轴负责调节机体消化过程、免疫过程及对内脏刺激的感知和情绪反应,是神经内分泌的重要组成部分。应激激活HPA 轴,刺激下丘脑分泌促肾上腺皮质激素释放激素,进而引起垂体分泌促肾上腺皮质激素(adrenocorticotropin,ACTH),ACTH通过血液到达肾上腺刺激皮质分泌糖皮质激素(glucocorticoid,GC)与GC 受体(GC receptor,GR)结合,激活GR 从而保护机体。当HPA 轴处于持续亢奋状态时,GC 水平持续偏高,使GR 表达和功能下降,产生GR 抵抗,引发海马部分的GR脱敏,导致其对HPA 轴的负反馈调节紊乱,引发抑郁症[6]。动物实验研究发现,敲除小鼠垂体和海马的GR基因,小鼠HPA 轴功能异常,表现出抑郁样行为[7]。同时,HPA 轴异常会影响胃肠功能,GC水平持续偏高使胃酸和胃蛋白酶分泌偏多,抑制上皮细胞再生,造成胃肠道小血管痉挛,破坏胃肠黏膜,进而引发胃肠疾病。德兴市人民医院将30 例未服用GC 的上消化道并发症患者纳入对照组,将30例在该院住院服用GC 的上消化道并发症患者纳入观察组,对2 组患者进行临床检查和胃镜观察。结果表明,GC 使胃黏膜损伤更严重[8]。谢玉刚等[9]发现小鼠多发伤应激后的胃黏膜细胞组织GRαmRNA 水平显著下降,而GRβmRNA 水平显著升高,表明GR 减少是应激性胃黏膜损害的重要因素。
抑郁症与胃肠疾病的发生均与HPA 轴功能异常相关。表明可通过调节HPA 轴某一环节的激素水平,改变HPA 轴的调节水平,进而影响疾病的发展。因此,恢复相关激素水平及HPA 轴功能正常可改善抑郁症和胃肠疾病患者的症状。
1.2 自主神经系统
自主神经系统是脑和肠的连接桥梁,通过交感神经和副交感神经调控中枢神经系统和肠神经系统(enteric nervous system,ENS)功能。自主神经功能异常会引发神经性疾病[10]。况丹妮[11]采用心率变异性研究抑郁症患者的自主神经系统,发现抑郁症患者与正常受试者的心率变异性存在显著差异。此外,自主神经功能异常也会引发胃肠疾病。交感神经通过释放去甲肾上腺素(norepinephrine,NE)并作用于肾上腺能α-1 受体,引起消化道括约肌收缩,消化道运动减弱,同时抑制腺体分泌。交感神经异常兴奋时,胃液分泌减少,消化功能严重下降,造成腹部胀痛或者腹泻。相反,胃液分泌过多,可能引起胃肠溃疡等。王磊等[8]应用肌电/诱发电位仪检测65 例功能性肠病患者自主神经功能,双上肢交感神经皮肤反应及心电图R-R 间隔变化结果表明,与同期40 例健康者比较,患者自主神经紊乱。结果表明切除交感神经可增加患胃溃疡的概率。穴位贴敷激活胃溃疡大鼠交感神经,大鼠胃内压力蠕动波频率、胃积电慢波频率及胃积电快波积分显著提升,而胃部溃疡面积显著减少,胃组织病理学总评分、上皮细胞损伤评分、黏膜下层水肿评分、炎性细胞产生评分均显著降低[12]。
副交感神经通过释放乙酰胆碱并作用于毒蕈碱型受体,引起消化道括约肌松弛,腺体分泌增多。当副交感神经异常兴奋时,胃肠活动增加,消化液分泌增多,大小便排出增加,身体消耗增加,引起反酸、嗳气、腹痛呕吐等。迷走神经是副交感神经的分支,也是脑神经中最长的、分布最广的1 对脑神经。邹细岩等[13]通过探讨肠易激综合征(irritable bowel syndrome,IBS)与心率变异性的相关性,发现IBS 患者自主神经紊乱,主要表现为迷走神经功能增强。心率变异性在临床上可提供有关自主神经系统、压力状态等信息。抑郁症和胃肠疾病患者均出现心率变异性,提示二者的发生、发展与自主神经系统功能密切相关。但是自主神经系统是否直接导致抑郁症和胃肠疾病,仍需进一步研究。
1.3 神经递质
神经递质是神经元和机体靶细胞间的化学信使,是脑与肠双向联系和交流的重要部分。神经递质不仅在抑郁症的发生发展中具有重要作用,而且在胃肠疾病发生、发展中具有重要调节作用。
1.3.1 5-羟色胺(5-serotonin,5-HT) 5-HT 与情绪、意志力等息息相关,是一种重要的神经递质。5-HT 神经机能传递的减退可能会导致情绪障碍,进而导致抑郁症[14]。谭庆晶等[15]临床调查结果显示,抑郁症患者血清5-HT 水平显著高于健康受试者。而通过高级脑电神经递质分析系统检测抑郁症患者脑内5-HT 功能,发现其均值显著低于正常人[16]。此外,5-HT 在神经系统和消化系统也有表达,且大部分分布在胃肠道,用于调节胃肠道运动和功能。不同类型的5-HT 受体作用于不同神经元,5-HT3受体广泛位于中枢神经系统和消化系统,介导快速兴奋性突触传递、调节呕吐;5-HT7 受体分布更广泛,参与温度调节、昼夜节律、记忆、睡眠等多项生理过程,并在心血管系统和胃肠道内的平滑肌松弛中发挥重要作用[17]。赵鲁卿等[18]通过研究猴头健胃灵片对功能性消化不良(functional dyspepsia,FD)大鼠胃敏感性及5-HT 分泌影响,发现FD 模型组大鼠血清和胃组织中5-HT 的含量较对照组显著升高。欧阳勇文等[19]应用粪菌移植实验研究腹泻型IBS 小鼠5-HT 通路。研究结果表明,与正常组相比,模型组小鼠血清5-HT 及结肠组织的5-HT3受体蛋白表达水平显著升高。神经系统突触间的5-HT 含量偏低可诱发抑郁症。5-HT 通过胃肠道的神经突触或受体调节胃肠道功能,其水平异常亦会导致胃肠疾病。然而,脑与胃肠道中5-HT 的交互作用及其机制仍需要进一步研究。
1.3.2 γ-氨基丁酸(γ-aminobutyric acid,GABA)GABA 是一种抑制性神经递质。突触释放GABA,作用于突触后膜上GABA 受体,进而介导抗焦虑、镇静和抗惊厥活性,调节细胞的行为与生理活动。GABA 水平偏低时,可能会引发睡眠紊乱、坐立不安、焦虑、抑郁等。重度抑郁症(major depressive disorder,MDD)患者脑内GABA 水平降低[20]。且敲除大鼠海马GABA 受体后,大鼠表现出抑郁样行为[21]。这些研究表明,MDD 与GABA 水平及功能异常有关。GABA 广泛分布于海马、下丘脑、丘脑等多个脑区,这些脑区可通过HPA 轴调控胃肠动力和功能,表明GABA 水平与肠道微生物密切关联。Strandwitz 等[22]发现部分人类肠道菌(KLE1738)未能被培养可能是由于人工培养基中缺少由邻近细菌在原位提供的关键生长因子GABA。覃思敏等[23]通过研究电针对FD 大鼠海马及下丘脑谷氨酸和GABA 水平的调控作用,发现与对照组相比,FD大鼠海马区和下丘脑GABA 含量显著降低,而电针可升高GABA 含量。王茜等[24]发现与生理盐水组相比,下丘脑伏隔核注射GABA 后大鼠的胃收缩和频率显著升高,胃液量和胃酸输出量显著升高,且胃牵张神经元的放电频率显著下降。GABA 抑制神经过度兴奋,通过HPA 轴调控胃肠功能。GABA 含量异常可诱发抑郁、焦虑和胃肠疾病。此外,GABA是肠道菌的生长因子,其水平异常也会诱发肠道菌群紊乱,进一步加重抑郁症与胃肠疾病。
1.3.3 脑源性神经营养因子(brain-derived neurotrophic factor,BDNF) BDNF 通过与酪氨酸激酶受体B(tyrosine kinase receptor B,TrκB)受体结合形成同型二聚体,导致酪氨酸残基磷酸化,是激活下游信号通路所必须的,如磷脂酰肌醇3-激酶和磷脂酶C(phospholipase C,PLC)的信号转导通路。这些通路在神经细胞的分化、发育等过程中发挥着重要作用[25]。同时,BDNF 在肠道中大量表达。ENS 存在于肠胃壁,含有大量感觉和运动神经元,是独立于大脑的完整神经网络,也是“脑-肠轴”的重要组成部分[26]。外源性BDNF 可以诱导胚胎干细胞分化为具有神经纤维束的肠神经结,维持ENS 稳定,在ENS 生长中发挥重要作用。ENS 功能紊乱会进一步引起胃肠动力下降。刘婷等[27]研究发现健康志愿者血清BDNF 水平显著高于FD 患者。BDNF在肠道与TrκB 受体相结合,激活受体后引起PLC磷酸化,最终引起平滑肌收缩,其机制可能与调节P 物质水平密切相关。相反,TrκB-PLC/三磷脂肌醇通道拮抗剂可以阻断BDNF 兴奋肠道的作用。同时,TrκB 活化后,也会刺激5-HT 释放[28]。
BDNF 的主要作用是神经营养因子,通过信号通路,保护脑神经分化发育,也参与肠神经的生长、发育。当BDNF 的含量低时,神经元减少,引发抑郁症和胃肠疾病。
1.4 炎症因子
近年来,大量研究表明免疫相关的炎症因子与抑郁症的发生、发展密切相关,抑郁症患者常出现免疫炎症反应。据报道,抑郁症患者外周血中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)、IL-1β、IL-2、IL-12、IL-13、γ 干扰素、单核细胞趋化蛋白-1、C 反应蛋白等促炎因子水平显著升高。同时,有学者提出“IL-6可被视为抑郁症的可靠生物标志物”的观点[29-30]。此外,其他炎症因子如TNF-α 和IL-1 等也被证实与抑郁症密切相关。Guo 等[31]研究发现,外周或中枢给予炎症诱导剂可诱发大鼠抑郁样行为,但可被抗抑郁药阻断;而将细胞因子阻断或使其受体缺失则可产生抗抑郁作用。
炎症因子在胃肠疾病的发生发展中具有重要作用,容易引起IBS、肠炎、胃炎胃溃疡等疾病,部分胃肠疾病的生理表现为消化道免疫细胞的浸润。其中IL-6 与IL-6 受体结合形成复合体,该复合物通过糖蛋白130 表面分子结合激活肠道靶细胞,可防止肠道细胞凋亡并激活信号传导及转录激活蛋白3,是结肠炎的关键信号蛋白。此外,IL-6 诱导T细胞增殖、分化,从而发挥促炎作用。Craig 等[32]发现结肠炎小鼠的海马区和大脑皮质中IL-1β和IL-6mRNA 表达及海马中IL-1β 和TNF-α 表达均显著增加,进一步证实了神经炎性与肠炎的相关性。TNF-α 介导的核因子-κB(nuclear factor-κB,NF-κB)是炎症程序的中心激活剂之一,其可上调与肿瘤细胞存活、增殖、侵袭、血管生成和转移相关的基因表达,与炎症性肠病癌变存在潜在联系[33]。IL-1 是先天免疫和炎症的中枢介质,其过表达会使小胶质细胞失去神经保护作用,进而导致神经炎症与抑郁症的发生[34]。IL-1 通过其受体发出信号,在肠上皮细胞产生拮抗作用,最终抑制IL-1 的促炎作用。当IL-1 受体缺失时,肠道炎症更易发生。此外,炎症刺激巨噬细胞激活IL-1 转换酶,释放IL-1,继而激活IL-6,引发继发性肠道炎症[35]。
上述研究结果表明,炎症因子的聚积容易引发抑郁症和胃肠疾病,而降低相关炎症因子的表达,可改善患者症状。
2 胃肠道系统机制
“脑-肠轴”理论提示胃肠道功能异常亦会参与抑郁症的发生发展。抑郁症与胃肠疾病共病可能涉及的胃肠道系统机制有肠道菌、肠神经和肠黏膜屏障。本文将从3 个方面展开论述,以探究二者共病的胃肠症状及相关机制。
2.1 肠道菌及其代谢物
2.1.1 肠道菌 现有研究表明,肠道微生物对中枢神经系统的生长发育具有重要作用。如无菌小鼠大脑发育异常的可能原因是肠道微生物缺失引起海马体积减少等脑部生物学变化[36]。越来越多的研究发现,肠道微生物紊乱可作为抑郁症的标志性特征。据报道,抑郁症患者的肠道微生物结构和组成均会发生显著变化,如肠道菌α 多样性增加,双歧杆菌和乳酸杆菌丰度降低等[37]。与正常受试者相比,MDD 患者肠道中 Acidaminococcaceae、Enterobacteriaceae、Porphyromonadaceae、Fusobacteriaceae、Rikenellaceae 等菌群的丰度显著升高,而粪菌移植后可以恢复其菌群丰度[38],表明肠道菌生态失调是诱发抑郁症的重要因素。
肠道微生物可直接刺激ENS 的发送神经元,通过迷走神经调控大脑功能。如喂食鼠李糖乳杆菌的小鼠其抑郁样行为与模型组存在显著差异;而阻断小鼠迷走神经后,小鼠抑郁情况并未得到改善[39]。Goehler 等[40]验证了肠道局部感染后,口服Campylobacterjejuni菌可激活迷走神经的神经元。此外,肠道菌的多样性及广泛性决定了其在调节胃肠生理功能的重要作用。肠道菌及其功能紊乱会引起胃肠疾病。如目前认为肠道菌失调是IBS 的发病机制之一,且在不同的病证会有不同的表现。此外,肠道菌可通过改变ENS 神经元的比例调节胃肠动力。Beraldi 等[41]研究发现,肥胖小鼠结肠肌神经元显著减少,结肠传输减缓;给予益生菌可有效改善结肠肌传输迟缓。
肠道菌群的改变在抑郁症、胃肠疾病的发生、发展过程中发挥着重要作用,3 者形成了“微生物-肠-脑”循环,影响抑郁症与胃肠疾病的相互转归、相互传变。
2.1.2 色氨酸 色氨酸是5-HT 合成的唯一前体物质,而5-HT 是参与中枢神经系统传递和胃肠生理功能调节的关键单胺类神经递质。色氨酸代谢改变是抑郁症经典特征之一。约5%色氨酸被色氨酸羟化酶通过甲氧基吲哚途径转化为5-HT,其余95%通过色氨酸2,3-双氧酶和吲哚胺2,3-双加氧酶转化为犬尿氨酸。在无菌动物体内定植色氨酸代谢细菌,其海马中5-HT 水平升高,焦虑抑郁行为减轻[42]。Chen 等[43]给予无菌小鼠健康小鼠粪便,无菌小鼠肠道微生物恢复正常,且菌群移植后小鼠海马区与色氨酸代谢相关的miRNA 含量与正常小鼠相近。表明肠道微生物及其功能可一定程度调控中枢神经系统功能,特别是色氨酸代谢。此外,色氨酸还参与人体能量平衡、食欲、肠道蠕动等生理功能。因此,色氨酸代谢亦可通过多种途径参与胃肠疾病的发生、发展过程。研究表明,炎症性肠炎(inflammatory bowel disease,IBD)患者的犬尿氨酸水平升高,血浆色氨酸浓度降低。同时,IBD 患者的色氨酸代谢物(吲哚乙酸盐和吲哚丙酸盐)水平也降低,表明IBD 与色氨酸代谢的降低有关[44]。色氨酸作为人体所需的必需氨基酸之一,与抑郁症和胃肠疾病直接相关。色氨酸代谢紊乱会引发抑郁、焦虑等情绪,同时还增加了胃肠疾病的发生率。
2.1.3 短链脂肪酸(short chain fatty acids,SCFAs)SCFAs 由肠道菌发酵复杂碳水化合物产生,具有调节机体消化、免疫和中枢系统等功能。SCFAs 可通过下调HPA 轴响应,参与抑郁症的发生发展。van de Wouw 等[45]研究发现给予抑郁小鼠SCFAs 后,与HPA 轴密切相关的促肾上腺皮质激素释放因子受体1 和受体2 基因的表达降低,小鼠的抑郁样行为得到有效缓解。同时,SCFAs 通过调控色氨酸代谢酶影响大脑5-HT 的合成,从而在中枢神经发挥作用。另有研究发现,控制乙酸、丙酸和丁酸盐的给药比例可以缓解慢性社交挫败应激模型小鼠的抑郁样症状[46]。
血脑屏障是维持中枢神经系统功能稳定至关重要的一部分,血脑屏障受损会使氨基酸转运蛋白主动运输到脑外,致使脑内氨基酸含量降低,进而导致神经活性降低,进一步发展成抑郁症[47]。丁酸可上调紧密蛋白基因的表达,维持血脑屏障的完整性,缓解小鼠的抑郁样行为[45]。此外,丁酸也是组蛋白去乙酰化的抑制剂,而组蛋白去乙酰化是抑郁症的重要病理机制之一,因此丁酸还可通过抑制组蛋白去乙酰化缓解抑郁症状。
在胃肠道中,SCFAs 常存在于结肠腔内,其不仅可作为肠黏膜细胞的主要能量来源,还可以减少促炎因子的生成,从而降低结肠炎症的发生,降低过敏炎症,提升胃肠道消化功能,强化养分消化[48]。肠上皮细胞作为“第1 道防线”,对胃肠道保护具有重要意义。丁酸盐可以修复和增强肠上皮的物理屏障功能,增加紧密蛋白的表达,降低其通透性,维持其功能的稳定[49]。研究表明,SCFAs 可抑制中性粒细胞和巨噬细胞的增殖,降低炎症因子的表达,减少NF-κB 活化,从而减轻肠道局部炎症反应[50]。
SCFAs 可降低炎症因子表达量,既能减轻肠道的炎症反应,也可减轻抑郁症状。同时,SCFAs 可上调紧密蛋白的表达,维持血脑屏障和肠黏膜屏障的完整性,在保护脑功能的同时,保护肠道功能及其稳态。
2.2 ENS
ENS 由神经元和神经胶质细胞组成。ENS 负责调控胃肠功能,显著调节肠道微生物菌群组成,维持肠道健康[51]。同时,肠神经元通过乙酰胆碱受体向迷走神经传递信息,作用于胃肠平滑肌。研究表明,使用抗肠神经抗体会导致胃肠功能障碍[52]。此外,肠神经元通过释放神经递质作用于中枢神经和自主神经系统。ENS 受损也会破坏肠黏膜屏障完整,引发精神性疾病或其他机体疾病。如ENS 功能紊乱,肠道菌组成改变、功能异常,可能会诱发抑郁症。同时,ENS 嵌于肠黏膜屏障中,是肠道屏障功能的关键调节剂和肠道稳态的“稳定剂”[53]。因此,肠神经的紊乱亦会引起肠屏障功能损伤,进而引发抑郁症。综上,ENS 连接了脑与肠,二者功能相互影响。ENS 的紊乱导致胃肠疾病的发生,并能诱发或加重抑郁症。
2.3 肠黏膜屏障
肠膜屏障由机械屏障、化学屏障、生物屏障和免疫屏障构成,是正常肠道隔绝有害物质进入肠黏膜的完整功能带。肠黏膜屏障是肠道发挥抗炎能力的重要组成部分,肠黏膜损伤会增加其通透性,进而加重炎症。最近的一项全基因组关联研究显示,IBD 易感性单核苷酸多态性可能与肠屏障功能有关,其中E-钙黏蛋白由I 型钙黏蛋白基因编码,是一种黏附连接蛋白,可调节细胞间的强烈黏附,维持肠黏膜黏附连接[54]。在克罗恩病患者中,TNF-α抗体不仅可以调节炎症,还可以改善肠道黏膜通透性[55]。此外,肠黏膜的完整性也与抑郁症发生、发展密切相关。赵恬叶等[56]研究发现,抑郁敏感组小鼠回肠组织形态出现明显损伤,且病理血评分显著升高。其病理机制为肠屏障损伤后,肠黏膜通透性增大,肠道细菌迁移血液循环激活机体炎症免疫反应,引发促炎因子水平升高而刺激HPA 轴,改变脑内神经递质代谢,最终引发抑郁症[57]。肠嗜铬细胞(enterochromaffin cells,ECs)位于肠道最表层,应激后产生NE、5-HT 等神经递质。ECs 可产生全身95% 5-HT,是大脑的化学感受器,具有调控大脑功能等作用。肠黏膜屏障受到损伤,影响神经递质的分泌而引发大脑情绪异常。
肠道受到外源性和代谢性氧化自由基损伤,引起肠道氧化应激。后者进一步破坏肠道屏障完整性、增加肠黏膜屏障通透性,进而导致相关疾病发生或病情加重[58]。已有研究表明,肠道氧化应激也是抑郁症的病理机制之一。Gawryluk 等[59]研究发现抑郁患者前额叶脑组织中抗氧化物如谷胱甘肽减少,脂质过氧化终产物如 4-羟基-2-壬烯醛增加。Scapagnini 等[60]发现抑郁症患者血浆抗氧化酶活性降低,氧化酶活性增加。
肠黏膜屏障是维持胃肠内环境平衡和阻碍致病菌的先天屏障。肠黏膜损伤会直接导致胃肠疾病,而胃肠疾病引发的免疫反应又会影响神经系统功能,进而导致抑郁症的发生。同时,肠黏膜损伤引发的氧化应激也会影响抑郁症的发生发展。抑郁症与胃肠疾病及其共病的脑肠交互机制见图1。

图1 脑–肠交互机制分析示意图Fig.1 Analysis of brain-gut interaction mechanism
3 药物调节
抑郁症与胃肠疾病相互影响、相互转化、互为因果。因此,临床研究中常用交叉或联合使用治疗2 类疾病,以期实现“脑病问肠”和“肠病询脑”。本文从中药、化学药与药物联用3 个方面论述临床药物使用情况及效果。
3.1 抗抑郁药物对胃肠功能的不良反应及治疗胃肠疾病的应用
3.1.1 抗抑郁药物对胃肠功能的不良反应 抗抑郁药物已经开始用于治疗抑郁与胃肠疾病共病,特别是脑-肠失调症状,实现抑郁症和胃肠疾病的“同治”。抑郁患者在发病初期并没有表现出明显的胃肠疾病症状,但随着治疗时间的延长,患者出现一定程度的胃肠症状,甚至胃肠疾病,说明抗抑郁药物一定程度影响胃肠功能。三环类抗抑郁药(tricyclic antidepressants,TCAs)可拮抗M-胆碱受体,减缓胃肠动力,减慢胃肠道运输,进而引发便秘[61]。临床上抑郁症伴腹泻患者常选择TCAs。患者服用选择性5-HT 再摄取抑制剂(selective serum reuptake inhibitors,SSRIs)药物或5-HT 和去甲肾上腺素再摄取抑制剂(serotonin and norepinephrine reuptake inhibitors,SNRIs)几天或几周内会出现恶心、腹泻、消化道出血及腹痛等不良反应,使用SSRIs 的患者消化道出血更为显著[62]。5-HT 受体拮抗剂如米氮平具有止呕性质,但是会引发便秘、食欲增加、体质量增加等不良反应。
3.1.2 抗抑郁化学药在胃肠疾病中的应用 功能性肠胃病(functional gastrointestinal disorders,FGIDs)是一种由生理和心理因素等共同导致的胃肠疾病。调查表明,1/3 的情绪障碍先于FGIDs 发生,2/3 的FGIDs 先于情绪障碍发生[63]。因此,临床治疗中可以将抗抑郁化学药应用治疗FGIDs。薛振龙等[64]使用氟西汀治疗IBS。治疗组口服氟西汀辅以心理安慰,其胃肠症状评分显著下降。表明氟西汀可以缓解IBS 患者的症状。赵文霞等[65]使用褪黑素治疗FD,治疗后的症状评分显著低于治疗前,但是治疗效果显著低于服用奥美拉唑的对照组。
3.1.3 抗抑郁中药在胃肠疾病中的应用 中药具有多靶点、多功效、多通路等作用特点,可用于治疗不同体系的疾病。抗抑郁中药也常用于胃肠疾病的治疗。越鞠丸由香附、川芎、苍术、栀子、神曲组成,是常见的理气剂和行气剂,具有确切且良好的抗抑郁效果,也被应用于治疗慢性胃炎、慢性肠炎等。潘金常[66]使用加减越鞠丸治疗85 名IBS 患者,总有效率达89%,治愈患者症状全部消失,胃肠功能恢复正常。半夏厚朴汤为理气剂,由半夏、厚朴、茯苓、生姜、苏叶组成,具有行气散结、降逆化痰之功效,临床可应用于治疗抑郁症和慢性胃炎。霍亚莉[67]用半夏厚朴汤治愈糜烂性胃炎患者,发现其可显著减轻胃神经官能症症状。归脾汤益气补血、健脾养心,由白术、茯神、黄芪、龙眼肉、酸枣仁、人参、木香、炙甘草、当归、远志组成,可通过调节单胺类神经递质和HPA 轴功能,改善抑郁症状。周建华[68]发现加味归脾汤可显著改善慢性胃炎患者胃脘痛,且大便颜色也趋渐于正常。
3.1.4 抗抑郁药物与胃肠药物联用治疗胃肠疾病由于胃肠疾病病程长、病情反复,严重影响患者的生活质量,且患者逐渐出现抑郁倾向。因此,在临床治疗中常将抗抑郁药物与治疗胃肠疾病药物联用,以达到更好的治疗效果,提高患者自我效能感,提升患者生命质量。逍遥散是经典抗抑郁复方,由柴胡、当归、白芍、白术、茯苓、生姜、薄荷、甘草8 味药组成。刘倩等[69]对逍遥散加减方联合胃肠疾病化学药物治疗IBS 的疗效进行荟萃分析发现,中西药联用疗效显著优于化学药物单用。赵胜乾[70]使用加味逍遥散和抗幽门螺旋杆菌(helicobacter pylori,Hp)药物联合治疗慢性胃炎,结果表明联合组总有效率显著高于化学药组、Hp 根除率也显著高于化学药组。
半夏厚朴汤联合多潘立酮治疗慢性胃炎患者,联用组并发症发病率显著低于单用多潘立酮组,且生活质量评分显著高于单用多潘立酮组[71];半夏厚朴汤联合左金丸治疗浅表性胃炎的中医症状积分显著低于常规化学药组,有效率显著高于常规化学药组[72]。越鞠丸联合马来曲酸美步汀治疗临床效果优于单服马来曲酸美步汀[73]。
黛力新(氟哌噻吨美利曲辛片)与胃舒胶囊联用治疗FD 伴抑郁症的临床研究结果表明,联用组总有效率显著高于单用组。且联用组效果前后对比,汉密顿抑郁量表指数显著下降。因此,黛力新联用胃舒胶囊可显著提高FD 伴抑郁症的临床疗效[74]。氟哌噻吨-美利曲辛与奥美拉唑联用治疗胃溃疡和浅表性糜烂胃炎,其联合给药组的生活质量评分、临床疗效均显著优于单用奥美拉唑组[75]。艾司西酞普兰联合埃索美拉唑肠溶片治疗伴焦虑咽喉反流,联合组患者反流的体征评分和反流的症状评分联合组显著低于单用埃索美拉唑组[76]。褪黑素联合奥美拉唑治疗FD,联合给药组症状评分显著低于单用奥美拉唑,临床疗效也优于单用奥美拉唑[65]。
综上,抗抑郁中药可单独用于胃肠疾病的治疗,其效果甚至可能优于治疗胃肠疾病的化学药,见表1。而抗抑郁化学药一般很少单独应用于胃肠疾病的治疗,只能作为辅助药物。临床上联合用药治疗策略的实施,尤其是中西药联用,可显著提高治疗效果、减少机体损伤、提高患者生活质量。

表1 抗抑郁药物在胃肠疾病中的应用Table 1 Applications of antidepressants in gastrointestinal diseases
3.2 治疗胃肠疾病药物对神经系统功能的影响及在抑郁症中的应用
3.2.1 胃肠疾病药物对神经系统功能的影响 长期服用胃肠疾病药物会影响大脑和神经系统功能。质子泵抑制剂(proton pump inhibitors,PPI)可抑制胃酸分泌,常用于治疗消化性溃疡病。临床观察发现长期服用PPI 后,约有20%患者出现易怒、幻觉、自控力缺失等不良反应[77]。H2受体阻断剂,如西咪替丁,也是胃酸分泌抑制剂。已有研究表明,西咪替丁可引起神经紊乱症状,也有帕金森病、锥体外系反应等,但停药后消失[78]。Ma 等[79]研究表明,H2受体与精神分裂相关,H2受体阻断剂会增加患精神分裂的隐患。
3.2.2 治疗胃肠疾病中药在抑郁症中的应用 整体观是中国古人对大自然的认知论,是中医“灵魂”所在,是中医辨证论治的基础。很多中药复方以“胃肠”为主要病位治疗疾病。同时,现代药理研究表明,中药复方还具有神经系统保护作用,可用于治疗抑郁症。四逆散由柴胡、枳实、白芍、炙甘草4味药组成,具有调节肝脾不调之效,临床上常用于治疗胃溃疡、慢性胃炎等疾病。邵丽等[80]研究表明,四逆散可显著升高慢性不可预知温和应激(chronic unpredictable mild stress,CUMS)抑郁大鼠下丘脑中5-HT、NE 和多巴胺的含量。小建中汤由芍药、桂枝、甘草、生姜、大枣组成,可治疗胃及十二指肠溃疡。小建中汤也可用于治疗老年抑郁症[81]。四君子汤由人参、白术、茯苓、甘草4 味药组成,具有补中益气之效,常用于治疗慢性胃炎和消化性溃疡。四君子汤亦可显著提升抑郁大鼠的体质量,降低IL-1、IL-6 含量,有效改善大鼠的抑郁状态[82]。柴胡疏肝散由陈皮、柴胡、川芎、香附、枳壳、芍药、甘草组成,具有疏肝行气兼活血之功效,临床常用于治疗慢性胃炎等肝郁气滞者[83]。
半夏泻心汤由半夏、黄连、黄芩、干姜、甘草、大枣、人参组成,临床多用于胃肠疾病,也用于治疗失眠、抑郁症、偏头痛等神经系统疾病,均具有较好的疗效[84]。升阳益胃汤由黄茂、半夏、人参、甘草、独活、防风、白芍、羌活等组成,主治脾胃虚弱。陈海燕[85]使用升阳益胃汤治疗抑郁症,且效果显著。平胃散由苍术、厚朴、陈皮、甘草、大枣、生姜组成,具有燥湿运脾、行气和胃之功效。施海婷[86]使用平胃散治疗抑郁症,3 个月后患者抑郁症后期症状完全缓解。
3.2.3 治疗胃肠疾病药物与抗抑郁药物联用在抑郁症中的应用 胃肠疾病中药方剂与抗抑郁药联用,抗抑郁效果更加显著。补中益气汤由黄芪、人参、白术、当归、陈皮、升麻、柴胡、甘草药味组成,主治脾虚气陷证,临床可用于治疗慢性胃炎等。刘传勇等[87]使用加减补中益气汤联合盐酸氟西汀治疗抑郁症可以更好地缓解疲惫感,治疗效果显著。吴慧萍[88]使用柴胡疏肝散联合逍遥散治疗产后抑郁,其焦虑抑郁评分显著低于单用氟哌噻吨-美利曲辛片,且患者生活质量亦得到显著提高。见表2。
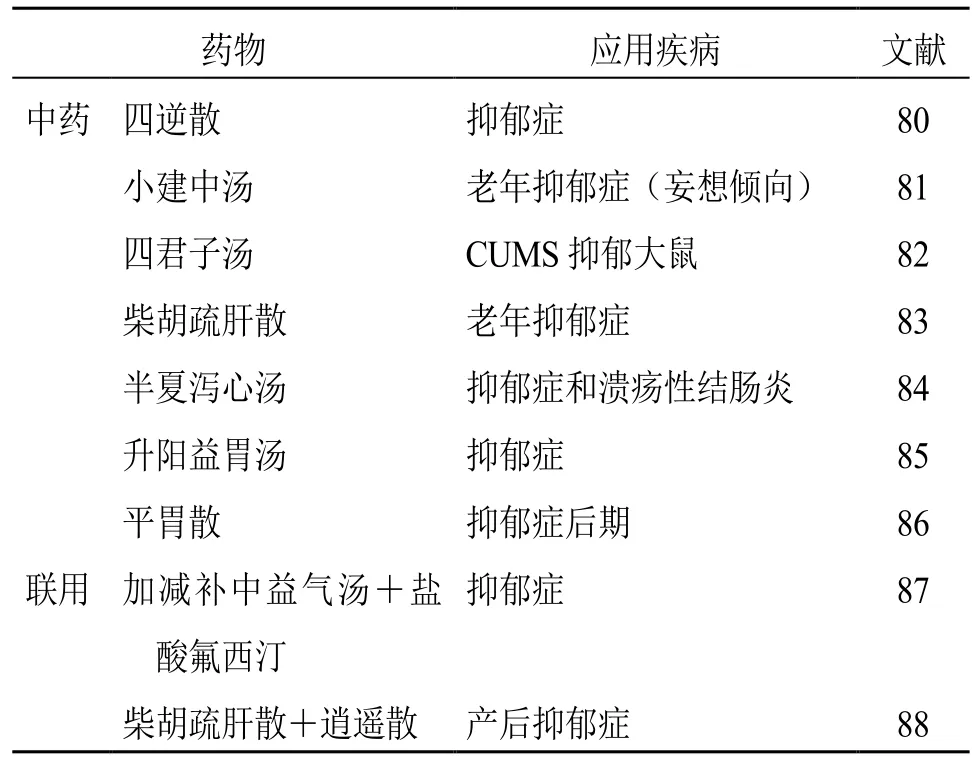
表2 治疗胃肠疾病药物在抑郁症中的应用Table 2 Applications of gastrointestinal disease drugs in treatment of depression
综上,根据中医脏腑理论,脑与胃肠功能相互影响、相关疾病病机互为因果、症状相互串扰,治疗胃肠疾病中药可用于抑郁症的治疗。治疗胃肠疾病中药与抗抑郁药物联用也可用于治疗抑郁症,疗效显著。但目前尚未见单独使用胃肠疾病药物治疗抑郁症的报道,可能与胃肠疾病药物对神经系统的不良反应有关。治疗胃肠疾病药物在抑郁症中应用仍需进一步挖掘。
4 结语与展望
抑郁症和胃肠疾病的发生发展具有双向性。二者相互影响、病理机制互为因果、临床症状相互串扰。“脑-肠”交互作用及相关理论为深入、全面认识2 类疾病提供了新视角,为“脑肠共病”的有效治疗提供了新角度,为临床合理用药提供了理论支持。抑郁症与胃肠疾病共病的神经系统机制包括HPA 轴、自主神经、神经递质系统异常激活,促进炎症过程,诱发或加重抑郁症,同时引起胃肠炎症和黏膜屏障损害,诱发肠道菌群紊乱和功能异常,进而引发胃肠疾病。胃肠道系统机制包括胃肠疾病损伤黏膜屏障,降低机体免疫,诱发大脑功能异常,引发情绪障碍,同时引发胃肠炎症;ENS、肠道菌群及其代谢物功能紊乱进一步诱发或加重抑郁症,也促进了胃肠疾病的发生发展。目前,临床上“肠-脑”疗法应用兴起,并被越来越多的医生与患者接受。抗抑郁药物和胃肠疾病治疗药物可根据实际情况联合应用,在治疗抑郁症、胃肠疾病及二者共病中发挥巨大优势,是中医“脏腑”理论和“脑肠同治”治则治法的具体实践。
本文整合抑郁症与胃肠疾病的“脑-肠”交互机制等相关研究,为全面、深入认识2 类疾病提供新视角,即从“脑”的角度认识肠胃疾病,从“肠”的角度认识抑郁症;为有效治疗2 类疾病提供新思路,即“脑肠同治”,治疗胃肠疾病时辅以“脑”的治疗,治疗抑郁症时辅以“肠”的保护。但是,二者共病的机制仍不明确,药物联用基础研究薄弱,机制仍需进一步深入阐释。基于“脑-肠交互”的中西医理论,从“脑-肠交互”的视角出发,有利于更深层次地揭示胃肠病与抑郁症的内在联系,为临床合理用药奠定坚实的理论基础,为深入阐释中西药联用治疗“脑-肠”共病的科学性和合理性提供夯实的数据支持。
利益冲突所有作者均声明不存在利益冲突

