一种适用于制药领域的纳滤膜有效截留相对分子质量计算方法
徐扬阳,章 莲,沈 欣,支兴蕾,李存玉, ,彭国平,
1.南京中医药大学药学院,江苏 南京 210023
2.江苏省经典名方工程研究中心,江苏 南京 210023
3.江苏省中药资源产业化过程协同创新中心,江苏 南京 210023
4.中药制药过程新技术国家重点实验室,江苏 连云港 222001
纳滤截留相对分子质量(M)在200~1 000,孔径为1~2 nm,具有绿色高效的分离特点,依靠孔径筛分效应和电荷效应等分离原理[1-3],在制药行业多用于热敏性成分的精制处理[4-5]。M是纳滤膜质量评价的关键参数,使用者多根据无机盐在膜表面的电荷排斥呈现出的差异性分离行为进行表征,但无法获得有效M。这导致不同生产厂家、批次、使用周期的纳滤膜难以量化对比,限制了纳滤技术在制药行业中的应用[6-7]。M常用的测定方法包括基准物质截留、电镜扫描、泡点法、液-液置换法、压汞法等[8-10],实际生产应用中主要依据膜制造厂家提供的标示M作为参数,选择性地指导分离应用。随着使用周期的增加,纳滤孔径发生变化,导致“有效”与“标示”M存在差异,出现波动性的分离行为,会直接影响分离效率。有效M评价方法的缺乏是制药行业迫切需要解决的共性技术难题。
中药成分多具有荷电特征,无法避免与纳滤膜分离层发生电荷排斥效应,难以真正反映纳滤膜的真实分离孔径,所以前期建立的孔径检测方法存在一定的局限性[11]。纳滤分离过程中,由于溶剂存在孔道占位效应,且该效应与溶剂相对分子质量、膜孔径直接相关,因此选择相对分子质量呈梯度变化的甲醇、乙醇为基准物质,调节有机溶剂在纳滤膜孔中的占位比例,分析溶剂传质系数(k)-孔道占位的内在相关性,以期构建一种适用于制药企业的纳滤膜有效M计算方法,为中药制剂的标准化生产提供了技术支撑。
1 仪器与材料
1.1 仪器
Fog-machine 中压纳滤泵、TNZ-1 型纳滤分离组件,南京拓鉒医药科技有限公司;KH-250B 型超声波清洗器,昆山禾创超声仪器有限公司;EPEDZ1-10T 型实验室级纯水机,南京易普易达科技发展有限公司;Waters e2695 高效液相色谱仪,PDA 检测器,美国Waters 公司。
1.2 材料
1812 型卷式膜,标准纳滤膜M150~300、200~300、300~500 和600~800,有效滤过面积0.30 m2,南京拓鉒医药科技有限公司;1812 型卷式膜,待测纳滤膜M150~300、200~300、300~500 和600~800,有效滤过面积0.30 m2,南京拓鉒医药科技有限公司;辛弗林对照品,批号110727-201809,质量分数99.5%,中国食品药品检定研究院;辛弗林提取物,批号jbz0101,质量分数99.0%,南京金益柏生物科技有限公司;甲醇、乙醇为色谱纯,无锡市亚盛化工有限公司;水为纯化水,由EPED-Z1-10T型实验室级纯水机纯化得。
2 方法与结果
2.1 溶液的制备
2.1.1 甲醇水溶液 精密量取100%甲醇溶液200、500、700 mL,分别采用纯化水稀释至总体积1 L,即得体积分数为20%、50%、70%甲醇水溶液。
2.1.2 乙醇水溶液 精密量取95%乙醇溶液210、526、737 mL,分别采用纯化水稀释至总体积1 L,即得体积分数为20%、50%、70%乙醇水溶液。
2.1.3 辛弗林对照品溶液 精密称取干燥至恒定质量的辛弗林对照品5.50 mg,置于10 mL 量瓶中,加50%甲醇水溶液稀释至刻度,得质量浓度为0.57 mg/mL 的辛弗林对照品溶液。
2.1.4 辛弗林提取物溶液 精密称取辛弗林提取物适量,纯化水超声溶解,配制含辛弗林质量浓度为0.12 mg/mL 的辛弗林提取物溶液。
2.2 纳滤分离操作
采用耐高压管路依次连接Fog-machine 中压纳滤泵、TNZ-1 型纳滤分离组件,将系列M的纳滤膜分别置于纳滤分离设备的膜管中,采用纯化水清洗,通过转速和截留阀调节跨膜压力差为0.2、0.4、0.6、0.8、1.0、1.2 MPa,测量纳滤膜膜通量(Jv,m/s),待不同跨膜压力差下系列纳滤膜Jv趋于稳定性后,排空纳滤膜组件及管路中残留的水溶液,更换供试品溶液进行纳滤分离。采用甲醇水溶液、乙醇水溶液及辛弗林溶液分离时,不同溶液环境之间需要采用纯化水清洗至Jv恢复至95%~105%,每组操作平行3 次,取平均值。
2.3 样品检测
2.3.1 色谱条件[12]色谱柱为Hanbon C18柱(250 mm×4.6 mm,5 μm);流动相为甲醇-磷酸二氢钾水溶液(取磷酸二氢钾0.6 g,十二烷基硫酸钠1.0 g,冰醋酸1 mL,加水溶解并稀释至1 000 mL)(50∶50);检测波长275 nm;体积流量1 mL/min;进样量10 μL。
2.3.2 线性关系考察 分别精密移取辛弗林对照品溶液0.10、0.20、0.50、1.00、2.00 mL 置于5 mL 量瓶中,50%甲醇水溶液定容至刻度,高效液相色谱仪检测,以峰面积为纵坐标(Y),辛弗林质量浓度为横坐标(X),得线性回归方程Y=655.7X-1 309.5,r2=0.999 2,线性范围11.40~228.00 μg/mL。
2.4 纳滤有效膜孔径评价方法相关数据拟合
分别收集溶剂体系为水、甲醇水溶液、乙醇水溶液环境时,系列跨膜压力差(0.2、0.4、0.6、0.8、1.0、1.2 MPa)下的Jv,根据式(1)[13]计算水、甲醇水溶液、乙醇水溶液不同溶剂的k,其中成分表观截留率(R)按99%计算。根据式(1)拟合ln[(1-R)∙Jv/R]与Jv的线性方程,斜率为1/k,截距为ln[DK/δ];R为截留率;δ为膜厚度(cm);DK/δ用于表征膜传质性能(m/s)。
根据式(2)纳滤膜M与纳滤膜等效细孔半径的相关方程计算膜孔半径(rS)[14],其中M是纳滤膜截留相对分子质量;rS为膜孔半径(nm)。
进而拟合k与rS的内在相关性,其中k可以表征溶质或溶剂的传质速度,且纳滤膜孔半径与传质速度直接相关,参考Gouy-Chapman-Stern 模型[15],超微孔界面的流动速度与膜孔半径呈幂函数相关,计算溶剂为水时的k与rS的幂函数方程,即式(3),并以该方程作为标准参考方程,其中要求相关性系数(R2)>0.95,a 为常数值。
由于纯水属于去离子水,纯度较高,分子质量相对很小,在纳滤膜中直接透过,且纳滤膜的清洗常常使用纯水。所以,水对纳滤膜有效M的影响可以忽略不计。
以水溶液为参照,将不同体积分数甲醇溶液、乙醇溶液k带入所求式(3)中,计算标准纳滤膜在不同体积分数甲醇、乙醇环境下的实际有效rS和M,再根据式(4)计算溶剂的孔道占位比例(P)。
根据式(1)~(4)计算待测膜的膜孔径在不同体积分数甲醇溶液、乙醇溶液(有机溶剂)下,相对于标准膜以纯水为溶剂时的占位比例,并与标准膜的有机溶剂占位比例进行对比,判定待测纳滤膜的孔径变化。
2.5 k 与纳滤膜孔半径的相关性
2.5.1 ln[(1-R)∙Jv/R]与Jv的相关性 对系列水、甲醇水溶液、乙醇水溶液体系下的ln[(1-R)∙Jv/R]与Jv进行相关性拟合,结果见图1,根据式(1),进而得到斜率1/k,求得k。表1 为M450 纳滤膜在0.2 MPa时不同体积分数甲醇溶液、乙醇溶液的Jv。可以发现在相同孔径的纳滤膜中,随着乙醇、甲醇体积分数的升高,Jv均呈现下降趋势,乙醇溶液的孔道占位效应大于甲醇溶液[19]。

表1 有机溶剂下纳滤的JvTable 1 Jv of nanofiltration under organic solvents

图1 不同M 时乙醇-水体系和甲醇-水体系下ln[(1-R)·Jv/R]与Jv 相关性拟合Fig.1 Correlation fitting between ln[(1-R)·Jv/R] and Jv under different M conditions in ethanol water system and methanol water system
2.5.2 水 水分子在纳滤膜的孔道占位效应较弱,选择水溶剂下k与膜孔半径的相关性为标准参数。将纳滤膜M150~300、200~300、300~500和600~800 取均值,根据式(2)计算纳滤膜孔半径rS,进而与溶剂水的k进行幂函数拟合,得式(3),结果见图2,二者的幂函数方程为k=134.49rS2.926,r=0.993 9,该方程作为k与rS关系的标准方程。

图2 水的传质系数与膜孔半径的幂函数方程Fig.2 Power function equation between water mass transfer coefficient and membrane pore radius
2.5.3 乙醇 收集M150~300、200~300、300~500 和600~800 标准纳滤膜在20%、50%、70%乙醇下的Jv,并对ln[(1-R)∙Jv/R]与Jv进行线性拟合得到k,结果见表2。k与纳滤膜M呈正相关,与乙醇体积分数呈负相关。

表2 乙醇体积分数对k 的影响Table 2 Effects of ethanol volume fraction on k
根据“2.5.2”项中拟合的纯水下k与rS的标准幂函数关系,计算得到系列乙醇体积分数下的真实有效rS。从表3 中数据可以看出,乙醇的孔道占位效应,随着体积分数增加而升高,其中在M偏低的纳滤膜中更为明显。
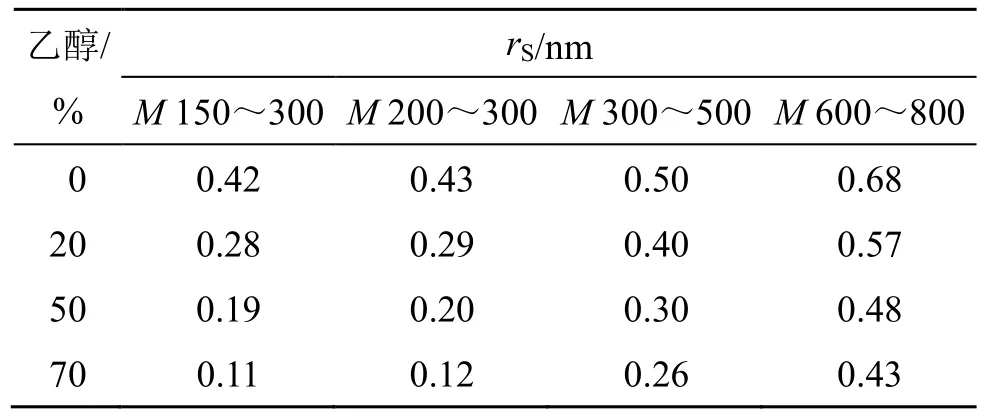
表3 不同乙醇体积分数环境下的纳滤有效孔径Table 3 Effective pore size of nanofiltration under different ethanol volume fractions
根据纳滤膜M与膜孔半径rS的相关性[14],代入有效孔径rS,计算得到纳滤膜有效平均M,以水获得的有效平均M为参照,计算乙醇溶液的P,结果见表4。标示M为150~300 和200~300 的有效M相近,乙醇溶液的P与乙醇体积分数呈正相关,与纳滤膜M呈负相关。

表4 乙醇溶液的PTable 4 P of ethanol solution
2.5.4 甲醇 拟合系列甲醇溶液环境下ln[(1-R)∙Jv/R]与Jv的相关性,计算传质系数,结果见表5。相较于乙醇溶液环境下的纳滤分离规律,甲醇在同等条件下的传质系数明显大于乙醇,且随着甲醇浓度升高,传质系数下降程度也低于乙醇。
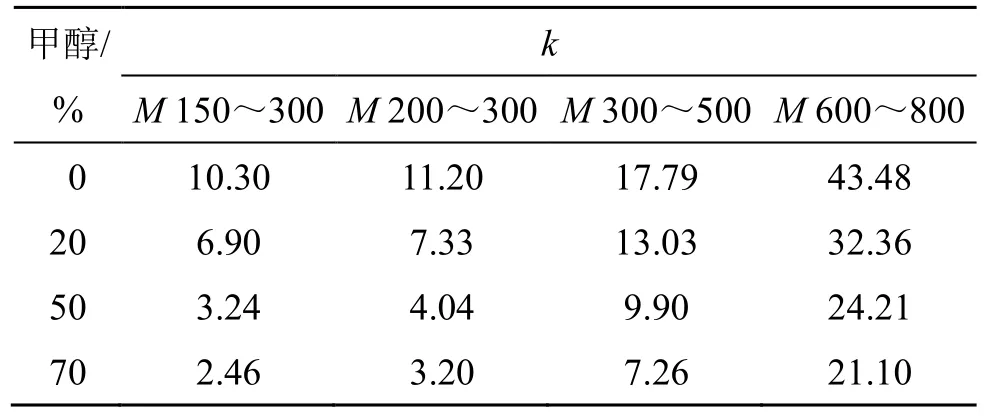
表5 甲醇体积分数对k 的影响Table 5 Effects of methanol volume fraction on k
根据纯水下k与rS的标准幂函数关系,计算得到系列甲醇体积分数下的真实有效rS。对比表3 和表6 中数据,甲醇和乙醇的孔道占位效应,均随着有机溶剂的体积分数增加而升高,其中因为乙醇的分子质量大于甲醇,孔道占位效应更加明显。
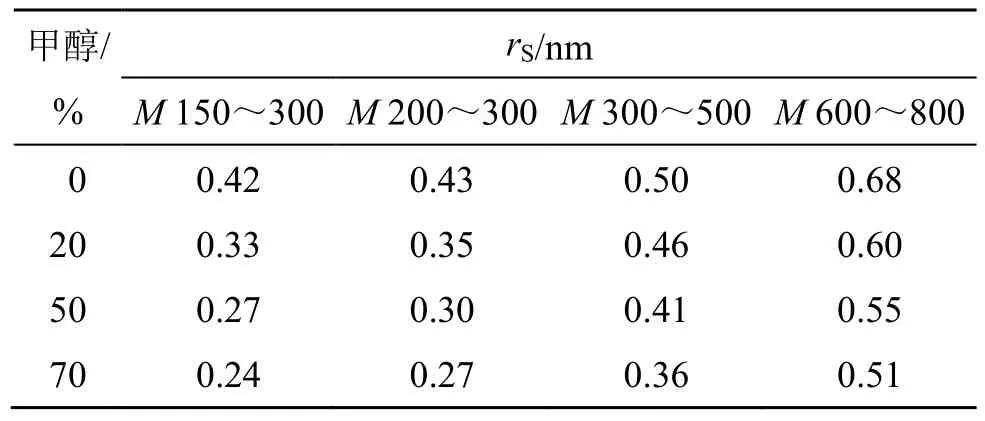
表6 不同甲醇体积分数环境下的纳滤有效孔径Table 6 Effective pore size of nanofiltration under different methanol volume fractions
对比表4 和表7 中数据,甲醇溶液的孔道占位效应低于乙醇溶液。随着甲醇体积分数的升高,纳滤膜有效M出现下降趋势,P升高。以P与溶剂体积分数进行相关性分析,相较于乙醇溶液,甲醇在纳滤膜中的P变化更为灵敏。

表7 甲醇溶液的PTable 7 P of methanol solution
2.6 纳滤膜孔径评价方法
将系列标准纳滤膜的P与溶剂体积分数的相关性数据点做折线图,虚线连接相同溶剂体积分数下的数据点,获得具有分布区域的孔径评价分布曲线,结果见图3、4。将待测纳滤膜分别采用20%~70%甲醇、乙醇溶液进行分离,分别收集并计算k,有效rS、有效M,拟合相应的P,根据P落入区间,综合判断待测纳滤膜的孔径分布特征。
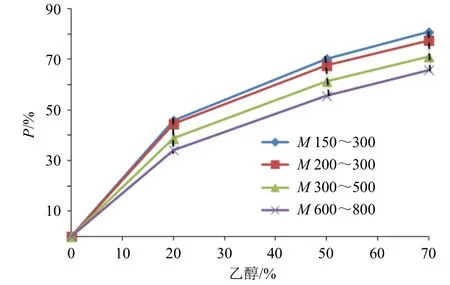
图3 乙醇-水体系下标准纳滤膜孔径评价曲线Fig.3 Evaluation curve of standard nanofiltration membrane pore size under ethanol water system
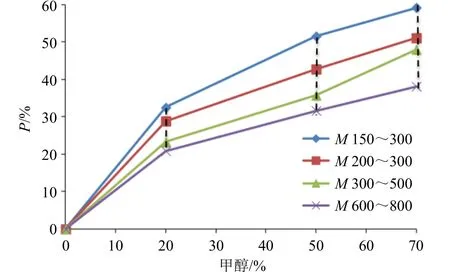
图4 甲醇-水体系下标准纳滤膜孔径评价曲线Fig.4 Evaluation curve of standard nanofiltration membrane pore size under methanol water system
2.7 待测纳滤膜孔径测定结果
测量使用周期3~5 年,标示M分别为150~300、200~300、300~500、600~800 的纳滤膜在纯化水,20%、50%、70%甲醇,20%、50%、70%乙醇溶液环境下的k,根据k与有效rS的幂函数方程,计算有效M和P,结果见表8。通过纯水测定的纳滤膜有效M可知,长时间使用的纳滤膜的M均会发生改变,其中M150~300、M600~800 有效M出现下降的现象,推测与膜污染等因素有关,经乙醇及甲醇进行孔径校正时,有效M并未随着有机溶剂的清洗恢复通量和有效M,说明污染物为不溶性微粒引起的机械堵塞。M200~300 和M300~500的有效M均出现增加的现象,水的P均为负值,结合乙醇及甲醇溶液测定的有效M,推测长时间高压分离引起了纳滤膜完整性发生改变。同时,结合扫描电镜图进行分析,图5-a、b 分别为M600~800待测膜和标准膜的扫描电镜图,二图对比可以发现待测膜表面覆盖着一层污染物。图5-c 中可以看出M300~500 待测膜表面更粗糙,存在部分膜材质层脱落的情况,膜的完整性存在问题。

表8 待测膜不同溶液环境的有效M 及PTable 8 Effective M and P in different solution environments of membranes to be tested

图5 M 600~800 待测膜 (a)、M 600~800 标准膜 (b)、M 300~500 待测膜 (c) 的SEM 图Fig.5 SEM of M 600—800 membrane to be tested (a), M 600—800 standard membrane (b), M 300—500 membrane to be tested (c)
图6、7 待测纳滤膜孔径评价曲线与图3、4 标准纳滤膜孔径评价曲线进行对比,相同截留M的纳滤膜曲线发生了明显变化,其中待测纳滤膜中M150~300、600~800 的占位比例曲线均高于标准膜。虽然通过纯水校正后待测纳滤膜M600~800 的有效M与标准膜M300~500 的相近,但是其孔道占位比例差异,说明因膜污染改变了纳滤孔道的物化性质,改变了两相接触产生的界面层厚度。因此,当纳滤膜因污染导致分离行为改变时,需要采用Jv及P为指标评价膜的清洗效果,从而保障纳滤膜的分离性能。
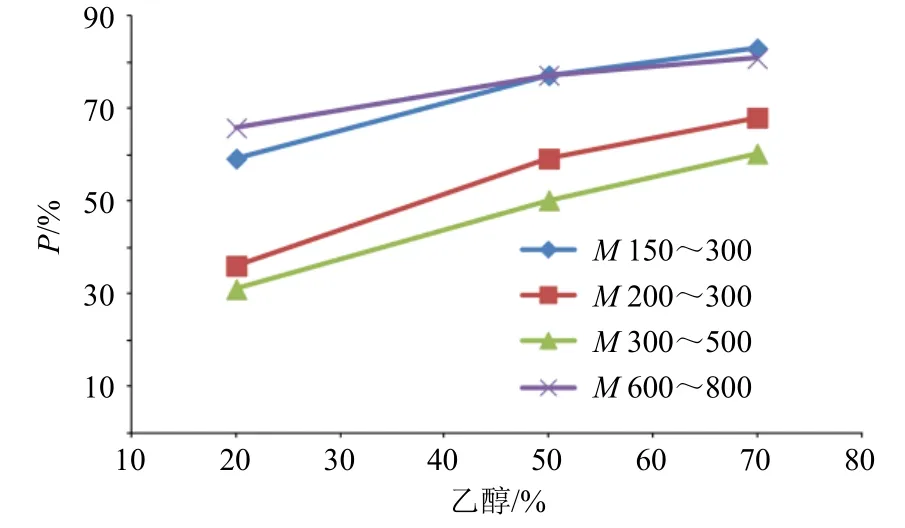
图6 乙醇-水体系下待测纳滤膜孔径评价曲线Fig.6 Evaluation curve of nanofiltration membrane pore size under ethanol water system

图7 甲醇-水体系下待测纳滤膜孔径评价曲线Fig.7 Evaluation curve of nanofiltration membrane pore size under methanol water system
待测纳滤膜中M200~300、300~500 纳滤膜的占位比例曲线均低于标准膜,其中待测纳滤膜M200~300 与标准膜M300~500 的孔径评价曲线相似,而有效M存在差异,说明待测纳滤膜M200~300 在使用过程中分离层脱落,增大了有效M,也引起了界面层厚度的变化。因此,在评价膜纳滤膜质量均一性时需要采用有效M和P为指标进行综合评价。
2.8 辛弗林分离佐证
目前,纳滤膜孔径截留情况检测没有统一标准的基准物质。但总体应基本满足[16]纯度高、分子结构明确,对膜材料吸附较小、浓度分析容易、廉价易得。辛弗林具有酸碱两性、分子式C9H13NO2,相对分子质量(167.21)相对较小,在M150~800 纳滤膜中截留率变化适中。辛弗林在质量浓度10~200 mg/L 时,其相应pKa在8.25~8.84,分别调节辛弗林提取物水溶液环境至pH 4.0 使其以解离态形式存在、pH 10 使其以游离态形式存在、pH 8.5 使其以解离-游离态形式共存[17]。不同存在状态的辛弗林所带电荷量不同,离子态占比越多,其所带电荷量越多。在纳滤分离时根据辛弗林的解离常数pKa、不同存在状态,结合孔径筛分和道南效应进行分析,其表现出差异性分离特征[18],可用于纳滤M的定性评价。通过调节辛弗林提取物溶液pH 为4.0、8.5、10.0,在跨膜压力差为1.0 MPa 时,分别采用标准纳滤膜及待测纳滤膜进行分离,待辛弗林与纳滤膜之间吸附-解吸附趋于稳定时,分别收集平衡液及纳滤液,液相检测平衡液及纳滤液中辛弗林质量浓度(C平衡、C纳滤),计算截留率(R,R=1-C纳滤/C平衡),对比不同孔径及不同使用年限纳滤膜的辛弗林截留率差异,对纳滤膜孔径进行评价。
2.9 辛弗林佐证结果
由表9 可知,标准纳滤膜在pH 4.0 时,以离子态形式存在的辛弗林,在电荷效应的作用下,截留率均高于90%,随着pH 值升高,辛弗林从离子态逐步向分子态形式过渡[17],在电荷效应和孔径筛分效应的协同作用下,辛弗林截留率随着离子态减少而下降,随着纳滤膜M的升高而逐渐降低。

表9 标准纳滤膜和待测纳滤膜对辛弗林纳滤截留率Table 9 Synephrine nanofiltration rejection rate of standard nanofiltration membrane and nanofiltration membrane to be tested
表9 中,待测纳滤膜中M200~300、300~500的辛弗林截留率与标准膜相比明显下降。结合图5-c 的电镜扫描图,推测因待测膜发生破损,其膜分离层材质脱落,膜孔“增大”,膜面电荷效应下降,离子态形式存在的辛弗林也难以维持较高的截留率。待测纳滤膜中M150~300、600~800 的辛弗林截留率均高于标准膜,根据pH 10.0 时游离态形式的辛弗林的截留行为差异,说明纳滤膜受到污染堵塞,有效M均出现下降的趋势。通过调节辛弗林存在状态改变纳滤分离行为,可以初步判断纳滤膜孔径的变化趋势,进而结合有机溶剂孔道占位引起的有效M及P的变化,可以综合评价纳滤膜的M、污染情况以及完整性特征。
3 讨论
以纯水环境下k与膜孔半径的相关幂函数关系为参数,计算不同体积分数甲醇、乙醇的P,其中,有机溶剂的孔道占位效应随有效M的减小而增大;有机溶剂分子越大,孔道占位效应越大。并结合不同存在状态辛弗林的截留行为,构建有效M、孔径评价曲线和辛弗林分离行为3 者综合的评价方法,对待测纳滤膜的质量进行评价。
有效M是衡量纳滤膜分离性能的重要参数,生产厂家根据制膜工艺在出厂时提供了标示M,但对于技术应用企业如何判定不同生产批次、不同使用周期的纳滤膜的M、组件完整性,是目前行业中尚不能解决的技术难题。通过借助中性溶剂水、甲醇、乙醇在纳滤膜中的孔道占位效应,提供一种纳滤膜有效M的计算方法,解决因膜污染、组件破损引起的孔径变化,而无法判断纳滤膜M的生产现状[20],为制药企业的标准化生产提供了技术支撑。
超滤膜M可以采用标准相对分子质量的球蛋白或多糖校准,纳滤膜的孔径尺寸远小于超滤膜,通常采用无机盐及寡糖进行判断[21],但这是一种单点式的判断方法对纳滤膜孔径变化进行定性分析,而根据纳滤膜M与膜孔半径rS的相关性,结合k与有效孔径的幂函数方程,推算得到有效M和P,结合孔径评价曲线变化趋势,这种多方法结合的判断法可以更全面的评价纳滤膜的有效M,并能够判断膜完整性和污染情况。
由于膜材质与有机溶剂的兼容性问题,所建立的方法是基于复合聚酰胺对80%以下甲醇和乙醇溶剂具有较好耐受性这一条件。但在通量恢复过程中,复合聚酰胺材质因溶胀在碱性溶液环境下易分解,因此需要采用纯水浸泡、清洗后更换溶剂系统进行孔道占位实验分析。纳滤膜材质具有多样性,本方法目前适用于聚酰胺类材质,而其他常见纤维素、磺化聚砜、聚丙烯腈等材质的有效M计算方法,需要明确溶剂兼容性的前提下,再建立有效M计算方法[22]。
利益冲突所有作者均声明不存在利益冲突

