当归实时荧光定量PCR 内参基因筛选
朋冬琴 ,罗蜜蜜 ,郭欣慰,栗孟飞 , ,魏建和*
1.甘肃农业大学 生命科学技术学院,甘肃 兰州 730070
2.干旱生境作物学国家重点实验室,甘肃 兰州 730070
3.中国医学科学院北京协和医学院 药用植物研究所,北京 100193
4.甘肃农业大学农学院,甘肃 兰州 730070
当归Angelicasinensis(Oliv.) Diels 为多年生草本植物,主要种植于我国甘肃、云南和青海等高寒阴湿地区[1-2]。其干燥根为我国常用大宗药材,具有补血活血、调经止痛、润肠通便等功效[3-4]。现代药理研究表明,根中多糖对保肝、类风湿性关节炎和缺血性中风[5-7],酚类化合物对抗炎、抗增殖和血小板聚集[8-10],以及有机酸对抗阿尔茨海默病、抗氧化和抗炎等具有显著效果[4,11-12]。
独特的药理作用,促使当归全球市场需求量逐年增加,目前,年均需求量已超过30 000 t,种植面积约43 000 hm2[13-14]。但在实际的生产过程中,当归产量和品质的提升一直受到早薹开花、连作障碍和逆境胁迫等因素的制约[14-16]。大量研究证实,当归产量和品质的形成主要受到基因表达调控的影响,比如,质量标志物阿魏酸的生物合成受到苯丙氨酸解氨酶基因(PAL)、肉桂酸4-羟化酶基因(C4H)、对香豆素酸3-羟化酶基因(C3H)和咖啡酸3-O-甲基转移酶基因(COMT)的调节[15];早薹开花受到constans 1 过表达抑制剂(suppressorofoverexpression ofconstans1,SOC1)、开花时间控制蛋白(flowering timecontrolproteinFCA,FCA)和早花3(early flowering3,ELF3)等基因的调控[16-19];逆境胁迫(如寒冷、干旱和病原体)受到乙烯反应性转录因子(ethylene‐responsivetranscriptionfactors,ERFs)、冷反应蛋白激酶1(cold‐responsiveproteinkinase1,CRPK1)和促分裂原活化蛋白激酶(mitogen‐activated proteinkinases,MPKs)等基因的调控[19]。因此,准确检测当归生长过程中的基因表达水平,对于产量和品质的促成具有重要作用。
目前,Northern 印迹、RNase 保护分析、原位杂交、半定量逆转录PCR(semi-RT-PCR)和实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)等多种检测方法已被应用于检测动物、植物和微生物中基因的表达水平[20]。其中,qRT-PCR 检测因其高效、灵敏和适用于不同样品而被广泛应用于评估基因的表达水平[20]。在qRT-PCR 实验中,内参基因通过控制潜在的实验误差,在规范靶基因的表达水平方面发挥着关键作用[20-22]。肌动蛋白(Actin,ACT)、泛素结合酶(ubiquitin-conjugating enzyme,UBC)、核糖体蛋白Ls(ribosomal protein Ls,RPLs)、18S 核糖体RNA(18S ribosomal RNA,18SrRNA)、含NAC 结构域的蛋白质(NAC domain-containing protein,NAC)和伸长率1-a(elongation factor 1-a,EF1-a)等持家基因通常被选为qRT-PCR 检测中的内参基因[23]。例如穿心莲中的UBC[24],三叶木通和板蓝根中的EF-1α[25-26],以及延胡索中稳定表达的RPL7均是持家基因[27]。
到目前为止,只有ACT[28]和甘油醛-3-磷酸脱氢酶基因GAPDH( glyceraldehyde-3-phosphate dehydrogenase)[29]被报道用于当归qRT-PCR 检测中的内参基因。随着测序技术的快速发展,从当归中鉴定出越来越多的持家基因[16-19,30],这为选择稳定的内参基因奠定了基础。本研究基于当归全长转录组获得的13 个候选基因和前期文献报道的ACT,通过 qRT-PCR 检测和 geNorm、NormFinder、BestKeeper、∆Ct以及RefFinder 软件分析,综合评估了14 个候选内参基因在当归不同生长期、春化温度、组织部位以及抽薹/未抽薹植株中的稳定性。研究结果将为当归产量和品质形成过程中的基因表达分析提供重要参考。
1 材料和仪器
1.1 植物材料
本研究所用样品原植物由甘肃农业大学孙学刚教授鉴定为伞形科当归属植物当归A.sinensis(Oliv.) Diels。样品采集详细信息见表1。所有样品在qRT-PCR 统一检测前,−80 ℃保存。

表1 样品详细信息Table 1 Detailed information of experimental samples
1.2 仪器
台式高速离心机(德国SORVAL 公司);ABI QuantStudio 5 实时荧光定量PCR 仪(美国ABI 公司);NanoDrop 2000 紫外分光光度计(美国Thermo公司)。
2 方法
2.1 总RNA 提取和cDNA 合成
使用Plant RNA Kit 试剂盒(R6827,Omega 公司)提取总RNA;使用NanoDrop 2000 紫外分光光度计检测RNA 样品浓度(A260/A280在1.90~2.10);通过1.5%琼脂糖凝胶电泳检测总RNA 完整性;FastKing RT 试剂盒(KR116,Tiangen)合成cDNA。
2.2 引物设计和qRT-PCR 检测
基于当归全长转录组数据[19](https://www.ncbi.nlm.nih.gov/bioproject/PRJNA789039),从中筛选出13个候选内参基因,利用NCBI 中Primer-BLAST 工具设计引物,并由生工生物工程(上海)股份有限公司合成;另外,还选择前期报道的1 个ACT基因[28],具体序列及产物长度见表2。利用SuperReal PreMix Plus(SYBR Green)试剂盒(FP205,Tiangen)进行qRT-PCR 检测。利用Excel 绘制标准曲线,横坐标(X)为cDNA 稀释倍数的对数值,纵坐标(Y)为Ct值,得到标准曲线方程和线性相关系数(R2),根据标准曲线斜率值计算扩增效率[32]。

表2 qRT-PCR 分析引物序列Table 2 Sequences of primer used in the qRT-PCR analysis
2.3 数据分析
使用Microsoft Office Excel 2010 进行数据处理,使用 geNorm[33]、NormFinder[34]、BestKeeper[35]和∆CT[36]软件对候选内参基因的表达稳定性进行分析,利用RefFinder 在线网站综合评价内参基因[37],采用SPSS 22.0 软件进行One-Way ANOVA Duncan 数据差异性分析(P<0.05)。
2.4 候选内参基因的验证
为了验证所选内参基因表达的稳定性,针对2 个关键基因SOC1和CAD1在当归4 个不同生长发育时期(S1~S4)的表达水平进行比较。SOC1是花器官分生组织形成过程中的关键基因,可通过整合外界环境和内在因素等各种成花途径信号,激活下游花器官发育所需的基因促进植株开花[38]。CAD1可参与催化香豆醛形成松柏醇,然后聚合形成木质素[39]。qRT-PCR 检测同“2.2”项,采用2−ΔΔCt法计算基因相对表达水平[40-42]。
3 结果与分析
3.1 引物验证
对当归各组织RNA 进行琼脂糖凝胶电泳检测,发现均具有28 S RNA、18 S RNA 2 条明显清晰的条带,且没有消失或弥散现象(图1),说明RNA 没有降解,完整性良好,符合后续实验要求。qRT-PCR 结果显示,14 个候选内参基因扩增效率在96.31%~108.71%,相关系数在0.953 2~0.999 1(表3)。同时,每个引物的熔解曲线均为特异的单一扩增峰(图2),没有产生引物二聚体,表明这14 个候选内参基因均具有良好的特异性,反应专一性高,符合qRT-PCR 引物标准,可以进行后续实验。
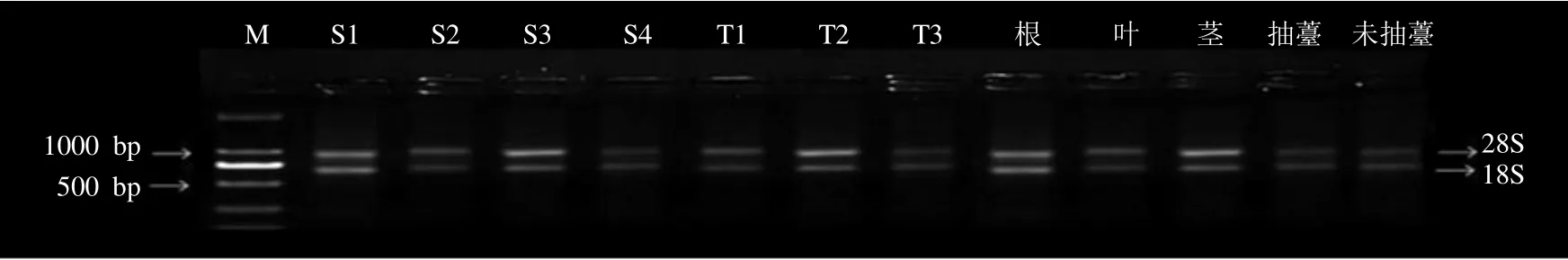
图1 不同样本总RNA 琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of total RNA from different samples

图2 14 个候选内参基因溶解曲线Fig.2 Melting curves of 14 candidate reference genes

表3 候选内参基因的标曲方程、扩增效率及相关系数Table 3 Scalar equations, amplification efficiencies and correlation coefficients of candidate reference genes
3.2 候选内参基因Ct 值分析
在基因表达分析中,Ct值是反映基因表达丰度的一个重要参数,Ct值越低,基因的表达量越高[31]。将荧光定量结果值绘制成箱线图,箱宽代表数据的波动程度,箱线长度则反应基因的稳定性,图3 结果显示,14 个候选基因Ct值分布在18.32~32.99,其中,RPL37A的波动幅度最小,其次是UBC32和RID2;相反,REFA1的波动幅度最大,表明其稳定性最差。

图3 候选内参基因Ct 值分布Fig.3 Ct value distribution of candidate reference genes
3.3 geNorm 分析
利用geNorm 计算候选内参基因平均稳定值(M),M 值越小,基因表达越稳定(M 值小于1.5为阈值)[33]。图4 结果显示,14 个候选内参基因所有M 值均低于1.5,表明这14 个基因表达均相对稳定,进而可以初步用作候选基因。geNorm 软件评价显示,在4 个不同生长发育时期样品中,ACT7和UBC32的M 值最低(0.10),表达最稳定,而NAC071的M 值最高(0.75,图4-A);在不同春化温度样品中,UBC32和EEF1G的M 值最低(0.07),而RPL37A的M 值最高(0.60,图4-B);在不同组织部位样品中,UBC2和NAC071的M 值最低(0.04),而RPL37A的M 值最高(1.16,图4-C);在抽薹/未抽薹植株样品中,REFA1和EEF1G的M值最低(0.04),而UBC32的M 值最高(0.62,图4-D);在所有实验样品中,RPL3和EEF1G的M 值最低(0.43),而NAC071的M 值最高(1.02,图4-E)。基于geNorm 分析,EEF1G、UBC2、ACT7、REFA1和RPL3表现出相对较高的稳定性。

图4 geNorm 分析候选内参基因表达稳定性Fig.4 Expression stability of candidate reference genes analyzed by geNorm
为获得更可靠的评价结果,利用候选内参基因标准化因子的配对差异分析(Vn/Vn+1)来选择内参基因的最佳数目,Vn/Vn+1<0.15 时表示n个内参基因已经满足稳定归一化[33,35]。图5 结果显示,除了V2/V3(0.165)中所有样品组外,几乎所有的配对变异值均小于0.15,表明2 个内参基因足以满足当归qRT-PCR 定量分析结果的可靠性。
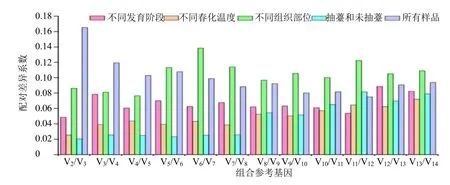
图5 geNorm 分析候选内参基因配对变异系数Fig.5 Coefficients of paired variation of candidate reference genes analyzed by geNorm
3.4 NormFinder 分析
NormFinder 分析是利用M 值对候选内参基因进行排序,M 值越低,内参基因越稳定[34,43]。表4结果显示,14 个候选内参基因的稳定性值存在显著差异,ACT7、REFA1、UBC26和UBC7分别为不同生长发育时期、春化温度、组织部位、抽薹/未抽薹植株中最稳定的内参基因;而EEF1G为所有样品中最稳定的内参基因,其次是UBC26和RPL3。NormFinder 分析的14 个候选内参基因的稳定性与geNorm 分析M 值基本一致。

表4 NormFinder 分析候选内参基因的表达稳定性Table 4 Expression stability of candidate reference genes calculated by NormFinder
3.5 BestKeeper 分析
BestKeeper 分析是根据相关系数、标准偏差和RSD 判断候选基因稳定性,相关系数越高,标准偏差和RSD 越小,基因越稳定,但标准偏差大于1则认为该基因不稳定[44]。表5 结果显示,14 个候选内参基因的稳定值存在显著差异,RPL37A、NAC078、NAC078和NAC071分别为不同发育阶段、春化温度、组织部位、抽薹/未抽薹植株中最稳定的内参基因;而UBC2为所有样品中最稳定的内参基因,其次是UBC32和UBC7。但BestKeeper 分析的14 个候选内参基因的稳定性与 geNorm 和NormFinder 分析结果不一致。

表5 BestKeeper 分析候选内参基因的表达稳定性Table 5 Expression stability of candidate reference genes calculated by BestKeeper
3.6 ∆Ct 分析
∆Ct分析是通过平均标准偏差对候选基因进行排序,平均标准偏差越低,内参基因越稳定[36]。表6 结果显示,14 个候选内参基因的稳定性值存在显著差异,ACT7、REFA1、UBC26和UBC7分别为不同发育阶段、春化温度、组织部位、抽薹/未抽薹植株中最稳定的内参基因;而EEF1G为所有样品中最稳定的内参基因,其次是UBC26和RPL3。∆CT分析的14 个候选内参基因的稳定性与geNorm 和NormFinder 分析结果基本一致。

表6 ∆Ct 分析候选内参基因的表达稳定性Table 6 Expression stability of candidate reference genes calculated by ∆Ct
3.7 RefFinder 分析
RefFinder 软件是基于geNorm、NormFinder、BestKeeper 和∆Ct软件的排序值的几何平均数进行整体排序来确定候选内参基因的稳定性[45]。表7 结果显示,14 个候选内参基因的稳定性值存在显著差异,ACT7、UBC32、UBC26和UBC7分别为不同发育阶段、春化温度、组织部位、抽薹/未抽薹植株中最稳定的内参基因;而EEF1G为所有样品中最稳定的内参基因,其次是RPL3和UBC26。RefFinder分析的14 个候选内参基因的稳定性与NormFinder和∆Ct分析结果一致。结合Ct值、geNorm、NormFinder、BestKeeper、∆Ct和RefFinder 分析结果,可以选择EEF1G、RPL3和UBC26作为内参基因,用于评估当归不同材料中的基因表达水平。

表7 RefFinder 分析候选内参基因的表达稳定性Table 7 Expression stability of candidate reference genes calculated by RefFinder
3.8 内参基因的稳定性验证
为了验证所选内参基因的可靠性,选取最稳定的3 个内参基因EEF1G、RPL3和UBC26以及最不稳定的2 个内参基因NAC071和NAC078,对2 个关键基因SOC1和CAD1在当归4 个不同生长发育时期样品中的相对表达水平进行验证。图6 结果显示,在单个内参基因EEF1G、RPL3和UBC26以及EEF1G+RPL3、EEF1G+UBC26和RPL3+UBC2组合之间,SOC1和CAD1表达水平没有显著差异,但单基因NAC071和NAC078过低评估了目的基因的表达,不能准确呈现基因的表达水平。以上结果表明,以最稳定的3 个基因EEF1G、RPL3和UBC26及其组合,可作为当归不同材料中的内参基因。
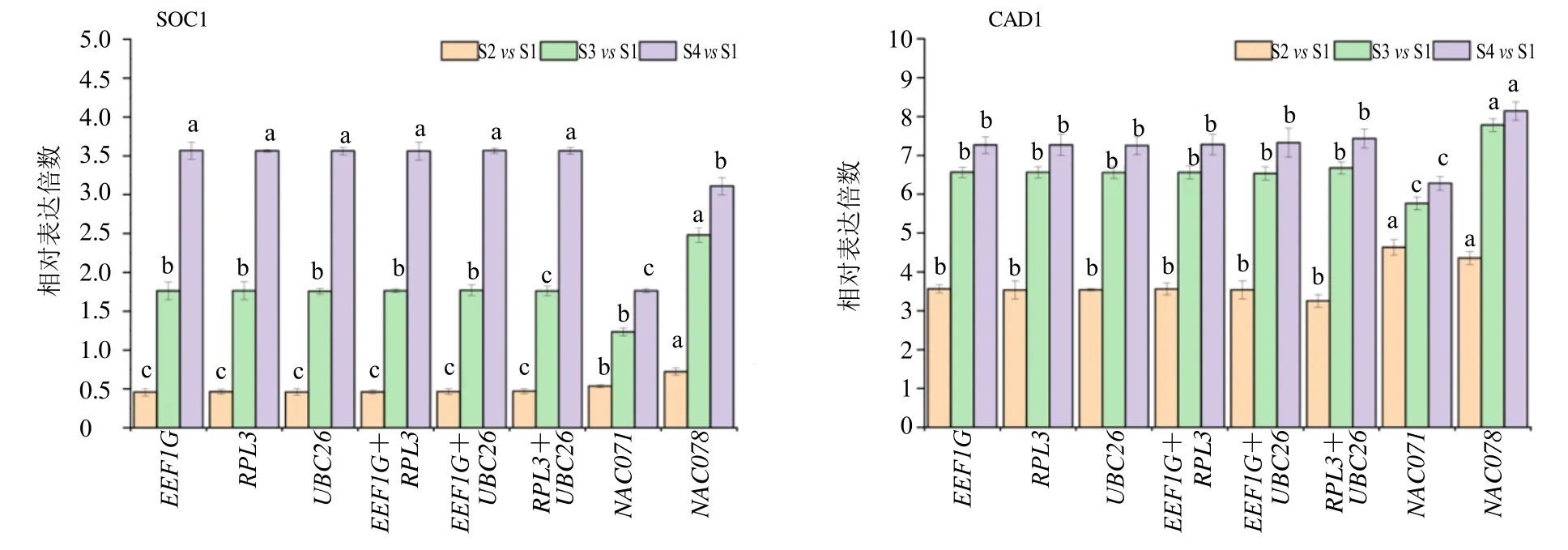
图6 SOC1 和CAD1 在当归不同生长发育时期的表达稳定性分析Fig.6 Stability analysis of SOC1 and CAD1 expression in Angelica sinensis at different growth and development stages
4 讨论
当归是我国常用大宗药材,生物和非生物因素显著影响植株生长和药效成分生物合成,该过程受到生长和代谢相关基因表达的调控[17-18,46]。因此,准确检测关键基因的表达水平对于提高当归体内生物活性代谢产物的积累至关重要。鉴于目前当归仅有2 个内参基因ACT和GAPDH可供选择的现状[28-29],本研究借助前期当归全长转录组测序结果,通过geNorm、NormFinder、BestKeeper、∆Ct和RefFinder 软件分析和验证,从14 个候选内参基因中筛选得到最稳定的3 个基因EEF1G、RPL3和UBC26。
目前,geNorm、NormFinder 和BestKeeper分析已广泛应用于筛选植物中的最适内参基因,比如,研究发现CYP和EF-1a适合作为人参的内参基因[47],ACT5、RPL3和18SrRNA是羊踯躅中表达最稳定的内参基因组合[20],EF1-a、UBC和ACT是牛膝中表达最稳定的内参基因组合[48]。在本研究中,应用Ct值、geNorm、NormFinder、BestKeeper、∆Ct和RefFinder 软件筛选当归不同材料中最稳定的内参基因,结果发现,利用相同的方法,不同样品中14 个候选内参基因的稳定性存在差异,例如,在geNorm 分析中,不同发育阶段、春化温度、组织部位、抽薹/未抽薹植株稳定性较高的基因分别为ACT7和UBC32、UBC32和EEF1G、UBC2和NAC071、以及REFA1和EEF1G;在NormFinder和∆CT 分析中,ACT7、REFA1和UBC26表达最稳定;在BestKeeper 分析中,RPL37A、NAC078和NAC078表达最稳定;在RefFinder 分析中,EEF1G、RPL3和UBC26表达最稳定。
由于不同组织和器官以及不同生长条件下的基因表达存在明显差异[49],因此,有必要找出最稳定的内参基因组合,确保基因表达水平在面对不同的样品时更加准确。目前,候选内参基因在多个药用植物中的表达稳定性已有研究报道,例如,EF-1α与18SrRNA是铁皮石斛不同组织部位中最稳定的内参基因组合[50];UBC与ACT是甘青青兰中响应干旱胁迫时最稳定的内参基因组合[51];ACT与18SrRNA是青蒿中响应镉胁迫时最稳定的内参基因组合[52]。本研究通过验证发现,EEF1G、RPL3和UBC26任意二者组合,可用于准确评估当归不同材料中的基因表达水平。研究结果将为进一步检测当归产量和品质形成过程中的基因表达提供重要参考。
利益冲突所有作者均声明不存在利益冲突

