利用InDel 标记鉴定汴早九号大白菜杂交种纯度
冯健起,王培云,蔡亚平,丁 聪,王惠云,生园园
(1.河南省开封市农林科学研究院 河南开封 475004; 2.河南省开封市种业发展中心 河南开封 475004;3.河南省开封市农业农村发展服务中心 河南开封 475004)
大白菜(Brassica rapa)是起源于我国的一种重要传统蔬菜,在平衡稳定我国“菜篮子”中起着重要作用。随着我国城镇化的发展以及蔬菜多元化的需求,大白菜的消费倾向于优质、小型、软叶率高的品种,汴早九号正是以此为目标选育出来的新品种,2018 年该品种在农业农村部完成非主要农作物品种登记,编号为GPD 大白菜(2018)410957,适合黄淮海流域推广种植,已在河南、河北、安徽、山东等地推广,田间高抗病毒病,抗霜霉病以及软腐病。
种子纯度是种子主要的质量指标,在农业生产中,种子纯度不合格易造成巨大的经济损失[1]。目前,杂交种的纯度鉴定通常采用田间形态学、蛋白质电泳和DNA 分子标记鉴定法。田间形态学鉴定法存在诸如周期长、易受环境影响、重复性差等问题,其准确性难以把握[2]。而分子标记技术因不受组织特异性及外界环境的影响,且具有鉴定准确、快速、重复性强等特点,已成为检测作物杂交种纯度真实且可靠的方法[3]。钟开勤等[1]利用相关序列扩增多态性SRAP(Sequence-Related Amplified Polymorphism)标记技术,快速且准确鉴定福春1 号大白菜的纯度。宋顺华等[4]采用扩增片段长度多态性AFLP(Amplified Fragment Length Polymorphism)技术,准确检测2 个大白菜品种(北京新2 号、京夏王)的纯度。杨晓云等[5]利用简单序列重复SSR(Simple Sequence Repeats)共显性分子标记P3鉴定青研早9 号、青研桔15 和青研春白一号3 个大白菜杂交种的纯度。赵新等[6]应用SSR 分子标记及高分辨率溶解曲线HRM(High-Resolution Melting)技术筛选出用于大白菜杂交种纯度鉴定的复合SSR位点,能对秋绿75、津秋78 和秋绿60 等10 份大白菜杂交种进行纯度鉴定;张庶等[7]利用3 对EST-SSR 引物(BRE28、BRE121 和BRE131)可快速、准确地对13 个大白菜品种进行纯度鉴定;Zhang 等[8]利用在大白菜10 条染色体上均匀分布的36 个SSR 标记,随机选取其中的1~2 个SSR 标记对大白菜杂交种进行纯度鉴定,并结合田间形态学鉴定验证了结果的可靠性;和禹廷等[9]利用2 对SSR 引物(SSRA 07-1 和SSRA 07-2)可以快速鉴定大白菜陕秋白3 号种子纯度;魏小春等[10]基于自交不亲和S 单元型多态性设计引物(BrCI 和BrCII),建立一种广适应性大白菜杂交种纯度分子鉴定方法;薛银鸽等[11]利用InDel(Insertion and Deletion)标记引物组合BrID90107 和BrID10667,可将豫新四号与其亲本完全区分开来,能有效鉴别豫新四号大白菜杂交种纯度;刘栓桃等[12]使用4 对InDel 引物能有效鉴定大白菜品种牛牌19 杂交种纯度;王祥等[13]利用InDel 标记可有效鉴定大白菜农大Q210及农大Q212 种子纯度。然而,目前仍缺乏对汴早九号大白菜杂交种纯度进行高效、准确分子鉴定的方法。
笔者从大量已公布的基于大白菜全基因组开发的InDel 引物中筛选获得了InDel 引物BrID90029,并利用该引物对汴早九号杂交种F1进行纯度鉴定,与田间形态的鉴定结果高度一致,为大白菜杂交种汴早九号的纯度鉴定及良种的安全使用提供分子标记依据和技术支持。
1 材料与方法
1.1 时间和地点
InDel 分子标记鉴定试验于2023 年6 月在河南省农业科学院蔬菜研究所分子生物学实验室进行;育苗、大田种植试验于2023 年7-10 月在开封市蔬菜科学研究所试验基地进行。
1.2 材料
试验材料大白菜(Brassica rapa)杂交种汴早九号、母本P1(早85)、父本P2(345×东二)由开封市蔬菜科学研究所十字花科研究室提供,植株表型如图1所示。塑料大棚内育苗,采用72 孔穴盘,根据天气情况适时加盖遮阳网(遮光率40%),待幼苗长至3 叶1 心期采摘嫩叶提取DNA。
1.3 方法
1.3.1 DNA 提取与定量 采用CTAB 大量法提取大白菜基因组DNA,具体方法参照魏小春[10]等并略有改动。提取的基因组DNA 用1.2%琼脂糖凝胶进行电泳检测,利用凝胶成像系统(Tanon 2500,上海天能)进行凝胶成像分析DNA 完整性,运用核酸定量仪(Nano-300,杭州奥盛)测定DNA 浓度,将DNA 模板原液用ddH2O 稀释为工作液(质量浓度为50 ng·μL-1),保存备用。
1.3.2 InDel 引物来源 选用已公布的基于大白菜全基因组(http://www.brassicadb.cn)[14]开发的32 对InDel 引物,具体的引物信息见表1。
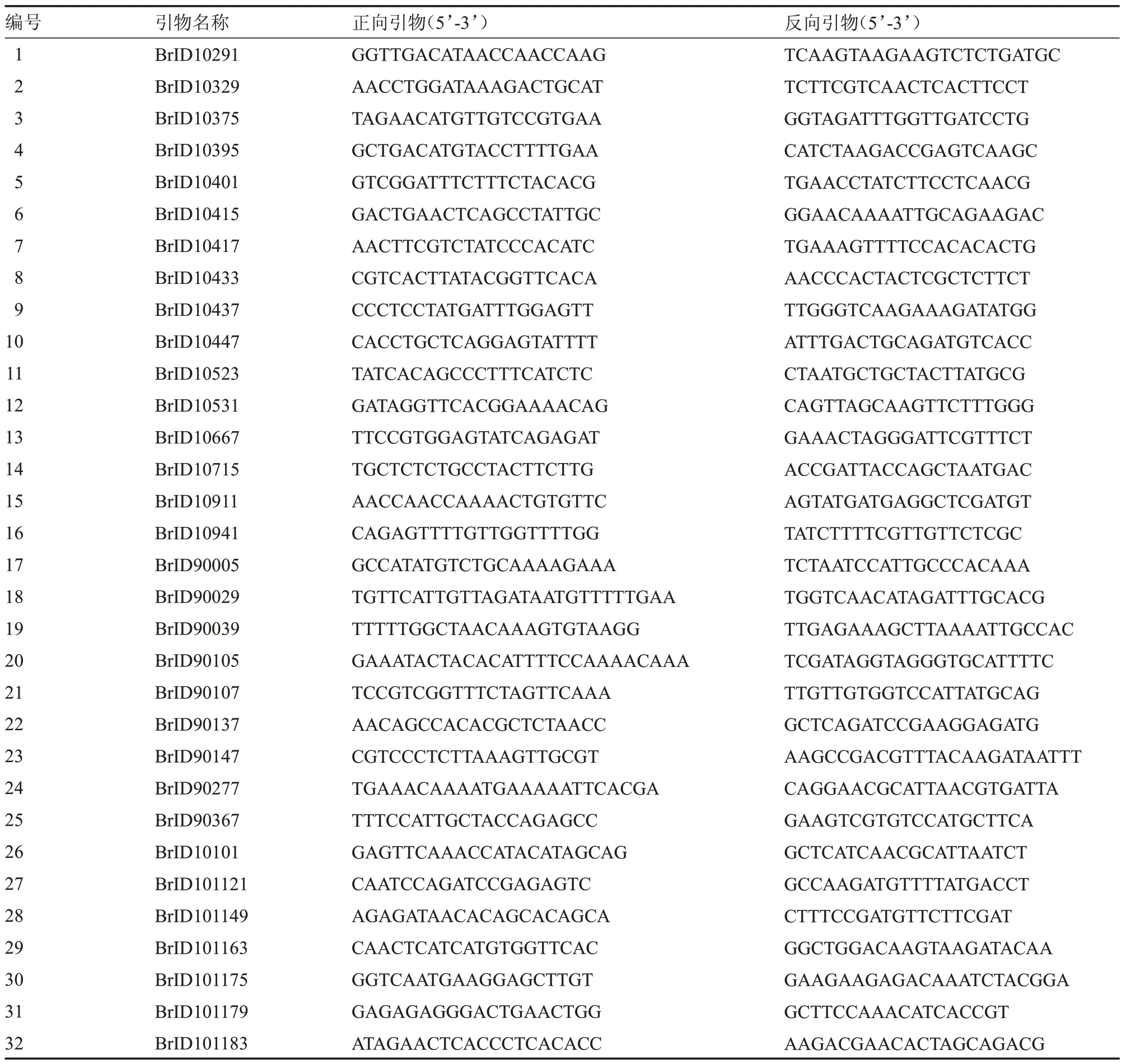
表1 引物信息Table 1 Primer information
1.3.3 PCR 扩增 采用优化后的PCR 反应体系,包括10 μL GenFQTaqMaster Mix(济凡生物科技(北京)有限公司),上、下游引物(浓度为10 μmol·L-1)各1 μL,模板DNA 2 μL,ddH2O 6 μL。
PCR 反应条件:95 ℃条件预变性5 min;95 ℃变性1 min,60 ℃退火30 s,72 ℃延伸30 s,35 个循环;72 ℃延伸7 min,10 ℃条件下保存。
1.3.4 InDel 引物筛选及PCR 扩增产物检测InDel 引物筛选:以汴早九号杂交种的2 个亲本(P1和P2)DNA 为模板,利用表1 中所列的32 对引物进行PCR 扩增,具体参见1.3.3 部分,筛选出父母本间呈互补带型、特异性好、易于辨别的清晰条带的分子标记用于后期杂交种纯度鉴定。
基于筛选试验获得1 对理想的InDel 引物,用于汴早九号大白菜杂交种纯度的分子鉴定。
PCR 产物用聚丙烯酰胺凝胶电泳(PAGE)进行检测分析。
1.3.5 InDel 分子标记鉴定 将汴早九号大白菜杂交种F1种子进行催芽和育苗(共288 株汴早九号大白菜植株),待幼苗长至2~3 叶期时,分别进行单株采集幼嫩叶片用于DNA 提取,并采用InDel 引物BrID90029 分别进行PCR 检测。种子纯度/%=(供检株数-杂株数量)/供检株数×100。同时,将已采样的幼苗在大田定植,进行田间种植鉴定。
1.3.6 田间纯度鉴定方法 自苗期至采收期,观察并统计植株田间表型性状进行纯度鉴定。根据植株生长习性、生长势、叶面茸毛、外叶形状、叶色、叶面皱缩情况、抱合方式、球形、球心色等表型特征判定是否为异型株。每隔3~5 d 观察1 次并记录。田间纯度/%=(供检株数-异形株数)/供检株数×100。
2 结果与分析
2.1 汴早九号多态性引物筛选
对汴早九号的父本、母本各选择10 株,建立DNA 混合池,然后进行引物多态性筛选,结果如图2所示。从已公布的基于大白菜全基因组开发的32对InDel 核心引物中筛选获得了1 对在汴早九号杂交种亲本间具有多态性、带型稳定、易于辨别的InDel 引物BrID90029,编号为18。

图2 汴早九号亲本鉴定多态性分子标记筛选结果Fig.2 The results of InDel markers screening in the parents of Bianzao No.9
2.2 大白菜杂交种汴早九号纯度的鉴定
利用筛选的InDel 引物BrID90029 对汴早九号杂交种进行纯度鉴定,结果如图3 所示,在汴早九号苗期鉴定的288 株中,编号为109、114、120、140、148、170、201 的PCR 产物中只有父本带或者母本带,为非杂交种。样本编号为109、114、140、148、170、201 的植株PCR 产物中缺少母本特异条带,编号为120 的植株缺少父本特异条带。其余的281 株,同时具有父母本特异条带,为杂交种子。分子标记鉴定其杂交种纯度为97.57%。
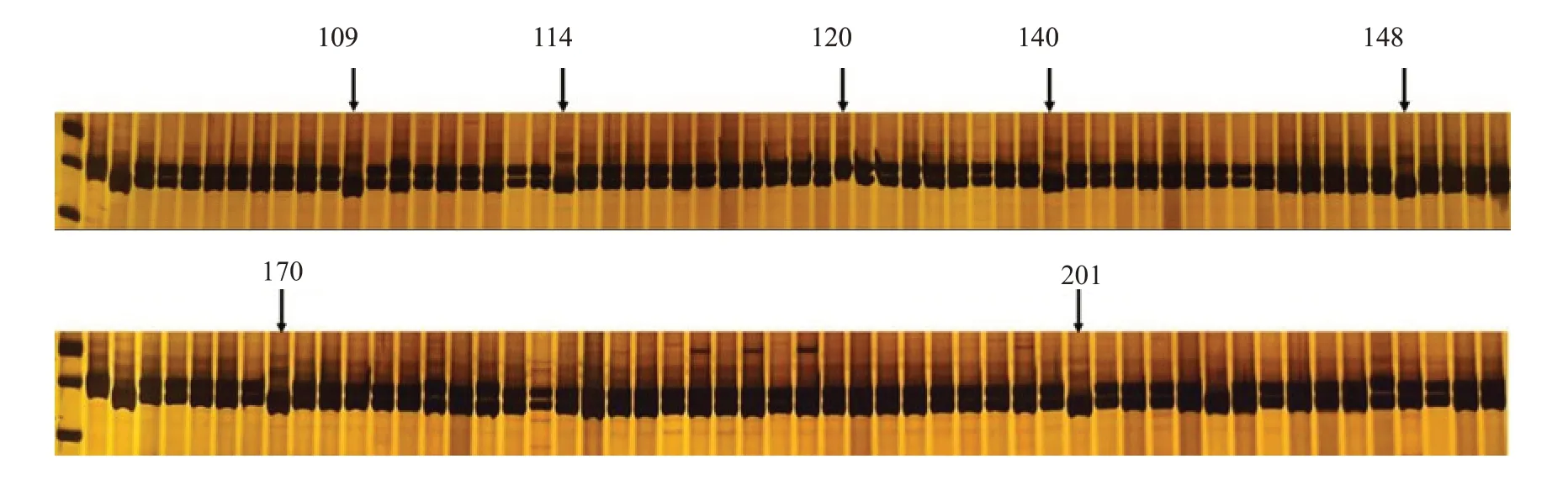
图3 汴早九号分子标记纯度鉴定结果Fig.3 The results of purity identification of Bianzao No.9 using the InDel marker
2.3 田间杂交种纯度鉴定
对汴早九号的288 个单株进行田间表型鉴定(图4),其中发现编号为109、114、140、170、201 的5 株为异形株,田间表型鉴定纯度为98.26%。经计算,田间表型鉴定与分子标记鉴定的吻合度为99.29%(表2)。

表2 汴早九号InDel 标记与田间纯度鉴定结果对比Table 2 Comparison of the results from InDel marker and field identification analyses in Bianzao No.9

图4 汴早九号植株表型Fig.4 Phenotypes of Bianzao No.9 plants
3 讨论与结论
随着大白菜育种技术的进步,新品种数量逐年增加。种子纯度鉴定能够保障种子优良遗传特性被充分利用,是防止良种混杂、提高种子质量的重要手段。在生产实践中,种子纯度不合格可能给农业生产造成巨大的经济损失[1]。
对大白菜杂交种进行纯度鉴定,传统方法是田间形态学鉴定,这一方法通常是当年收获种子,秋季进行田间鉴定,种子第二年才可销售,而且容易受天气等环境因素的影响,耗时长且繁琐,工作量大。随着分子生物技术的发展,分子标记技术越来越多地应用于杂交种的纯度鉴定。基于AFLP、SRAP、RAPD、SSR 和InDel 等分子标记鉴定各种白菜品种和亲本纯度的研究结果表明,分子鉴定结果是可靠的[15-16]。共显性DNA 分子标记技术的优点在于多态性好、易于辨别、操作简单、稳定可靠。因此,基于DNA 分子标记技术能更加有效地鉴别不同的甚至近亲的基因型,该技术在杂交种纯度鉴定等方面具有广阔应用前景。
与SSR 标记相比,InDel 标记的多态性较低、分布较密、带型简单,在遗传分析中的重现性、准确性都相对较高[17],在十字花科蔬菜如大白菜[11-13]、乌菜[18]、萝卜[19]等品种纯度鉴定中应用广泛。利用In-Del 标记进行杂交种纯度鉴定可实现规模化检测,具备广阔的应用前景,有望成为种子纯度鉴定的发展方向。大白菜杂交种汴早九号品质优良,已广泛应用于我国黄淮海流域。为了准确、高效地鉴定汴早九号的种子纯度,保障其品质和生产实践,急需开发适用于汴早九号杂交种纯度鉴定的InDel 分子标记检测方法。
笔者从已公布的基于大白菜全基因组开发的32 对InDel 核心引物中筛选获得了1 对谱带差异大且稳定的双亲互补型InDel 引物(BrID90029)进行汴早九号杂交种的纯度鉴定,对288 份材料的鉴定结果与大田调查结果高度吻合,分子标记鉴定结果与田间形态学鉴定结果相比,差异仅为0.69%,结果偏差≤2%,符合误差允许范围[20-21],检测结果快速、准确。刘栓桃等[12]使用4 对InDel 引物对大白菜品种牛牌19 杂交种进行了有效鉴定。王祥等[13]利用InDel 标记有效鉴定农大Q210 及农大Q212大白菜种子纯度。可见,针对不同的大白菜品种杂交一代种子纯度鉴定可开发特异性的InDel 标记,利用所获得的InDel 标记进行分子鉴定,可快速有效地鉴定大白菜杂交种纯度。笔者的研究结果表明,单一InDel 引物BrID90029 可对大白菜杂交种汴早九号杂交种纯度进行有效鉴定,极大提高了检测效率,解决了田间形态学鉴定种子纯度所面临的难题,可为大白菜种子纯度及真实性鉴定提供新的标记方法。

