土壤改良措施对土壤微生态和西瓜苗期枯萎病防治的影响
陈子彪,易丽聪,李庆柯,3,周 伟,王运强,伍 娜,焦春海,肖 波,戴照义
(1.长江大学园艺园林学院 湖北荆州 434000;2.蔬菜种质创新与遗传改良湖北省重点实验室·湖北省农业科学院经济作物研究所 武汉 430064;3.长江大学农学院 湖北荆州 434000; 4.湖北省农业科学院 武汉 430064)
西瓜是我国重要的园艺作物之一,种植历史悠久,深受大众喜爱。枯萎病是西瓜生产上危害最严重的病害之一,是一种由尖孢镰孢菌西瓜专化型(Fusarium oxysporumf.sp.niveum,FON)侵染引起的一种在世界范围内广泛发生的真菌性土传病害,主要通过土壤传播,也可由种子传播[1]。目前共发现和鉴定出4 个西瓜枯萎病生理小种:生理小种0、1、2 和3,其中生理小种1 是造成我国西瓜枯萎病的优势生理小种[2]。研究表明,随着连作年限的增加,西瓜枯萎病病原菌迅速累积,土壤中镰孢菌属(Fusarium)真菌相对丰度快速上升,破坏西瓜根际土壤微生物群落结构,导致土壤生态系统失衡,西瓜枯萎病发生严重[3]。
微生物是土壤生态系统的重要组成部分,对推动土壤养分循环、改善土壤环境、促进植物生长发育起重要作用[4]。土壤酶在土壤-微生物-植物系统中起到关键的转化作用,土壤理化性质、土壤酶活性和土壤微生物多样性互相影响,且关系密切[5]。温度是影响土壤微生物群落结构和活性的重要因素,高温闷棚是最常见的西瓜枯萎病防治手段之一[6]。Zhang 等[7]研究发现,草原平均气温升高1.8 ℃,明显提高了土壤真菌的活性和丰度,进而提高了对菌类中一些酶的利用效率,极大地影响了土壤微生物群落结构。淹水处理也是生产上防治枯萎病的常见措施,研究发现,淹水处理可以通过影响土壤养分的利用率,加大土壤微生物群落结构的差异,增加根瘤菌、假单胞菌等有益菌的相对丰度[8]。施用微生物菌剂是新兴的绿色土壤改良措施,是影响微生物群落结构最直接的方式之一,研究表明,不同类型外源有机物的投入对土壤微生物种群数量及其群落结构调控的机制存在着显著差异[9-10]。
生产上常见的防治西瓜枯萎病的方法包括嫁接、化学消杀、轮作、夏季高温闷棚、添加微生物菌剂等[11]。但是,嫁接导致生产成本增加且可能影响果实品质[12],而化学防治存在抗药性、安全性和环境污染等问题[13]。随着设施西瓜的不断发展和市场对高品质西瓜需求的增加,生产上急需简单实用、绿色安全的西瓜枯萎病防治技术。但是,目前大部分对土壤改良防控西瓜枯萎病的研究局限于单一的防治效果比较或仅基于单个改良措施[5,12,14],而针对不同土壤改良处理后土壤理化性质、酶活性和土壤微生物群落等变化的研究报道还很少。笔者对混有FON 分生孢子的栽培基质进行物理和生物处理,通过综合比较不同土壤改良措施对土壤微生态环境的影响,分析了土壤改良措施缓解西瓜枯萎病的作用机制,为生产上西瓜枯萎病的绿色防控提供理论基础。
1 材料与方法
1.1 材料
抗病西瓜自交系2W137 和感病对照材料Sugar baby 来自湖北省农业科学院经济作物研究所瓜类组团队;供试病原菌为西瓜枯萎病病原菌1 号生理小种,由浙江大学李大勇教授提供。
1.2 枯萎病人工接种
试验于2022 年9 月至2023 年2 月在湖北省农业科学院经济作物研究所人工培养室完成。枯萎病病菌在PDA 培养基(马铃薯200 g,葡萄糖15 g,琼脂粉18 g,蒸馏水1000 mL)上28 ℃黑暗条件下培养3 d,从菌落边缘取直径5 mm 的菌饼3 块,接种在含有100 mL PDA 培养基的三角瓶中,28 ℃250 r·min-1振荡培养5 d,取培养好的菌液用4 层纱布过滤,除去菌丝,得到孢子悬浮液。用血球计数板记录孢子悬浮液孢子数,并将孢子悬浮液稀释为不同浓度备用。西瓜种子表面消毒后用55 ℃温汤浸泡约3 h,然后置于30 ℃温箱催芽,待胚根长0.5 cm 左右时播种。采用浸根接种法作为西瓜枯萎病抗性鉴定对照,即在西瓜幼苗子叶平展期将根洗净,用5×106个·mL-1孢子悬浮液浸泡15 min 后移栽。其他处理采用菌土混合接种法,枯萎病菌菌液接种浓度设5 个梯度处理,分生孢子浓度分别为1×106、5×105、1×105、5×104、1×104个·mL-1。选用灭菌基质与菌液量按体积比5∶1 混合均匀,分装于50 孔穴盘,然后播种,每穴1 粒。每个穴盘各播种抗病和感病材料20 粒,设3 次重复,分别于接种后9、12、15、18 d 统计病株率。
1.3 土壤改良处理
以生产上常见的枯萎病防治土壤改良措施设置6 个处理:高温消杀(Fon_HT,70 ℃,7 d)、淹水(Fon_FL,水位高于基质2 cm,淹水14 d)、哈茨木霉菌制剂(Fon_T_har,2 g·L-1,有效活菌数≥100 亿·g-1)、枯草芽孢杆菌制剂(Fon_B_sub,2 g·L-1,有效活菌数≥400 亿·g-1)、菌土对照(Fon)、健康土对照(CK)。西瓜材料选用感病种质Sugar baby,每个处理50 株,设3 次重复。
1.4 土壤理化性质和酶活性测定
采用五点取样法,在播种后18 d,分别对6 种处理的西瓜幼苗根际土壤进行取样,混匀后分成小份备用。使用土壤养分速测仪测定土壤有效磷、有效钾、铵态氮含量。使用ELISA 试剂盒测定(北京索莱宝生物股份有限公司)土壤过氧化氢酶(S-CAT)、土壤脲酶(S-UE)、土壤多酚氧化酶(S-PPO)、土壤纤维素酶(S-CL)、土壤蔗糖酶(S-SC)活性。
1.5 土壤微生物多样性测定
采用试剂盒(北京全式金生物技术股份有限公司)提取土壤基因组DNA,用琼脂糖凝胶电泳检测纯度和浓度。分别采用IST1/ITS4 和338F/806R 通用引物进行ITS 和16s rDNA 扩增,PCR 扩增产物经2%的琼脂糖凝胶电泳回收纯化后送至分子标记(武汉)生物育种有限公司测序,每个样品3 次重复。利用Trimmomatic 对Fastq 测序数据进行质控,随后用Flash 软件对两端序列进行拼接。根据已知数据库用uchime 方法比对去除Fasta 序列的嵌合体,对未知数据使用自比对(Denovo)方法进行去除,同时去除不合要求的短序列。使用QIIME2 平台进行微生物多样性分析。利用Uparse 7.0.1001 软件进行聚类分析,根据97%的相似度筛选OTUs 代表序列。对OTUs 序列进行物种注释,并分别在各个分类水平统计各样本的群落组成。利用SILVA 数据库对细菌群落进行分类,利用UNITE 数据库对真菌群落进行分类。以各样品中数据量最少的为标准进行均一化处理。使用FAPROTAX 数据库进行细菌的功能注释,使用FUNGulid 数据库进行真菌的功能注释。
1.6 数据分析
土壤理化性质数据采用Microsoft Excel 2019软件处理,用SPSS 22.0 统计软件进行数据分析,采用单因素方差分析和Duncan 显著差异法分析处理间在0.05 水平上的差异显著性。
2 结果与分析
2.1 枯萎病接种浓度试验
由表1 可知,菌土法1×105个·mL-1接种浓度的西瓜幼苗病株率和浸根法结果高度吻合,接种后18 d,Sugar Baby 和2W137 的病株率分别为100%和0%,确定该孢子浓度为最佳接种浓度。

表1 不同接种浓度和接种方法下西瓜幼苗枯萎病发病情况Table 1 The Fusarium wilt incidence of watermelon seedling under different incubation concentrations and methods
2.2 不同土壤改良处理对土壤养分含量的影响
以病原菌1×105个·mL-1分生孢子浓度为原始接种量进行菌土混合,在播种前利用高温(Fon_HT)、淹 水(Fon_FL)、哈 茨 木 霉 菌(Fon_T_har)和枯草芽孢杆菌(Fon_B_sub)进行土壤改良。结果表明,Fon_HT 处理后土壤中有效磷和铵态氮含量显著高于Fon 对照。Fon_T_har 和Fon_B_sub 处理后土壤中有效磷和有效钾含量与Fon_HT 处理无显著差异,但铵态氮含量显著低于Fon_HT 处理,同时Fon_T_har 处理后的土壤铵态氮含量显著低于Fon 对照。Fon_FL 处理后土壤中的铵态氮含量相较于其他处理均有所下降,且差异显著。菌土对照和其他4 种处理土壤中的有效磷、有效钾和铵态氮含量均低于或显著低于健康土对照CK(表2)。

表2 不同土壤改良处理对土壤养分含量的影响Table 2 The effects of different soil improvement treatments on soil nutrients contents (g·kg-1)
2.3 不同土壤改良处理对土壤酶活性和苗期枯萎病发病率的影响
采用不同土壤改良措施对病土进行土壤改良处理。结果显示,与CK 相比,Fon_HT 和Fon_FL 处理的5 种土壤酶活性均显著下降,除了Fon_HT 处理的S-UE 酶活性显著高于Fon 处理外,两处理其他的土壤酶活性均显著低于Fon_T_har、Fon_B_sub 和Fon 处理。Fon_B_sub 处理后的S-PPO、S-CAT、S-CL 和S-UE 酶活性均显著高于Fon,但均低于CK。Fon_T_har 处理后的S-PPO、S-CL 酶活性均显著高于其他处理,S-SC、S-UE 酶活性均显著高于除CK 外的其他处理,相较于Fon,S-PPO、S-CL、S-SC 和S-UE 酶活性分别提高了65.24%、33.53%、10.59%和38.55%,接近甚至高于CK(表3)。

表3 不同土壤改良处理对西瓜苗期发病率和土壤酶活性的影响Table 3 Effects of different soil improvement treatments on incidence rate of watermelon seedlings and soil enzyme activities
4 种土壤改良措施的西瓜苗期枯萎病发病率由高到 低 依 次 为 Fon_B_sub>Fon_T_har>Fon_FL>Fon_HT,其中Fon_HT 处理的幼苗平均发病率最低,为14.13%,显著低于其他3 种土壤改良处理;Fon_FL 处理可以降低西瓜幼苗枯萎病发病率,幼苗平均发病率为56.33%;Fon_B_sub 和Fon_T_har 处理对该浓度下的西瓜枯萎病防治效果较差,幼苗平均发病率分别为92.33%和88.37%(表3,图1)。

图1 不同土壤改良条件下西瓜幼苗的枯萎病发病情况Fig.1 The Fusarium wilt incidence of watermelon seedlings under different soil improvement conditions
2.4 不同土壤改良处理对土壤细菌多样性和群落结构的影响
由表4 可知,健康土CK 的土壤细菌群落Chao1 指数最高,Fon_B_sub 处理仅次于CK,其次为Fon_T_har 和Fon_FL,Fon_HT 和Fon 处理的Chao1 指数明显降低,且显著低于CK。各处理之间土壤细菌的Shannon 指数和Simpson 指数均以CK 为最高,Fon_HT 最低,但各处理之间的差异均未达到显著水平。

表4 不同土壤改良处理后土壤细菌多样性指数Table 4 The bacterial diversity index of soil under different improvement treatments
对相对丰度前10 位的细菌属水平分析表明,不同土壤改良处理可改变枯萎病胁迫下土壤的细菌群落组成(图2)。相对于CK,Fon 对照主要提高了假单胞菌属(Pseudomonas)(从3.25%升高至6.45%)、Birii41(从3.28%升高至6.34 %)、德沃斯氏菌属(Devosia)(从1.57%升高至2.60%)、芽单 胞 菌 属(Gemmatimonas)(从 1.14% 升 高 至2.66%)、未培养的纤维菌(Fibrobacteraceae;uncultured)(从0.32%升高至3.36%)和未培养的肠杆菌(Enterobacteriaceae;uncultured)(从0.09%升高至2.33%)的丰度;降低了罗尔斯通氏菌属(Ralstonia)(从4.21%降低至0.04%)、纤维弧菌属(Cellvibrio)(从2.45%降低至0.84%)、马杜拉放线菌属(Actinomadura)(从1.32%降低至0.28%)的丰度。Fon_HT处理和Fon_FL 处理相对于Fon 对照均明显提高了罗尔斯通氏菌属(Ralstonia)、纤维弧菌属(Cellvibrio)、马杜拉放线菌属(Actinomadura)的丰度,降低了Birii41、uncultured Microscillaceae、和未培养的肠 杆 菌(Enterobacteriaceae;uncultured)的 丰 度。Fon_B_sub 处理与Fon 对照相比,在细菌属的水平上明显提高了罗尔斯通氏菌属(Ralstonia)、芽单胞菌属(Gemmatimonas)的丰度,降低了假单胞菌属(Pseudomonas)、Birii41、未培养的纤维菌(Fibrobacteraceae;uncultured)、未培养的肠杆菌(Enterobacteriaceae;uncultured)的丰度。Fon_T_har 处理则主要提高了假单胞菌属(Pseudomonas)、罗尔斯通氏菌属(Ralstonia)、未培养的肠杆菌(Enterobacteriaceae;uncultured)的丰度,降低了Birii41、芽单胞菌属(Gemmatimonas)、未培养的纤维菌(Fibrobacteraceae;uncultured)的丰度。综上所述,CK 和4 种改良土壤中的罗尔斯通氏菌属(Ralstonia)丰度均高于Fon 对照,而未培养的纤维菌(Fibrobacteraceae;uncultured)、Birii41和德沃斯氏菌属(Devosia)丰度均低于Fon 对照。

图2 不同土壤改良处理对土壤细菌群落结构的影响Fig.2 The effects of different soil improvement treatments on soil bacterial community structure
通过对细菌功能注释,发现不同处理下土壤中的细菌功能存在明显差别(图3)。CK 中高丰度细菌主要包含甲烷氧化(methanotrophy)、硝化作用(nitrification)、好氧氨氧化(aerobic ammonia oxidation)、碳氢化合物降解(hydrocarbon degradation)和光异养类型(photoheterotrophy)细菌;而Fon 中几丁质分解(chitinolysis)、脂肪族非甲烷烃降解(aliphatic non methane hydrocarbon degradation)、蓝藻类(cyanobacteria)和光合自养(photoautotrophy)细菌的丰度明显高于其他处理。与Fon 处理相比,Fon_FL 处理后纤维素分解(cellulolysis)、甲基营养(methylotrophy)和甲醇氧化(methanol oxidation)细菌丰度提高,Fon_HT 处理后化能异养(chemoheterotrophy)细菌丰度提高,而其他类型细菌丰度均降低,Fon_B_sub 和Fon_T_har 处理下细菌丰度变化不明显。
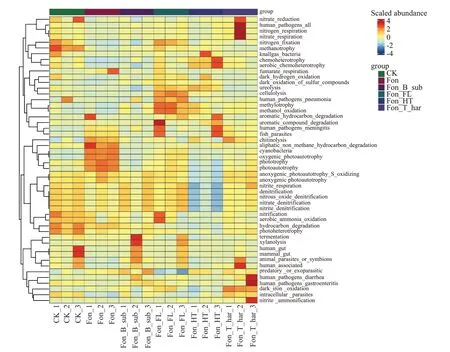
图3 不同土壤改良处理对土壤细菌功能聚类热图Fig.3 Heat map of soil bacterial functional clustering under different soil improvement treatments
2.5 不同土壤改良处理对土壤真菌多样性和群落结构的影响
土壤真菌的ITS 序列分析结果显示,CK 的Chao1、Shannon 和Simpson 指数均为最高,其中CK 的Chao1 指数显著高于其他处理。Fon_T_har、Fon_HT 和Fon_B_sub 处理之间的Chao1、Shannon指数均无显著差异,Fon_HT 与Fon_T_har、Fon_B_sub 处理之间的Simpson 指数无显著差异,但Fon_T_har、Fon_B_sub 处理之间的Simpson 指数差异显著。Fon 和Fon_FL 处理的真菌多样性明显降低,其Chao1 指数显著低于其他处理,且Fon_FL处理的Shannon 和Simpson 指数均为最低(表5)。

表5 不同土壤改良处理土壤真菌多样性指数Table 5 The fungi diversity index of soil under different improvement treatments
不同土壤改良处理可以改变枯萎病胁迫下土壤真菌群落组成(图4)。与CK 相比,Fon 处理在真菌属的水平上明显提高了未培养的真菌(Fungi;uncultured)(从6.50%升高至16.64%)、被孢霉属(Mortierella)(从3.74%升高至21.55%)、镰孢菌属(Fusarium)(从0.44%升高至17.34%)和未培养的子囊菌(Ascomycota;uncultured)(从5.49%升高至8.91%)的丰度;降低了Leucothecium(从19.94%降低至2.61%)、节从孢属(Arthrobotrys)(从1.71%降低至0.18%)、未培养的壶菌(Chytridiomycota;uncultured)(从1.08%降低至0.12%)和Leucocoprinus(从11.47%降低至0.05%)的丰度。Fon_HT 处理与Fon 相比,根囊壶菌属(Rhizophlyctis)、节从孢属(Arthrobotrys)丰度提高,分别为23.77%和17.17%;被孢霉属(Mortierella)、镰孢菌属(Fusarium)丰度明显降低,分别为0.34%和0.32%。Fon_FL 处理中,未培养的真菌(Fungi;uncultured)的丰度要明显高于其他处理,为42.22%;而被孢霉属(Mortierella)、镰孢菌属(Fusarium)丰度明显低于Fon 对照,分别为0.91%和1.22%。Fon_B_sub 处理与Fon 对照相比,大部分菌属的丰度均有不同程度的降低,其中被孢霉属(Mortierella)和未培养的子囊菌(Ascomycota;uncultured)降低幅度最大,分别从21.55%降低至1.61%,从8.91%降低至0.53%,镰孢菌属(Fusarium)的 丰 度 从17.33% 降 低 至4.42% 。Fon_T_har 处理与Fon 对照相比,被孢霉属(Mor-tierella)和Leucothecium的丰度提高;镰孢菌属(Fusarium)丰度降低,从17.33%降低至6.32%。4 种土壤改良措施处理后,镰孢菌属(Fusarium)丰度有不同程度的降低,而尖孢镰孢菌(Fusarium oxysporum)是引起西瓜枯萎病的主要病菌,为镰孢菌属真菌(Fusarium),说明4 种土壤改良措施对西瓜枯萎病防治均有一定效果,镰孢菌属丰度越低,西瓜幼苗发病率也越低。
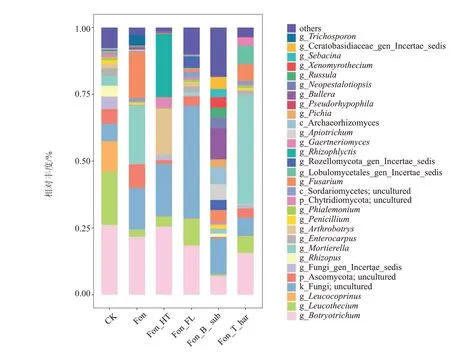
图4 不同土壤改良处理对土壤真菌群落结构的影响Fig.4 The effects of different soil improvement treatments on the soil fungi community structure
通过对真菌功能注释,发现不同土壤处理下的真菌功能存在明显差别(图5)。CK 中优势类群主要包含未定义的腐生菌(Undefined Saprotroph)、内生菌(Endophyte)和动物病原菌(Animal Pathogen);而Fon 对照中优势类群主要为木腐生菌(Wood Saprotroph)和土壤腐生菌(Soil Saprotroph)。与Fon对照相比,Fon_FL 处理后粪腐生物(Dung Saprotroph)、未定义的木腐生物(Undefined Saprotroph-Wood Saprotroph)丰度提高;Fon_HT 处理后动物内共生病原菌(Animal Endosymbiont-Animal Pathogen)和腐生菌(Dung Saprotroph-Soil Saprotroph、Undefined Saprotroph)丰度提高;Fon_T_har处理后腐生(Endophyte-Litter Saprotroph-Soil Saprotroph-Undefined Saprotroph、Dung Saprotroph-Soil Saprotroph)和植物病原体(Plant Pathogen)相关真菌丰度提高;Fon_B_sub 处理下真菌群落变化不明显。

图5不同土壤改良处理下土壤真菌的功能聚类热图Fig.5 Heat map of soil fungal functional clustering under different soil improvement treatments
3 讨论与结论
针对西瓜枯萎病的抗性鉴定方法一直是西瓜育种的一个关键环节,西瓜苗期枯萎病抗性鉴定是其中重要的组成部分,可以及时、快速地了解选育品种的抗性[15]。笔者采用菌土混合接种法,比较了5 种病原菌分生孢子浓度,筛选出了1×105个·mL-1作为菌土法最适宜的接种浓度。此方法将灭菌基质和菌液以5∶1 的体积比混合,直接将萌发一致的种子播种于菌土之中,潜育期10 d 左右,整体试验时间相较于浸根法提早了7~10 d,减少了种子生长至子叶平展期的时间和移栽、缓苗等操作步骤,降低了试验难度。此方法操作简单、用菌量少、结果稳定,且发病方式更接近于自然发病,该浓度的接种鉴定结果与浸根接种法高度吻合,适用于西瓜苗期枯萎病抗性鉴定、西瓜抗枯萎病种质筛选、杀菌剂筛选等试验。
土壤酶活性的高低表征土壤熟化程度,影响着土壤微生物多样性和群落结构组成,是反映土壤肥力的一项重要指标[16]。笔者通过土壤改良,比较高温、淹水、哈茨木霉菌和枯草芽孢杆菌处理后的土壤和未处理土壤的养分含量、土壤酶活性和微生物多样性变化。温度是影响土壤微环境的主要因子之一,高温闷棚是生产上常见的病虫害防治方法[17]。有研究者报道,高温闷棚会引起土壤有机质含量下降,部分土壤酶变性失活[18]。本研究结果表明,高温处理显著降低了西瓜幼苗枯萎病发病率,相较于病土对照显著提高了有效磷和铵态氮含量,这可能与有机质在高温环境下分解有关,与李英梅等[19]研究高温闷棚导致的土壤养分变化结果基本一致。相较于病土对照,高温处理后,土壤中多酚氧化酶、蔗糖酶、纤维素酶和过氧化氢酶活性显著下降,这与李佳川等[20]的研究结果基本一致,大部分酶在高温、高湿、缺氧环境下会发生高温胁迫反应,蛋白质变性导致失活。淹水处理后,西瓜幼苗枯萎病发病率相较于病土对照有一定程度的减轻。淹水处理相较于病土对照,土壤中有效磷、有效钾、铵态氮含量有不同程度的下降,并且各类土壤酶活性均有显著下降,可能与酶蛋白变性和淹水引起的土壤淋溶作用有关,这与周榆淇等[21]在淹水对水稻根际土壤的研究中的结果基本一致。哈茨木霉菌和枯草芽孢杆菌处理后的土壤各项指标的变化基本一致,提高了土壤中的有效磷、有效钾含量,除S-CAT外其余4 种土壤酶活性均有不同程度提高,这与姜永雷等[22]在微生物菌剂对烟草连作影响的研究中的结果相似。
有研究指出,温度上升可以提高土壤中的真菌丰度,促进土壤对菌类中一些酶的利用效率,影响土壤微生物群落结构[23]。在本试验中,高温处理后,相较于病土对照,土壤真菌丰度和多样性明显上升,但是土壤细菌丰度和多样性无明显变化,这与何伟等[24]对辣椒的研究结果基本一致,与戚嘉琦等[25]在草莓中的研究结果不一致,这可能与种植作物种类、温度和持续时间不同有关。此外,高温处理后提高了化能异养(chemoheterotrophy)类型细菌的丰度,这可能与土壤中有机质含量的增加有关。有研究者发现,旱地土壤微生物的多样性会随土壤含水量的增加而增加,淹水处理不仅可以改变土壤养分形态和含量,还可以通过影响土壤养分利用率加大土壤微生物群落结构的差异[26]。淹水处理对改良后土壤微生物多样性有一定影响,提高了土壤细菌的丰度,其中甲基营养(methylotrophy)和甲醇氧化(methanol oxidation)类型细菌丰度明显提高,但是真菌的多样性相较于病土对照明显下降。龚小雅等[27]在淹水对辣椒的影响中同样发现,土壤中细菌和真菌对淹水处理的响应相反,且真菌对水分变化更加敏感。施用微生物菌剂是影响土壤微生物多样性最直接的方式,微生物菌剂还可以有效抑制病原菌生长,增加土壤养分含量[28]。哈茨木霉菌和枯草芽孢杆菌处理后土壤细菌和真菌的丰度、多样性均有所提高,且对真菌的影响要大于细菌,这与杨肖芳等[29]的研究结果一致。但是2 种微生物菌剂对西瓜幼苗枯萎病发病程度均没有明显缓解,其镰孢菌属(Fusarium)丰度下降幅度要低于高温和淹水处理,说明本次试验所用的哈茨木霉菌和枯草芽孢杆菌浓度对1×105个·mL-1分生孢子浓度枯萎病菌胁迫下的西瓜幼苗的发病率影响不大,无法有效缓解枯萎病胁迫。这可能是因为本次试验微生物菌剂浓度过低,也可能是因为本试验均使用单一型微生物菌剂,对缓解枯萎病胁迫的效果要弱于复合型微生物菌剂。
综上所述,高温处理可以有效缓解西瓜枯萎病胁迫,改良土壤微生物群落结构,降低土壤中镰孢菌属等有害菌相对丰度,促进有机质分解,提高土壤养分含量。但高温处理后存在部分土壤酶活性下降、有益菌减少的问题。添加单一的微生物菌剂有利于改善土壤微生态环境,但无法有效防治枯萎病。因此,在实际生产中应结合高温闷棚、添加微生物制剂等多种措施来改善土壤环境。本研究结果可为克服西瓜连作障碍和枯萎病绿色防控提供理论依据。

