麝香草酚破坏小肠结肠炎耶尔森氏菌细胞膜并抑制其生物被膜的形成研究
高 畅, 田 露, 卢家兴, 龚国利
(陕西科技大学 食品科学与工程学院, 陕西 西安 710021)
0 引言
小肠结肠炎耶尔森氏菌(Yersiniaenterocolitica)属于肠杆菌科[1],是一种具有嗜冷特性的食源性病原菌,在自然界中广泛分布,主要通过粪口途径或动物宿主(尤其是猪和羊)在各种食物中传播.可直接引起慢性胃肠炎、小肠结肠炎等各种消化性疾病,也可导致呼吸道、心血管和骨髓结缔等发生病变,甚至引起败血症,最终导致死亡[2].
生物被膜是一种可以通过附着在物体表面的胞外多糖、蛋白质和DNA等细菌分泌的胞外聚合物(Extracellular Polymeric Substances,EPS),用于自我防御的结构.生物被膜可以增强细菌感染的能力,对抗生素的耐药性也随之增加,已经成为食品工业中主要的感染源,除了引起食品腐败外,还会破坏设备、增加能源成本.目前食品工业生产中主要采用物理和化学方法防控Y.enterocolitica的污染(如热灭活、紫外线和臭氧灭活、辐射和冷冻以及酸碱灭活)[3,4],但这对于冷冻生肉等直接入口的食物并不适用.许多天然活性物质已被证明具有广谱的抗菌活性.例如肉桂醛、麝香草酚和卡波诺对伤寒沙门氏菌、铜绿假单胞菌和金黄色葡萄球菌有抗菌作用[5,6].
麝香草酚(2-异丙基-5-甲基苯酚)具有广谱抗菌活性[7],已被美国食品和药物管理局视为公认的安全食品添加剂(21 CFR 182.60).现有的研究表明,麝香草酚能显著抑制大肠杆菌、李斯特菌、铜绿假单胞菌、金黄色葡萄球菌、沙门氏菌等病原菌的生长繁殖[8],但其抑制Y.enterocolitica及其生物被膜的活性和机制却很少被报道.
因此,本文检测了麝香草酚对Y.enterocolitica的最小抑菌浓度(MIC)、最小抑制生物被膜浓度(MBIC)、最小清楚生物被膜浓度(MBEC),并利用荧光法深入研究可能的抑制机制,最后在微观视野下观察细菌的形态结构及对生物被膜的抑制作用.结合以上实验结果,综合评价麝香草酚对Y.enterocolitica及其生物被膜的抑制作用,并为麝香草酚在未来天然抗菌剂中的开发和应用提供参考.
1 材料与方法
1.1 实验材料
1.1.1 主要试剂
麝香草酚[HPLC ≥ 98%]由生工生物工程有限公司提供,溶解在含有2%(v/v)乙醇的磷酸盐缓冲液(PBS)溶液中,在-20 ℃存储备用.本研究中用于缓冲液配置的所有化学品均为分析级.
1.1.2 菌种和培养条件
Y.enterocoliticaBNCC 108930购自苏州北纳菌株保藏中心.将冷冻保存的菌株在胰蛋白酶大豆肉汤(TSB)固体培养基中划线活化,并挑单菌落在100 mL的TSB中37 ℃培养,使细菌生长至对数生长阶段,浓度约为108个菌落形成单位(CFU)/mL.随后6 000 rpm离心10 min,除去上清液并用磷酸盐缓冲液PBS洗涤两次,收集菌体沉淀.
1.2 实验方法
1.2.1 MIC
麝香草酚的MIC通过改良后的肉汤微量稀释法来测定[9].根据1.1.2节的方法收集Y.enterocolitica的菌体沉淀,并用PBS重新悬浮细胞.在96孔板中加入200 μL的菌液和用Mueller-Hinton肉汤稀释麝香草酚,使每孔麝香草酚的最终浓度分别为0.312 5 mg/mL、0.156 25 mg/mL、0.078 mg/mL、0.039 mg/mL、0.019 mg/mL、0.009 75 mg/mL、0.004 87 mg/mL、0.002 43 mg/mL、0 mg/mL,0.1 mg/mL氨苄青霉素作为参考抗生素.37 ℃培养6 h后,加入10 μL微生物活力测定试剂盒-WST的工作液,测定450 nm处吸光度.
1.2.2 生长曲线
在96孔板的每个孔中加入培养后的细菌和麝香草酚,并使每孔麝香草酚的最终浓度分别为1/64 MIC、1/32 MIC、1/16 MIC、1/8 MIC、1/4 MIC、1/2 MIC、MIC和2 MIC,每个浓度设置6组平行,在37 ℃下培养24 h,每小时测定在600 nm处的吸光度.
1.2.3 膜电位
按照Shi等[10]描述的方法并进行一些修改.根据1.1.2中的方法收集细菌,分别使用终浓度为0 MIC、1 MIC、2 MIC的麝香草酚的PBS溶液重悬细菌,37 ℃培养1 h后,取200 μL细胞悬液与1 μM荧光探针双-(1,3-二丁基巴比妥酸)三甲氧醇(DiBAC4(3)混合,转移到黑色96孔板,在37 ℃避光孵育15 min后,在激发和发射波长分别为492 nm和515 nm下测定荧光强度.
1.2.4 胞内ATP浓度
按照Jiang等[11]提出的方法进行了一些修改.根据1.1.2中的方法收集细菌,在使用终浓度为0 MIC、1 MIC、2 MIC的溶解在PBS的麝香草酚重悬细菌,37 ℃培养1 h.随后,加入100 μL的细胞裂解液以使细胞充分裂解,在4 ℃,8 000 rpm下离心5 min,取上清液备用.在黑色96孔板中加入100 μL ATP检测混合液处理10分钟,以消除背景影响,随后加入20 μL的上清液混合后测定荧光.
1.2.5 pHin
按照Shi等[10]的方法测定pHin.为了在样品细胞中嵌入荧光探针,用HEPES缓冲液悬浮细菌,加入3.0 μM的二醋酸羧基荧光素琥珀酰亚胺酯,在37 ℃下处理20 min.随后,用磷酸二氢钾缓冲液清洗加载了荧光探针的细胞,再重新悬浮在10 mL缓冲液中.加入葡萄糖(10 mM),在37 ℃下孵化30 min,以去除未加载的探针,清洗两次后重新悬浮在5 mL试管中,其中含有麝香草酚溶液(0、1 MIC和2 MIC),37 ℃避光孵育1 h,然后分装到黑色的96孔板,检测在激发波长440 nm和490 nm以及发射波长为520 nm时的荧光强度.
扣除无细胞对照组的荧光背景值后,根据激发波长490 nm和440 nm的荧光强度比值,通过含有不同pH值缓冲液的cFDA-SE负载细胞的校准曲线确定与荧光比值对应的pH值.
1.2.6 CLSM观察细胞膜损伤
在本研究中,采用LIVE/DEAD BacLightTM Bacterial Viability Kit,参照Liu等[12]的方法,评估细胞膜损伤的程度.收集的细菌分别用0,1 MIC,2 MIC的麝香草酚处理4 h后,清洗并在8 000 rpm下离心5 min收集细胞,然后重新悬浮在生理盐水中.最后,在每毫升的细胞悬液中加入3 μL的混合染料(SYTO/PI),室温下避光孵育15 min后在激光共聚焦显微镜(CLSM)下观察.
1.2.7 FEGSEM观察菌体形态
场发射扫描电镜(FEGSEM)的样品按照Wang等[13]的描述,稍作修改.收集的细菌用0、1 MIC和2 MIC的麝香草酚处理4小时后,PBS清洗细菌两次后,重悬在2.5%戊二醛中,4 ℃冰箱处理12 h.离心后,分别用30%、50%、70%、80%、90%和100%的乙醇脱水10 min.随后,在-20 ℃下重新悬浮在叔丁醇中处理30 min.真空冷冻干燥后,将样品放在载物台上喷金,使用FEGSEM观察.
1.2.8 MBIC和MBEC
取96孔板,在每孔内加入200 μL培养后的菌液,然后加入溶解在含有2%无水乙醇的TSB中的麝香草酚,使每孔内最终的浓度分别为1、1/2、1/4、1/8、1/16、1/32、1/64和0 MIC,每个浓度设置6组平行.在37 ℃培养48 h后,吸除培养液,用PBS缓缓洗涤3次以除去浮游菌,然后加入200 μL甲醇固定15 min,吸除后再加入200 μL 0.1%的结晶紫染色10 min,吸除结晶紫并用PBS清洗两次除去未与生物被膜结合的结晶紫,最后加入200 μL 33%乙酸,测定在570 nm处吸光度,计算抑制率.
为评价麝香草酚对成熟生物被膜清除的能力,待Y.enterocolitica在96孔中培养48 h以形成生物被膜,PBS洗涤两次,再加入200 μL溶解在含有2%乙醇的PBS中的不同浓度的麝香草酚,使最终药物浓度为2 MIC、1MIC、1/2 MIC、1/4 MIC、1/8 MIC、1/16 MIC、1/32 MIC和0 MIC,每个浓度设置6组平行.在37 ℃下培养12 h,后续处理步骤同上,计算清除率.
1.2.9 光学显微镜观察生物被膜的抑制和清除
取24孔板,向每孔底部放入灭过菌的圆形玻片,加入2 mLY.enterocolitica,再加入麝香草酚,使其终浓度分别为0 MBIC、1 MBIC、2 MBIC,37 ℃培养48 h后用PBS洗涤两次以除去悬浮菌,再加入1 mL结晶紫染色20 min,并用PBS冲洗两次以除去未结合的结晶紫溶液.取出玻片并在光学显微镜下观察生物被膜.
对于清除成熟生物被膜的观察,先使Y.enterocolitica在玻片上生长48 h以形成成熟的生物被膜,随后吸除菌液,加入2 mL含有麝香草酚的PBS溶液,使每孔最终浓度分别为0 MBEC、1 MBEC、2 MBEC,后续处理步骤同上.
1.2.10 统计分析
所有实验一式三份,至少重复两次,以确保数据的可信度.SPSS软件用于数据处理.数据以平均值标准偏差(n=3)表示,各组之间的差异通过学生t检验进行检验.P≤0.01代表差异明显,用**表示.
2 结果与讨论
2.1 麝香草酚对Y.enterocolitica的MIC
使用微生物活力检测试剂盒WST®检测MIC,其中WST®-8可以被脱氢酶还原,生成可以溶于水的甲臜,根据甲臜的生成量与微生物数量成正比的关系,推算微生物数量.结果显示,0.156 25 mg/mL麝香草酚处理组的吸光度与用氨苄青霉素处理的阳性对照组相似,Y.enterocolitica的生长被完全抑制.因此,麝香草酚对Y.enterocolitica的MIC为0.156 25 mg/mL.
2.2 生长曲线
为了进一步确定麝香草酚对Y.enterocolitica的抑制作用,我们构建了生长曲线来评估Y.enterocolitica在1/64 MIC至2 MIC浓度下24 h内的生长情况(图1).结果显示,1 MIC和2 MIC的麝香草酚在24 h内完全抑制了Y.enterocolitica的生长.此外,与对照组相比,1/4 MIC麝香草酚处理后,Y.enterocolitica的生长速度下降,Y.enterocolitica的滞后期从2 h延长到4 h,24 h的总细菌含量减少到约3/5.类似的,当Y.enterocolitica暴露在浓度为1/2 MIC的麝香草酚中时,其生长速度进一步下降,细菌总数量减少到对照组的2/5.而1/8 MIC和1/16 MIC的抑制作用不明显.

图1 Y.enterocolitica在不同浓度麝香草酚下的生长曲线
2.3 细胞膜呈现去极化
细胞膜内外离子梯度保持的电位差称为膜电位.当细胞膜受到物理或化学作用的破坏时,膜内外的电位差会增加或减少,分别称为超极化和去极化.对膜电位变化的测量可用于评估细胞的完整性和代谢活动.本文采用DiBAC4(3)来研究Y.enterocolitica的膜电位变化.正常膜电位的细胞会排斥氧酚,发出微弱的荧光,如果膜电位丧失,染料进入细胞并与富含脂肪的细胞内成分结合,从而导致荧光增强.
结果显示,未经处理的Y.enterocolitica细胞只显示微弱的荧光,而用麝香草酚处理的细胞的荧光强度显著增加,表明细胞膜内外的电位差下降,Y.enterocolitica细胞膜出现了去极化,细胞膜的完整性受到了破坏(图2).2 MIC处理组的荧光强度进一步增强,细胞膜去极化程度明显升高.膜电位的变化主要是由于麝香草酚引起的pH值和离子运输的改变.类似的,帕霉素、麝香草酚和香芹酚也会导致金黄色葡萄球菌和大肠杆菌的膜电位出现去极化[14].

图2 麝香草酚对Y.enterocolitica膜电位影响
2.4 降低胞内ATP浓度
ATP是细胞内主要的能量分子,ATP的减少会导致能量供应不足,进一步影响质子转运使之无法维持正常的膜电位.在这项研究使用的ATP检测试剂盒是根据荧光素酶催化荧光素从而产生荧光的原理,因为这个过程需要ATP提供能量,所以在一定的范围内,荧光强度与ATP的浓度成正比(图3).
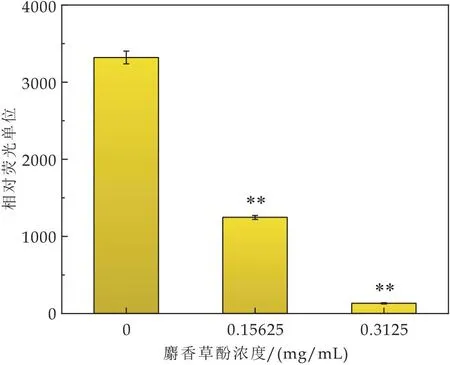
图3 麝香草酚对Y.enterocolitica胞内ATP的影响
结果显示,1 MIC和2 MIC处理组的荧光强度明显低于对照组(P≤0.01),1 MIC和2 MIC处理组之间也有明显的差异(P≤0.01).与未处理组相比,1 MIC的麝香草酚在1 h内使Y.enterocolitica的细胞内ATP减少到1/3左右,而2 MIC的麝香草酚在1 h内基本耗尽了Y.enterocolitica的细胞内ATP.这可能是因为改变了细胞膜的通透性,从而导致ATP泄漏.此外,质子泵水解ATP的速度升高,导致ATP快速耗竭,细胞内ATP合成速度的降低等也可能是胞内ATP下降的原因.Ultee等[15]发现,2 mmol/L的香芹酚在7 min内使蜡样芽孢杆菌细胞内ATP降为0,猜测香芹酚可以加速细胞内ATP的消耗而导致能量短缺.
2.5 降低pHin
pHin是细胞膜受损的一个重要指标,一个完整的细胞屏障可以维持细胞代谢的适当pH值.pHin的变化意味着细胞膜上的离子通道出现异常,不能维持正常的pH梯度.pHin的异常会影响细胞内酶的活性和代谢途径,可能导致ATP合成受阻和膜转运蛋白异常.本文采用cFDA-SE荧光探针技术来检测pHin.cFDA-SE是一个亲脂性分子,在细胞外只表现出微弱的荧光.被运入细胞后,乙酰基团被酯酶裂解,可以激发出较强的荧光[16].这种荧光探针具有较好的准确性和敏感性,在单一激发波长下显示双发射峰,两者的比率与pH值有关,所以经常被用来指示细胞内的pH值.
结果显示,未处理组490/440 nm的比值为(3.18±0.03),而1 MIC的比值降至(1.51±0.04),2 MIC处理组的比值进一步降至(1.16±0.07).因此,Y.enterocolitica的初始pHi为6.77±0.03.1 MIC和2 MIC的麝香草酚分别使Y.enterocolitica的pH从6.77±0.03降至4.72±0.04和4.3±0.07(图4).

图4 麝香草酚对Y.enterocolitica pH的影响
完整的细胞膜通过离子通道维持pH梯度,而麝香草酚处理后膜上的离子通道受到干扰并关闭,细胞内pH值的降低,这意味着细胞内积累了大量的氢离子,从而导致质子运输失败.类似的,Qian等[17]发现,香草酸能显著下调梭状芽孢杆菌的细胞内pH值,从而起到抑制作用.
2.6 破坏细胞膜完整性
对膜电位、细胞内ATP浓度、pH值的检测证明,细胞的功能障碍与细胞膜的损伤有间接关系.本文使用LIVE/DEAD®BacLightTM Kit确定细胞膜的完整性,其中SYTO 9能够自由穿过任何细胞膜,激发出绿色荧光,而PI只能通过与细胞膜受损的细胞内核酸结合发出红光[18],所以正常的细胞在CLSM下呈现明亮的绿色荧光,而在膜损伤的细胞中显示红色荧光.因此CLSM可以直接观察到不同浓度的麝香草酚对Y.enterocolitica细胞膜造成的损伤.
结果表明,对照组的细胞在补充了2%无水乙醇的PBS溶液中培养后几乎是绿色的(图5(a)),表明细胞膜完整.然而,在1 MIC处理组中,视野中绿色荧光的比例显著减少,而红色荧光增加(图5 (b)).2 MIC的处理组中,在相同的初始细菌数量和培养条件下,视野中的细菌数量明显减少,且均呈红色荧光(图5 (c)).说明1 MIC的麝香草酚破坏了大部分细菌的细胞膜.随着麝香草酚浓度的增加,受损细胞的百分比和受损程度也随之升高.2 MIC的麝香草酚能显著减少Y.enterocolitica的数量,表明有潜在的致死作用.柠檬醛处理后阪崎肠杆菌的细胞形态结构和细胞膜完整性的也发生了类似变化[19].

图5 激光共聚焦显微镜观察麝香草酚对Y.enterocolitica的影响
2.7 菌体形态被严重破坏
使用CLSM间接表征用麝香草酚处理的细胞膜的损伤程度后,进一步使用FEGSEM直观地观察细菌的形态变化.结果显示,对照组的细菌形态表现出完整且光滑的棒状,长度约为1~1.5 cm,呈现单细胞或两个细胞头尾相连的整体形状(图6 (a)).与对照组相比,1 MIC处理组的细菌形态出现了明显的收缩和变形,Y.enterocolitica原有的棒状形态几乎无法识别(图6 (b)).暴露于2MIC麝香草酚的Y.enterocolitica出现坍塌,长度明显缩小,甚至失去了杆状形态(图6 (c)).
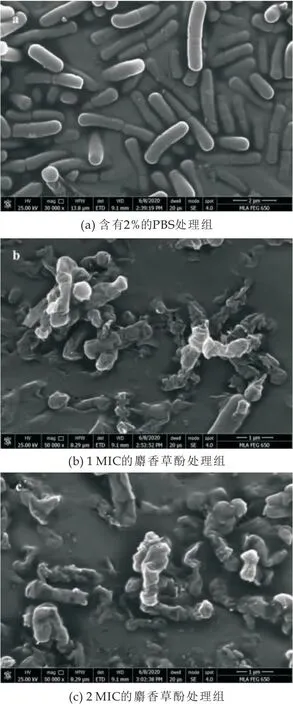
图6 场发射扫描电镜观察麝香草酚对Y.enterocolitica的影响
2.8 麝香草酚对Y.enterocolitica的MBIC和MBEC
为研究麝香草酚对Y.enterocolitica生物被膜的影响,使用结晶紫染色法测定生物膜形成量.结果表明,未经处理的对照组Y.enterocolitica生物被膜生长良好,1/32 MIC和1/16 MIC的麝香草酚对生物被膜形成的抑制率可以分别达到49.72%和55.69%,而1 MIC的生物被膜形成的抑制率达到了68.9%(图7).对生物被膜形成的抑制作用,在每个实验组均显著,这表明麝香草酚是效果良好的生物被膜抑制剂.结合生长曲线的实验结果,1/16 MIC的麝香草酚不抑制浮游菌的生长,但可以明显抑制生物被膜的形成,说明麝香草酚并不是通过抑制悬浮菌的生长而起到对生物被膜形成的抑制作用,因此选择1/16 MIC为MBIC.

图7 麝香草酚对Y.enterocolitica生物被膜的抑制率
麝香草酚对成熟生物被膜的清除能力显示,1/2 MIC的麝香草酚对Y.enterocolitica生物被膜的清除率超过52%,清除率与药物浓度呈正相关,1 MIC和2 MIC对生物被膜的清除率分别是54.98%和64.14%(图8).因此选择1 MIC为MBEC.

图8 麝香草酚对Y.enterocolitica生物被膜的清除率
2.9 麝香草酚抑制并清除Y.enterocolitica的生物被膜
使用结晶紫染色法在光学显微镜下观察生物被膜的形成情况.结果显示,未经处理的样品可以看到,有大量的细胞聚集物粘附在细胞爬片表面,菌体之间相互交错,连接较为致密,形成有一定厚度的生物被膜.而经麝香草酚处理后的细胞爬片只能观察到少量并分散的细菌黏附,2 MBIC的药物浓度下很少看到细胞聚集,形成疏松多孔的生物被膜(图9).这些结果表明,麝香草酚以剂量依赖性的方式减少细胞爬片上的细胞黏附,从而抑制生物被膜的形成.对于成熟生物被膜的清除作用可以发现,经过1 MIC麝香草酚的处理,仍留在细胞爬片上的生物被膜含量明显降低(图10),这表明麝香草酚具有清除成熟生物被膜的能力.
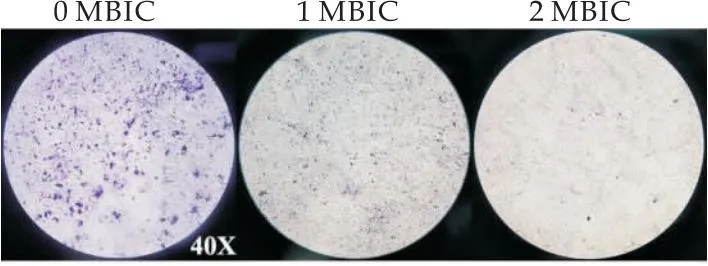
图9 光学显微镜观察麝香草酚对Y.enterocolitica生物被膜的抑制作用

图10 光学显微镜观察麝香草酚对Y.enterocolitica生物被膜的清除作用
3 结论
本研究验证了麝香草酚对Y.enterocolitica及其生物被膜的抑制作用,表现为低浓度时滞后期延长,高浓度时Y.enterocolitica的生长和分裂受到抑制.麝香草酚破坏了Y.enterocolitica细胞膜的完整性,并导致其代谢功能紊乱,这主要表现在细胞内ATP减少、细胞膜去极化和胞内pH值下降.此外,1/16 MIC的麝香草酚还可以抑制Y.enterocolitica生物被膜的形成.这些结果表明麝香草酚可以作为一种潜在高效的天然防腐剂、抗菌饲料、食品添加剂和抗生素替代品来减少食源性致病菌的污染.

