基于网络药理学与分子对接的当归黄芪超滤物改善冠状动脉微血管疾病作用机制
严春艳, 蒋虎刚,2, 王新强, 刘 凯,2, 李应东,2,, 赵信科,2,*
(1.甘肃中医药大学 中西医结合学院, 甘肃 兰州 730000; 2.甘肃省中医药防治慢性疾病重点实验室, 甘肃 兰州 730000; 3.甘肃中医药大学附属医院 心血管临床医学中心, 甘肃 兰州 730099)
0 引言
冠状动脉微血管疾病(Coronary Microvascular Dysfunction,CMVD)是一种临床综合征,由多种致病因素刺激,导致冠状前小动脉和小动脉的结构和(或)功能发生异常变化,患者出现劳力性心绞痛或具有心肌缺血客观证据[1].CMVD在梗阻性和非梗阻性冠状动脉综合征以及心肌疾病,包括射血分数保留性心衰的发病机制中发挥作用[2].尽管在诊断及治疗方面取得了一定进展,然而CMVD的发生机制较复杂,在临床实践中经常被忽略,目前尚未有治疗CMVD的针对性药物,因此研究CMVD的发病机制,对研究新药和其他治疗该病的方法具有重要意义.如何有效治疗并延缓其进展也是全世界关注的热点问题.
中医对CMVD的治疗多用益气活血的单味药或复方中药制剂,且进行了大量的药理学研究,复方丹参滴丸、麝香保心丸、通心络等益气活血方具有改善微循环的疗效[3].当归黄芪超滤物(Radix Angelica Sinensis and Astragalus mongholicus extract,RAS-AM)是课题组在气血理论的基础上依据《内外伤辨惑论·暑伤胃气论》中的当归补血汤配伍比例制备而成(黄芪5:当归1),具有益气活血兼补血之功效[4].药理学发现,当归、黄芪富含当归多糖、Z-藁本内酯、E-藁本内酯、正丁基苯酞、当归酸酯、花椒毒素和槲皮素、黄芪多糖、黄芪甲苷、黄芪总碱多种成分[5-7]对炎症反应和缺血缺氧造成的内皮细胞损伤具有良好疗效.
网络药理学是通过构建药物-成分-靶点网络,来分析化合物与疾病之间的关系,属于研究疾病机制与药物作用机制的新学科,它的研究方法具有探索中药的多成分、多通路、多靶点调控通路治疗疾病的优势[8].因此,本研究旨在利用网络药理学和分子对接的药物空间结构理论来探讨RAS-AM的有效活性成分、核心靶点,明确揭示其改善CMVD的作用机制,以便为进行体内和体外实验研究提供一定的理论依据.
1 材料与方法
1.1 查询与预测RAS-RM相关靶点
检索中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php),条件是口服生物利用度(Oral bioavailability,OB)≥15%及类药性(Drug-likeness,DL)≥0.15筛选活性成分.使用PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库、Swiss Target Prediction(http://www.swisstargetprediction.ch/)数据库检索药物靶点,通过CNKI(https://www.cnki.net/)和PubMed(https://pubmed.ncbi.nlm.nih.gov/)补充靶点;通过Uniprot(https://www.uniprot.org/)数据库校正.
1.2 CMVD靶点获取
以“Coronary Microvascular Dysfunction”为检索词,在GeneCards(https://www.genecards.org/)、DisGeNET(https://www.disgenet.org/home/)和OMIM(https://omim.org/)数据库获取疾病靶点.
1.3 RAS-AM改善CMVD的潜在靶点
利用Venny 2.1平台(https://bioinfogp.cnb.csic.es/tools/venny/)获取交集靶点,绘制交叉基因韦恩图,即RAS-AM改善CMVD的潜在作用靶点.
1.4 PPI网络构建及可视化分析
为进一步分析RAS-AM改善CMVD潜在作用靶点的功能和作用机制,将交集靶点上传至STRING数据库(https://cn.string-db.org/)进行PPI网络分析.使用Cytoscape 3.9.1软件中cluster.viz插件对PPI网络作聚类分析,获取MCODE,计算Degree,得到连接度更高的亚网络提取关键靶点.
1.5 “药物-活性成分-作用靶点”网络构建
使用Cytoscape 3.9.1软件建立网络.采用Network Analyzer插件可视化分析网络,得到节点(Nodes)、度值(Degree)等,用Degree值排序网络中节点,筛选核心成分.
1.6 KEGG通路富集及GO功能分析
运用Metascape平台(https://metascape.org/)对交集靶点进行GO功能及 KEGG 通路富集分析,将物种设置为“Homo sapiens”,选择自定义分析( Custom Analysis) ,设定最小计数为3,P值为0.01,最小富集因子为1.5.GO功能分析主要包括生物过程(Biological Process,BP)、细胞组分(Cell Component,CC)和分子功能(Molecular Function,MF).运用微生信平台(http://www.bioinformatics.com.cn/)绘制富集分析柱状图和气泡图,分析RAS-RH改善CMVD的途径.
1.7 分子对接
选择核心活性成分、靶点做分子对接.分别从Pubchem数据库和RCSB PDB数据库(http://www.rcsb.org/)获取活性成分和关键靶点的三维结构,通过PyMOL 2.4.0软件去除溶剂分子与配体,利用AutoDockTools 1.5.6软件进行加氢、加电子等操作.核心活性成分依次与靶点进行分子对接.
2 结果与讨论
2.1 活性成分及靶点获取
通过TCMSP、SwissADME数据库检索筛选,得到22个活性成分,包括当归3个,黄芪19个,如表1所示.通过Swiss TargetPrediction筛选出当归对应靶点78个,黄芪对应靶点1 108个,合并共1 185个靶点,去除重复项后,得到RAS-AM 437个作用靶点.药物靶点共462个点,1 204条边,如图1所示.

图1 药物-成分-靶点网络

表1 RAS-AM-活性成分信息
2.2 疾病靶点获取
从GeneCards、DisGeNET和OMIM 3个数据库共获取CMVD相关靶点1 806个,其中GeneCards数据库1 792个、DisGeNET数据库14个、OMIM数据库569个,共2 375个靶点,去除重复基因后,得到2 307个靶点.
2.3 RAS-AM治疗CMVD的潜在作用靶点
将RAS-AM作用靶点与CMVD疾病靶点通过Venny平台进行匹配,绘制韦恩图,如图2所示,获取交集靶点217个.
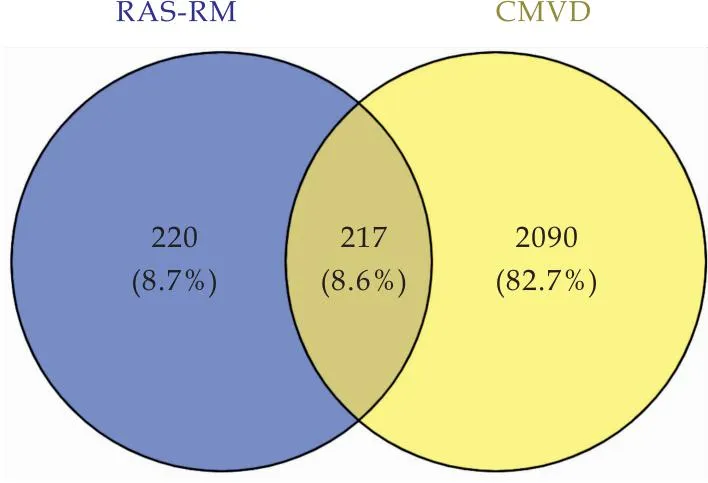
图2 RAS-AM与CMVD的韦恩图
2.4 PPI网络构建
将217个交集靶点导入STRING数据库进行PPI分析,该网络有节点217个、边1 125条、平均节点度值为10.4、平均介数为0.472.利用Cytoscape 3.9.1软件可视化分析,得到Degree值,去除单个无连接的点,共有节点201个,边2 248条,边之间越密集表示各蛋白之间的相互作用越强.使用cluster.viz插件进行聚类分析,得到更高的亚网络,关键靶点61个,如表2所示.该网络共有节点61个,边970条,关键靶点里含有得到IL-1β、NLRP3、CASP1,提示上述基因可能是RAS-AM治疗CMVD的潜在核心靶点,如图3所示.
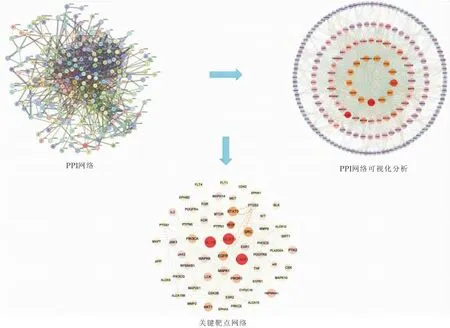
图3 PPI网络

表2 关键靶点
2.5 “药物-活性成分-交集靶点”网络构建
利用Cytoscape 3.9.1软件构建网络,借助Network Analyzer插件分析活性成分的Degree.粉色代表药物,绿色代表活性成分(菱形大小代表Degree的大小),蓝色代表靶点,主要成分为β-谷甾醇(beta-sitosterol)、槲皮素(quercetin)、黄芪甲苷(AstragalosideⅣ)等.该网络共有241个节点和643条边,其中包括2个药物,22个活性成分、217个交集靶点,边代表药物、活性成分与靶点间的相互作用关系,连线越多,则代表活性成分作用CMVD的靶点越多,如图4所示.

图4 RAS-AM-活性成分-交集靶点网络
2.6 KEGG信号通路及GO功能富集分析
运用Metascape平台进行KEGG富集分析,共筛选得到272条信号通路,涉及的关键通路包括癌症信号通路(Pathways in cancer)、NOD样受体信号通路(NOD-like receptor signaling pathway)、NF-kappa B信号通路(NF-kappa B signaling pathway)等,结果如图5所示.在气泡图中,每个圆点的大小反映了目标通路中的靶基因数,而富集度则表示该通路中所有被注释基因中的靶基因数量比率.P值越小圆点颜色越红,表示KEGG富集程度越高.
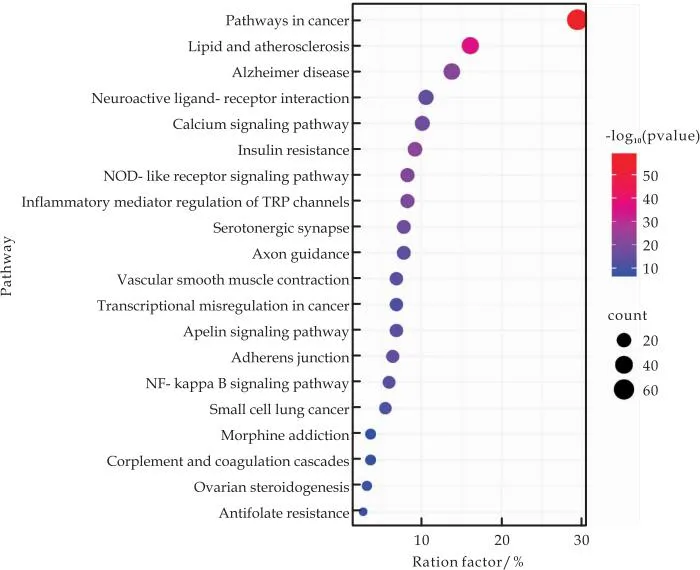
图5 KEGG通路富集分析气泡图
进行GO功能富集分析后,得到了7 461个GO条目,其中包括5 865个生物过程(BP)条目,516个细胞组分(CC)条目,以及1 080个分子功能(MF)条目,如图6所示.BP主要集中在蛋白质磷酸化(protein phosphorylation)、MAPK级联调控(regulation of MAPK cascade)、细胞因子产生的正向调节(positive regulation of cytokine production cell activation)等生物过程;CC主要涉及膜筏(membrane raft)、细胞质核周区(perinuclear region of cytoplasm)、细胞的顶端部分(apical part of cell)等部位;MF主要涉及蛋白激酶活性(protein kinase activity)、蛋白丝氨酸/苏氨酸/酪氨酸激酶活性(protein serine/threonine/tyrosine kinase activity)等方面.上述结果提示了RAS-AM可能通过多途径、多通路发挥改善CMVD作用.

图6 GO功能富集分析图
2.7 分子对接验证
通过GO功能和KEGG分析发现共同靶点参与了多个通路及生物学过程,其中KEGG结果显示关键靶点汇集在NOD样受体通路、NF-kappa B等信号通路.参与这些信号通路且度值较大的核心靶点有NLRP3、IL-1Β(IL-1β)、CASP1,并与活性成分β-谷甾醇、黄芪甲苷、槲皮素进行分子对接,以验证预测结果的准确性.结果显示,所有对接结果的最小结合能均<-5.0 kJ·mol-1,表明分子对接良好,如表3和图7所示.

图7 分子对接

表3 活性成分与靶点分子对接结果
细胞焦亡(pyroptosis)主要是天冬氨酸特异性蛋白酶家族(Caspase)炎性蛋白酶1介导的细胞死亡方式[9].NLRP3作为NOD样受体家族的成员之一,当其被激活后,通过特殊接头蛋白结合在pro-Caspase-1后活化成Caspase-1,并且促进成熟的白细胞介素-1β(Interleukin-1β,IL-1β)和白细胞介素-18(Iinterleukin-18,IL-18)形成,同时GSDMD在细胞膜上打孔,大量炎症因子从孔道释放,扩大炎症反应,介导细胞焦亡发生,最终引发血管内皮损伤导致微循环障碍[10].核转录因子-κB(nuclear transcription factor,NF-κB)作为关键性转录因子,主要参与调节大多数细胞的生物代谢过程,涉及炎症反应、细胞增殖和存活等[11].NF-κB是NLRP3炎症小体激活的上游信号蛋白,如ROS/NF-κB/NLRP3、HMGB1/NF-κB/NLRP3等通路,均说明NF-κB可参与调节NLRP3的激活途径[12,13].益气活血的单味药或复方中药制剂多用于治疗CMVD,当归-黄芪作为益气活血的经典药对,是中医治疗心系疾病中药复方中的重要组成药物.益气活血通络方可通过调节AMPK/SIRT1/NF-κBp65通路,下调IL-1β、IL-6表达,发挥抗炎作用,减轻血管内皮损伤,改善微循环障碍[14];黄芪甲苷可通过抑制MAPK信号通路蛋白表达,减少心衰模型大鼠心肌炎性因子表达,改善心肌细胞凋亡,提高心脏功能[15].槲皮素通过降低galectin-3水平,减少NLRP3炎症小体和IL-1β等下游信号蛋白因子的分泌,显著减轻AS病变[16].槲皮素可通过调节AKT1-eNOS-MMP9通路抗心肌细胞凋亡[17].在内皮功能紊乱方面,当归补血汤可能通过调控NLRP3/ASC/caspase-1、PI3K-Akt、AGE-RAGE信号通路减少炎症因子分泌,发挥抗炎作用[18].本研究分子对接实验表明槲皮素与IL-1β结合能最低为-8.4 kJ·mol-1,且NLRP3与β-谷甾醇、槲皮素的结合能为-5.6 kJ·mol-1、-8.3 kJ·mol-1,CASP1与β-谷甾醇、黄芪甲苷的结合能分别为-5.5 kJ·mol-1、-7 kJ·mol-1,表明这些活性成分与靶点的亲和力更强,可能是RAS-AM治疗CMVD的关键成分,预测RAS-AM可通过抑制NLRP3等靶点的表达,参与NOD样受体信号通路,调控细胞焦亡,改善CMVD.
3 结论
CMVD的发病机制较复杂,其中内皮细胞功能障碍对CMVD的发病机制较为重要.本研究采用网络药理学和分子对接的方法初步揭示了RAS-AM通过调控细胞焦亡治疗CMVD的作用机制,并进行了分子对接验证,为下一步研究提供了理论依据.结果表明,当归黄芪超滤物中的槲皮素、黄芪甲苷、β-谷甾醇可能作用NLRP3等靶点调控细胞焦亡来改善CMVD,为 后 续 的体内外实验研究验证及临床治疗提供了思路及理论依据.本研究仍具有一定局限性,第一,检索数据库较少,可能靶点收集不全面;第二,分子对接预测的蛋白和靶点较少,未将NF-κB作为关键靶点进行分子对接验证,未探讨其上游信号通路的机制,不能说明NF-κB参与了CMVD的发生过程,需要进一步的基础及临床实验验证.

