基于肠道菌群探讨运动改善2型糖尿病的可能机制①
杨 琼 戴 霞 徐丹青 黎学颖 (广西医科大学第一附属医院,南宁 530021)
近年来,全球糖尿病发病率呈持续上升趋势。报告显示,2019 年糖尿病患病率高达9.3%,患病人数上升至4.63 亿,2 型糖尿病(type 2 diabetes mellitus,T2DM)约占所有糖尿病的90%[1]。T2DM 是由遗传和环境因素共同作用的一种以高血糖为主要特征的代谢性疾病,胰岛素抵抗和胰岛素分泌不足是其主要的病理生理机制[2]。随着各项高通量微生物研究技术的研发与应用,许多研究认为肠道菌群失调及其代谢产物可能是导致T2DM 发展的潜在环境因素,并将其作为重要的干预靶点[3-4]。人体肠道菌群由多种因素调节,如遗传、饮食因素[5]。进一步研究发现,运动可通过对肠道菌群产生积极影响促进宿主健康,但其确切机制尚未明确[6-7]。鉴于此,以肠道菌群为靶点的运动干预很可能成为改善T2DM 生物学机制研究的新方向。本文旨在综述运动调节肠道菌群对T2DM的改善作用,为防治T2DM提供研究思路。
1 肠道菌群概述
机体肠道菌群的建立始于婴儿出生时,受母体、分娩方式、环境及饮食因素影响,肠道菌群一直处于动态的、非稳定的变化过程[8]。直到2~3 岁才形成类似于成人的肠道菌群结构并趋于稳定,据估计,人体肠内微生物数量超过1×1014个/ml,约为机体自身细胞数量的10 倍[9]。现已发现人体肠道内的定植菌可分为9个菌门,包括厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形杆菌(Proteobacteria)、放线菌门(Actinobacteria)、梭杆菌门(Fusobacteria)、疣状球菌门(Verrucomicrobia)等,厚壁菌门和拟杆菌门为优势菌群,二者占比高达90%[10]。正常情况下,肠道菌群与人体、外界环境三者间形成互利共生关系以维持动态平衡状态,一方面参与机体营养物质的消化吸收,如维生素、必需氨基酸的合成;另一方面可调节免疫功能,防御致病菌及条件致病菌侵入肠黏膜,保持机体内环境的相对稳定,对维持人体健康具有重要作用[11]。
2 肠道菌群与T2DM
大量研究强调了肠道菌群组成在诱发T2DM 中的重要性。与正常饮食相比,高脂饮食可降低小鼠肠道菌群多样性,厚壁菌门/拟杆菌门比例下降与肥胖、胰岛素抵抗风险有关[12]。相同基因型或饮食类型的小鼠存在不同的葡萄糖代谢情况,其代谢和免疫特征主要取决于肠道微生物的多样性和组成,与饮食类型无关[13-14]。研究发现,与健康人群相比,新诊断的T2DM 患者粪便中的乳酸杆菌计数较高,而球状梭菌和柔嫩梭菌计数较低。乳酸杆菌与糖化血红蛋白呈正相关,而球状梭菌、柔嫩梭菌与糖尿病参数呈负相关[15]。MOCANU 等[16]证实,采用粪菌移植结合低发酵性纤维治疗可重塑肠道微生物组成,有效改善肥胖和代谢综合征患者的胰岛素敏感性。有研究提出,合生元结合运动治疗可能对改善肠道菌群失调起到协同加强作用,提高胰岛素敏感性,未来的研究应关注这种可能性[17]。因此,肠道菌群失调与T2DM 相关,通过有效治疗手段重塑肠道菌群组成可能成为防治T2DM的新方向。
3 运动对T2DM肠道菌群的影响
运动可减少脂质沉积,调节能量代谢,是公认的促进健康的最佳手段之一。运动对肠道菌群的调节具有良性刺激作用,不同的运动方式、强度及持续时间对肠道菌群的影响有所差异,近年来关于运动对T2DM 肠道微生物结构影响的研究结果详见表1。
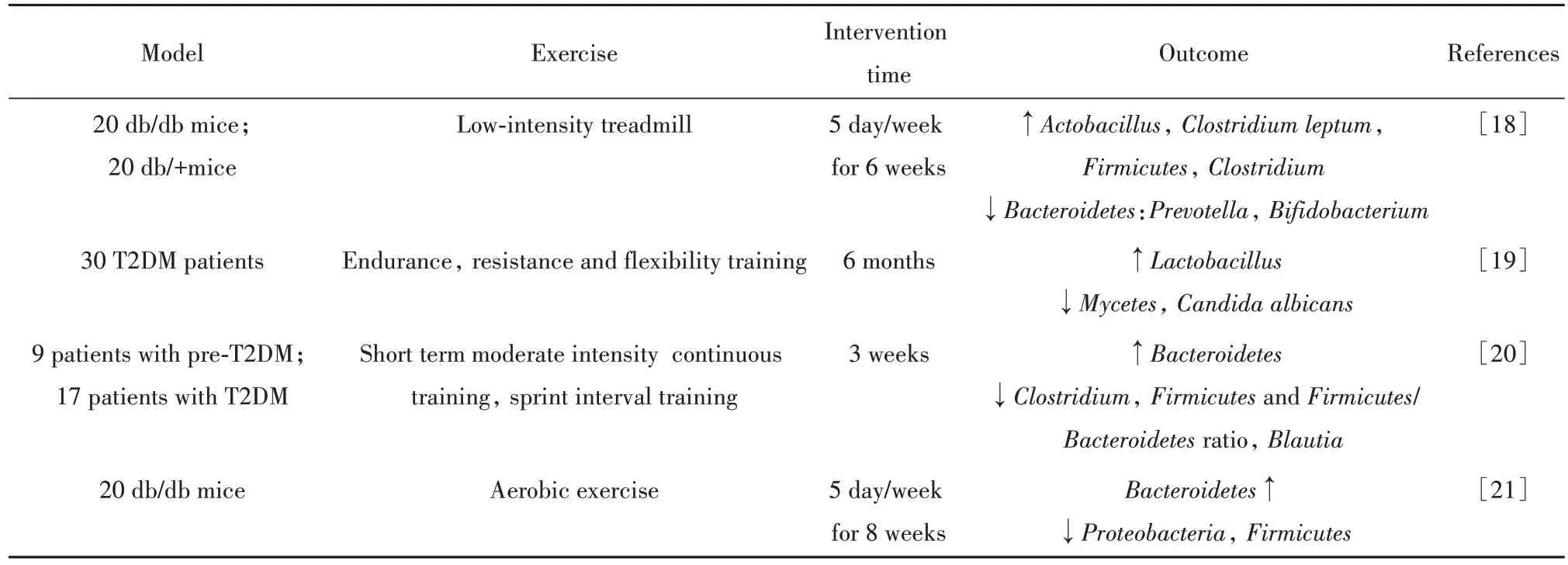
表1 运动对T2DM肠道菌群结构的影响Tab.1 Effects of exercise on gut microbiota in T2DM
4 运动调节肠道菌群改善T2DM 的可能机制
目前仍缺乏运动对T2DM 特定菌群种类改变的相关研究,证据表明,产丁酸盐细菌减少和致病菌增加可导致肠黏膜屏障破坏,触发炎症反应;与氧化应激有关的微生物基因表达增加,胰岛素敏感性降低[22-23]。此外,菌群代谢产物也参与糖代谢紊乱中涉及的内毒素血症、胰岛细胞功能障碍等相关机制[24]。研究发现,移植运动训练后T2DM 患者粪便菌群可有效改善肥胖小鼠的胰岛素抵抗[25]。运动是否可以独立影响肠道菌群尚未阐明,尽管多项实验结果存在差异,但不能排除运动通过调节肠道菌群改善T2DM进展的潜力。
4.1 改善能量代谢
4.1.1 短链脂肪酸(short-chain fatty acid,SCFA)代谢途径 SCFAs是肠道菌群酵解纤维的主要代谢终产物,包括乙酸、丙酸和丁酸,补充SCFAs 可调节能量代谢,改善胰岛素敏感性。运动可以提高梭状芽孢杆菌科、乳杆菌科等产丁酸盐类菌群的丰度,提示运动对T2DM 的影响可能是通过调节菌群代谢产物改善血糖[9]。G 蛋白偶联受体GPR41和GPR43是特异性SCFAs 受体,GPR41/43可诱导肠道内分泌细胞合成分泌胰高血糖素样肽1(GLP-1)和胃肠多肽酪肽(PYY),使宿主产生饱腹感,促胰岛素分泌[26];HAN 等[27]发现SCFAs 可通过激活GPR41 增加3T3-L1 脂肪细胞和C2C12 肌细胞对葡萄糖的摄取;腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是细胞能量代谢的重要调节剂,SCFAs 可激活 骨 骼 肌 中AMPK-PGC-1α 通 路,上 调PGC-1α mRNA及蛋白表达,促进线粒体生物合成,增强葡萄糖的摄取和脂肪酸氧化作用[28]。
4.1.2 支 链 氨 基 酸(branched-chain amino acid,BCAA)代谢途径 BCAAs 为人体必需的氨基酸,主要从饮食中获得,并由肠道菌群代谢产生,Prevotella copri和Bacteroides vulgatus可促进BCAAs 的生物合成,增加BCAAs 摄入会促进T2DM 发展[29-30]。研究发现,BCAAs 合成酶和转运蛋白基因在T2DM 患者中聚集[31]。BCAAs 诱导胰岛素抵抗的机制与PI3KAKT-mTOR 信号通路有关[32]。此外,运动诱导的BCAAs 减少归因于Prevotella copri复制速率降低速度和促进参与BCAAs 降解的基因共同作用,进而改善胰岛素抵抗[25]。因此,BCAA 可能是运动调节肠道菌群改善糖代谢的重要途径之一,但运动调节T2DM 有关的特定氨基酸种类,以及如何通过此途径改善胰岛素抵抗等过程仍有待进一步探究。
4.1.3 胆汁酸(bile acids,BAs)代谢途径 BAs 以胆固醇为原料在肝脏中合成,肠道菌群可通过酶促反应参与BAs 的化学修饰,包括去结合、转运和7α-脱羟[33]。MERCER 等[34]发现,小鼠进行4 周的自由轮转运动可促进BAs 分泌,提高粪便BAs 水平。肠道菌群合成的BAs 可介导两种受体信号分子途径,包括法尼酯衍生物X受体(FXR)和G蛋白耦联受体5(TGR-5)。FXR 可激活成纤维细胞生长因子FGF15或FGF19,改善肝糖和胰岛素敏感性;诱导GLP-1分泌,调节糖代谢[35-36];FXR 可增加PGC-1α 表达,进而活化过氧化物酶体增殖物激活受体-α(PPAR-α)表达,促进脂肪酸代谢[35]。此外,BAs可诱导TGR-5激活cAMP,促进2 型碘代甲状腺素脱碘酶(DIO2)表达,DIO2可将四碘甲状腺原氨酸转化为三碘甲状腺原氨酸,增加脂肪消耗,间接降低血糖[37];体外研究发现,BAs 还可激活胰岛β 细胞TGR-5 以促进胰岛素的合成与分泌[38]。
4.2 改善低度慢性炎症反应 研究发现,运动可以改变肠道菌群,减轻肠道渗漏,改善内毒素症,提示运动可能存在另一种抗炎作用[19]。炎症因子的产生依靠模式识别受体(pattern recognition receptor,PRRs)调控,包括Toll 样受体(Toll-like receptors,TLRs)和NOD 样受体(NOD-like receptors,NLRs),PRRs 可特异性识别病原体相关分子模式(pathogen associated molecular patterns,PAMPs)。革 兰阴 性(G-)菌表面的脂多糖(LPS)是常见的PAMPs,较低水平的LPS 不会引发严重感染,但可使机体呈现持续的低度炎症状态,引发代谢性内毒素血症,导致胰岛细胞损伤[6]。
4.2.1 修复肠道黏膜屏障 肠黏膜损伤的主要特征是肠黏膜通透性增加和上皮细胞间紧密连接蛋白(tight junctions,TJs)减少,从而增加LPS渗漏,LPS可通过阻断TJs 的磷酸化和去磷酸化过程,降低ZO-1 在上皮细胞中的表达,加重炎症反应[39]。研究发现,为期6 个月的慢性运动(耐力、阻力和柔韧性训练)可减少T2DM 患者肠道病原菌的定植,降低粪便ZO-1、LPS 和CPR 浓度[19];将自由转轮训练6周的小鼠粪便移植到无菌小鼠体内,发现其结肠黏液层厚度增加,免疫细胞浸润减少[40]。长期运动训练可增加Lachnospiraceae和Faecalibacterium prausnitzii等产丁酸盐细菌群的丰度,丁酸可调节中性粒细胞的功能和迁移,增加TJs 基因表达,抑制炎症细胞因子释放,发挥维持肠道上皮屏障的功能[41];模拟高原运动训练可提高IL-6、TNF-α 水平及NF-κB 蛋白表达,IL-6 可改变紧密连接蛋白ZO-1 在胞内的错误定位,改变肌动蛋白结构,调节肌动蛋白收缩[42];对T2DM合并冠心病患者进行为期12个月的联合有氧与抗阻运动,并未发现肠漏标志物I-FABP、LBP 的改善,但该研究并未排除饮食和药物的影响,这可能减弱了运动干预的测定效果[43]。以上研究提示,不同训练方案对肠黏膜屏障的影响存在一定的差异。
4.2.2 改善内毒素血症 作为代谢性内毒素血症的关键触发因子,LPS 可通过LPS 结合蛋白(LBP)/CD14/TRL4 信号激活免疫细胞,这些信号可能渗入肝脏、脂肪组织和骨骼肌等组织导致全身炎症[44]。在年轻女性中,急性离心运动训练可通过NF-κB 途径和干扰素调节转录因子3(IRF3)下游信号传导阻止TLR4 激活[45]。Sestrins 是以Sestrin1、Sestrin2 及Sestrin3 三种形式存在于哺乳动物体内的应激诱导蛋白,在机体炎症反应中发挥重要作用[46]。研究报道,将巨噬细胞过表达Sesn2 后发现,其TNF-α、IL-6和IL-1β 等炎症因子表达下降[46]。YU 等[47]在对小鼠进行8 周的跑台运动干预后发现,运动组小鼠肠道中产丁酸盐细菌显著增加,其肝脏中Sesn2 表达上升;在单独使用丁酸盐灌胃小鼠后也出现了类似的表达结果,提示Sesn2 在此过程中具有重要作用。此外,运动训练可降低肥胖儿童中NLR 家族Pyrin结构域3 和caspase-1 水平,这些蛋白质参与炎症小体激活途径[48]。
4.3 减轻氧化损伤 氧化应激是T2DM 的重要诱因,LPS 可结合TLR4 激活NF-κB 与AP-1 信号途径诱导大量活性氧(reactive oxygen,ROS)产生,从而损伤胰岛β 细胞,引起胰岛素抵抗[49]。肠道菌群在机体抗氧化系统中具有重要作用,摄入益生菌可有效提高抗氧化水平,益生菌的抗氧化机制可以部分解释为螯合金属离子,降低超氧阴离子和过氧化氢活性[50]。动物实验表明,摄入副干酪乳杆菌NL41 可提高超氧化物歧化酶和谷胱甘肽过氧化物酶活性,改善糖代谢[51]。此外,有研究报道,SCFAs调节氧化应激可通过抑制GPR43 和组蛋白去乙酰化酶(histone deacetylase,HDAC)发挥作用[52-53]。运动通过肠道菌群改善氧化应激目前未见报道,未来研究仍需进一步探讨该方面的机制。
4.4 调节肌因子 肌因子是由骨骼肌组织产生并分泌的细胞因子,其生物学效应主要为运动对机体产生良性作用。IL-6是第一个在血液中被发现的肌肉因子,与巨噬细胞分泌IL-6 参与的炎症机制相反,肌细胞释放的IL-6 通过激活骨骼肌中的AMPK或磷脂酰肌醇3激酶(PI3K)增加葡萄糖摄取和脂肪氧化[54];IL-6 可促进肠道L 细胞和胰岛α 细胞分泌GLP-1 增加胰岛素分泌[55];肠道菌群在调节肌肉代谢中发挥重要作用,LAHIRI 等[56]发现,无菌小鼠的肌肉质量和力量出现下降,甚至出现肌肉萎缩,采用SCFAs处理无菌小鼠后,其肌萎缩素1(Atrogin-1)表达降低,而生肌调节因子MyoD1 表达升高。提示肌因子可能参与运动调节肠道微生物改善T2DM 过程,而目前并无相关研究证实。
5 小结与展望
综上,大多数研究表明,运动对肠道菌群具有正向调节作用,运动调节肠道菌群成为改善T2DM的部分机制仍存在争议。目前,运动对肠道菌群及代谢影响结果出现差异的原因可能是遗传、饮食结构、运动类型、强度以及持续时间造成的。未来的研究应考虑适当干预持续时间和样本量,并进行长期随访,还需关注疾病的决定因素,如年龄、性别、合并症等,这些因素很大可能影响疾病对运动的反应。因此,深入探究运动对肠道菌群的影响可为防治T2DM提供理论和实践依据。