依托咪酯通过促进miR-142-3p表达减轻缺氧诱导的PC12细胞神经炎症反应和细胞凋亡的分子机制研究①
沈 磊 李明霞 彭 湃 周军格 杨 军 (长江航运总医院麻醉科,武汉 430000)
脑缺氧缺血可引起广泛的生物反应,包括去极化、兴奋性毒性、氧化应激、炎症和细胞凋亡,并导致神经变性[1]。依托咪酯是一种常用的静脉麻醉剂,可在麻醉期间保持良好的血流动力学稳定性。据报道,依托咪酯在非小细胞肺癌等癌症中发挥肿瘤抑制作用[2]。最近有报道称,依托咪酯具有神经保护作用。依托咪酯通过抗凋亡、抗氧化作用改善过氧化氢刺激的PC12细胞损伤,或减少细胞死亡对抗神经元缺氧损伤[3-4]。然而,依托咪酯是否会对缺氧诱导的PC12 细胞产生有益作用仍有待阐明。依托咪酯麻醉会在心血管中诱导不同的微小RNA(microRNA,miRNA)表达,如miR-129-5p、miR-105、miR-324-3p 等[5]。研究显示,miR-142-3p 对脑缺血/再灌注损伤发挥神经保护作用[6]。然而miR-142-3p对缺氧诱导的PC12 细胞损伤及依托咪酯能否通过调控miR-142-3p 减轻缺氧诱导的PC12 细胞损伤尚不明确。本研究旨在探究依托咪酯对缺氧诱导的PC12 细胞凋亡和炎症损伤的保护作用,并以miR-142-3p为切入点,阐明其潜在机制。
1 材料与方法
1.1 材料 PC12 细胞(中国科学院上海细胞库);依托咪酯(>98%)、CCK-8试剂(美国Sigma-Aldrich);Lipofectamine 3000、TRIzol 试剂、TaqMan MicroRNA逆转录试剂盒(美国Invitrogen);miR-con、miR-142-3p 模拟物、anti-miR-con、miR-142-3p 抑制物(antimiR-142-3p)(上海吉玛);抗细胞周期蛋白D1(CyclinD1)一抗、抗活化的含半胱氨酸的天冬氨酸蛋白水解酶-3(Cleaved-caspase-3)一抗、TNF-α、IL-1β、IL-6 ELISA 试剂盒(美国Abcam);细胞凋亡检测试剂盒、RIPA 缓冲液、BCA 蛋白定量试剂盒、ECL Plus试剂盒(上海碧云天);SYBR Green Universal qPCR Master Mix(美国Bio-Rad)。
1.2 方法
1.2.1 细胞培养与缺氧损伤 采用含10%胎牛血清、37 ℃、含5%CO2、95%空气的DMEM 培养基培养PC12 细胞。缺氧损伤时,将PC12 细胞置于37 ℃、95%N2、5%CO2的缺氧培养箱中培养24 h[7]。
1.2.2 实验分组 将PC12 细胞分为对照组(正常培养)、缺氧组(缺氧处理24 h)、缺氧+不同剂量(2、6、12 μmol/L)依托咪酯组(2、6、12 μmol/L 依托咪酯干预24 h 后,行缺氧处理)、miR-con+缺氧组(转染miR-con 后,行缺氧处理24 h)、miR-142-3p+缺氧组(转染miR-142-3p模拟物后,行缺氧处理24 h)、antimiR-con+缺氧+12 μmol/L 依托咪酯组(转染antimiR-con 后,12 μmol/L 依托咪酯干预24 h,再行缺氧处理24 h)、anti-miR-142-3p+缺氧+12 μmol/L 依托咪酯组(转染anti-miR-142-3p后,12 μmol/L依托咪酯干预24 h,再行缺氧处理24 h)。
1.2.3 CCK-8 法检测细胞活性 于96 孔板(2.5×104个/孔)培养细胞4 h,按照1.2.2 分组处理后,加入CCK-8(10 μl/孔)孵育2 h,酶标仪测450 nm 处吸光度(A)值。
1.2.4 流式细胞仪检测细胞凋亡 于6孔板(1.0×105个/孔)培养细胞4 h,按照1.2.2 分组处理后收集各组细胞,利用Annexin-V-FITC/PI 试剂盒,流式细胞术检测细胞凋亡率。
1.2.5 Western blot 检测CyclinD1、Cleaved-caspase-3蛋白表达 于6 孔板(1.0×105个/孔)培养细胞4 h,按照1.2.2 分组处理后,收集各组细胞。RIPA 试剂提取细胞中总蛋白,BCA 法测定蛋白浓度后,10%SDS-PAGE 分离总蛋白,并转膜、封闭。分别于CyclinD1(1∶1 000)、Cleaved-caspase-3(1∶1 000)、β-actin(1∶2 000)一抗中4 ℃孵育12 h,洗膜,再于二抗中37 ℃孵育2 h。显影,曝光,Image J软件进行蛋白灰度值分析。
1.2.6 ELISA 检 测TNF-α、IL-1β、IL-6 水 平 于6孔板(1.0×105个/孔)培养细胞4 h,按照1.2.2分组处理后,收集各组细胞培养上清液,350 g 离心10 min。取上清液,ELISA 试剂盒测定上清液中TNF-α、IL-1β、IL-6水平。
1.2.7 RT-qPCR 检测miR-142-3p 表达 于6 孔板(1.0×105个/孔)培养细胞4 h,按照1.2.2 分组处理后,收集各组细胞。TRIzol试剂提取细胞总RNA,逆转录合成cDNA,行PCR 扩增。miR-142-3p 正向引物:5'-GCTCGACAAGGCTCGTTATGAA-3',反向引物:5'-CCTTTGATTTTTGGGGCGGTA-3';U6(对照)正向引物:5'-AGGTCGGTGTGAACGGATTTG-3',反向引物:5'-GGGGTCGTTGATGGCAACA-3'。2-ΔΔCt法计算miR-142-3p相对表达。
1.3 统计学分析 采用SPSS22.0 软件分析数据。以±s表示计量资料。采用单因素方差分析比较多组间数据,SNK-q检验行组内比较;独立样本t检验分析两组间数据差异性。P<0.05 为差异有统计学意义。
2 结果
2.1 依托咪酯对缺氧处理的PC12细胞活性及凋亡的影响 与对照组比较,缺氧组PC12 细胞活性降低,凋亡率升高(P<0.05)。与缺氧组比较,缺氧+不同剂量(2、6、12 μmol/L)依托咪酯组PC12 细胞活性呈增强趋势,细胞凋亡率呈降低趋势(P<0.05,图1、表1)。
表1 依托咪酯对缺氧处理的PC12 细胞活性及凋亡的影响(±s,n=9)Tab.1 Effects of etomidate on activity and apoptosis of PC12 cells under hypoxia (±s,n=9)
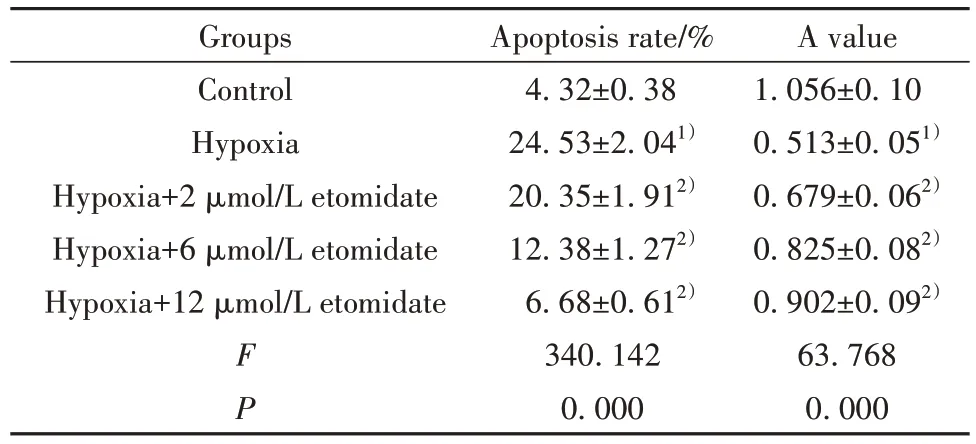
表1 依托咪酯对缺氧处理的PC12 细胞活性及凋亡的影响(±s,n=9)Tab.1 Effects of etomidate on activity and apoptosis of PC12 cells under hypoxia (±s,n=9)
Note:Compared with control group, 1)P<0.05; compared with hypoxia group, 2)P<0.05.
A value 1.056±0.10 0.513±0.051)0.679±0.062)0.825±0.082)0.902±0.092)63.768 0.000 Groups Control Hypoxia Hypoxia+2 μmol/L etomidate Hypoxia+6 μmol/L etomidate Hypoxia+12 μmol/L etomidate FP Apoptosis rate/%4.32±0.38 24.53±2.041)20.35±1.912)12.38±1.272)6.68±0.612)340.142 0.000

图1 流式细胞术检测细胞凋亡Fig.1 Detection of apoptosis by flow cytometry
2.2 依托咪酯对缺氧处理的PC12细胞中有关蛋白表达的影响 与对照组比较,缺氧组CyclinD1 蛋白表达量降低,Cleaved-caspase-3 蛋白表达量增加(P<0.05)。与缺氧组比较,缺氧+不同剂量(2、6、12 μmol/L)依托咪酯组CyclinD1 蛋白表达呈升高趋势,Cleaved-caspase-3 蛋白表达量呈降低趋势(P<0.05,图2、表2)。
表2 依托咪酯对缺氧处理的PC12 细胞中CyclinD1、Cleaved-caspase-3蛋白表达的影响(±s,n=9)Tab.2 Effect of etomidate on expressions of CyclinD1 and Cleaved-caspase-3 protein in hypoxia-treated PC12 cells (±s,n=9)
Note:Compared with control group, 1)P<0.05; compared with hypoxia group, 2)P<0.05.
Cleaved-caspase-3 0.24±0.03 0.75±0.071)0.62±0.062)0.45±0.042)0.32±0.032)166.878 0.000 Groups Control Hypoxia Hypoxia+2 μmol/L etomidate Hypoxia+6 μmol/L etomidate Hypoxia+12 μmol/L etomidate F P CyclinD1 0.86±0.07 0.41±0.041)0.61±0.062)0.75±0.072)0.90±0.092)90.977 0.000

图2 Western blot 检测CyclinD1、Cleaved-caspase-3 蛋白表达Fig.2 Expressions of CyclinD1 and Cleaved-caspase-3 protein detected by Western blot
2.3 依托咪酯对缺氧处理的PC12 细胞炎症因子表达的影响 与对照组比较,缺氧组TNF-α、IL-1β、IL-6 水平升高(P<0.05)。与缺氧组比较,缺氧+不同剂量(2、6、12 μmol/L)依托咪酯组TNF-α、IL-1β、IL-6水平均呈降低趋势(P<0.05,表3)。
表3 依托咪酯对缺氧处理的PC12 细胞炎症因子表达的影响(±s,n=9,ng/L)Tab.3 Effects of etomidate on expressions of inflammatory factors in hypoxia-treated PC12 cells (±s,n=9,ng/L)

表3 依托咪酯对缺氧处理的PC12 细胞炎症因子表达的影响(±s,n=9,ng/L)Tab.3 Effects of etomidate on expressions of inflammatory factors in hypoxia-treated PC12 cells (±s,n=9,ng/L)
Note:Compared with control group, 1)P<0.05; compared with hypoxiagroup, 2)P<0.05.
Groups Control Hypoxia Hypoxia+2 μmol/L etomidate Hypoxia+6 μmol/L etomidate Hypoxia+12 μmol/L etomidate TNF-α 25.02±2.27 104.02±9.561)IL-1β 81.64±7.61 456.31±41.021)IL-6 12.17±1.14 64.58±6.111)81.17±7.522)384.97±33.142)48.67±4.282)60.53±5.242)254.67±22.132)32.61±2.942)42.19±3.912)147.84±12.572)19.54±1.512)FP 302.733 0.000 223.663 0.000 317.655 0.000
2.4 依托咪酯对miR-142-3p 表达的影响 对照组、缺氧组、缺氧+不同剂量(2、6、12 μmol/L)依托咪酯组miR-142-3p 表达量分别为1.00±0.11、0.43±0.04、0.61±0.06、0.79±0.07、0.89±0.09。与对照组比较,缺氧组miR-142-3p 表达量减少(P<0.05)。与缺氧组比较,缺氧+不同剂量(2、6、12 μmol/L)依托咪酯组miR-142-3p表达量呈增加趋势(P<0.05)。
2.5 miR-142-3p 对缺氧处理的PC12 细胞活性、凋亡及炎症因子表达的影响 miR-142-3p+缺氧组PC12 细胞miR-142-3p 表达量、细胞活性、CyclinD1蛋白表达量较miR-con+缺氧组升高,Cleaved-caspase-3 蛋白表达量、TNF-α、IL-1β、IL-6 水平、细胞凋亡率较miR-con+缺氧组降低(P<0.05,表4、图3)。
表4 上调miR-142-3p对缺氧处理的PC12细胞活性、凋亡和炎症因子表达的影响(±s,n=9)Tab.4 Effects of up-regulation of miR-142-3p on activity, apoptosis and inflammatory factors expressions in hypoxia-treated PC12 cells (±s,n=9)

表4 上调miR-142-3p对缺氧处理的PC12细胞活性、凋亡和炎症因子表达的影响(±s,n=9)Tab.4 Effects of up-regulation of miR-142-3p on activity, apoptosis and inflammatory factors expressions in hypoxia-treated PC12 cells (±s,n=9)
Note:Compared with miR-con+hypoxia group, 1)P<0.05.
A value 0.516±0.05 1.013±0.091)14.482 0.000 Groups miR-con+hypoxia miR-142-3p+hypoxia t P miR-142-3p 1.00±0.10 2.53±0.221)18.994 0.000 CyclinD1 0.42±0.04 0.88±0.081)15.429 0.000 Cleavedcaspase-3 0.76±0.07 0.37±0.031)15.363 0.000 TNF-α/(ng·L-1)105.11±9.25 30.94±2.341)23.321 0.000 IL-1β/(ng·L-1)455.61±41.02 95.56±9.161)25.699 0.000 IL-6/(ng·L-1)64.21±6.17 13.54±1.061)24.281 0.000 Apoptosis rate/%24.84±2.08 5.43±0.511)27.190 0.000
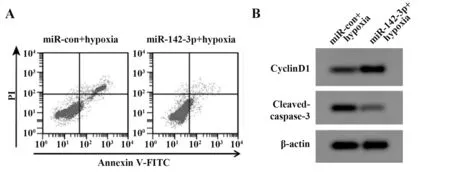
图3 上调miR-142-3p对缺氧处理的PC12细胞凋亡及相关蛋白表达的影响Fig.3 Effect of up-regulation of miR-142-3p on apoptosis of PC12 cells under hypoxia and expressions of related proteins
2.6 下调miR-142-3p 逆转依托咪酯对缺氧处理的PC12 细胞活性、凋亡和炎症因子表达的影响 antimiR-142-3p+缺氧+12 μmol/L 依托咪酯组miR-142-3p表达量、细胞活性、CyclinD1蛋白表达量低于antimiR-con+缺氧+12 μmol/L 依托咪酯组,Cleaved-caspase-3 蛋白表达量、TNF-α、IL-1β、IL-6 水平及细胞凋亡率均高于anti-miR-con+缺氧+12 μmol/L 依托咪酯组(P<0.05,图4、表5)。
表5 下调miR-142-3p逆转依托咪酯对缺氧处理的PC12细胞活性、凋亡和炎症因子表达的影响(±s,n=9)Tab.5 Down-regulation of miR-142-3p reverses effects of etomidate on activity, apoptosis and inflammatory factors expressions in hypoxia-treated PC12 cells (±s,n=9)

表5 下调miR-142-3p逆转依托咪酯对缺氧处理的PC12细胞活性、凋亡和炎症因子表达的影响(±s,n=9)Tab.5 Down-regulation of miR-142-3p reverses effects of etomidate on activity, apoptosis and inflammatory factors expressions in hypoxia-treated PC12 cells (±s,n=9)
Note:Compared with anti-miR-con+hypoxia+12 μmol/L etomidate group,1)P<0.05.
Groups anti-miR-con+hypoxia+12 μmol/L etomidate anti-miR-142-3p+hypoxia+12 μmol/L etomidate miR-142-3p CyclinD1 IL-1β/(ng·L-1)IL-6/(ng·L-1)A value 1.00±0.10 0.91±0.09 Cleavedcaspase-3 0.33±0.03 TNF-α/(ng·L-1)42.02±3.86 147.39±11.94 19.47±1.64 Apoptosis rate/%6.61±0.65 0.910±0.09 0.537±0.051)10.869 0.000 t P 0.48±0.041)14.484 0.000 0.45±0.041)14.012 0.000 0.71±0.071)14.969 0.000 94.13±8.531)16.697 0.000 421.57±40.011)19.700 0.000 67.94±5.971)23.487 0.000 23.18±1.991)23.745 0.000
3 讨论
缺氧可诱导神经细胞产生过度炎症反应,分泌大量炎症因子,造成神经细胞炎症损伤,这些炎症因子进一步刺激神经细胞,诱导神经细胞凋亡,抑制缺氧诱导的神经细胞炎症反应和凋亡对治疗脑缺氧十分关键[8-9]。大鼠嗜铬细胞瘤细胞系PC12 高度分化后,具有神经细胞特性,常用作神经生物学和神经化学研究的模型细胞[10]。本研究发现,缺氧处理PC12细胞后,细胞活性降低,细胞凋亡增加,且炎症因子TNF-α、IL-1β、IL-6 分泌量增加,表明缺氧诱导PC12细胞损伤模型建立成功。
依托咪酯是一种常用的催眠和静脉麻醉剂,其还具有抗炎、抗细胞凋亡作用。例如,SUN 等[11]发现依托咪酯可抑制晚期糖基化终产物(AGEs)诱导的软骨细胞中IL-1β 和TNF-α 表达;LV 等[12]报道依托咪酯通过降低炎症标志物IL-6、IL-1β 和TNF-α 分泌防止心肌缺血再灌注损伤;ZOU 等[13]报道称,依托咪酯处理可通过降低TNF-α、IL-1β 表达、减少凋亡和坏死细胞数量缓解大鼠肢体缺血再灌注引起的肺损伤。本研究结果显示,依托咪酯剂量依赖性地提高缺氧诱导的PC12 细胞活性,减少细胞凋亡,并降低炎症因子TNF-α、IL-1β、IL-6 分泌,表明依托咪酯可以保护PC12细胞免受缺氧诱导的损伤。
miRNA 参与调控细胞凋亡、炎症反应等生理、病理过程,可作为脑缺氧损伤治疗的分子靶点[14]。研究显示,miR-142-3p 在脑缺血再灌注小鼠大脑皮层和氧糖剥夺诱导的PC12细胞中表达增加[15];在培养的背根神经节神经元中,miR-142-3p 模拟物通过促进细胞周期和抑制细胞凋亡增强细胞活力[16]。本研究结果显示,miR-142-3p在缺氧诱导的PC12细胞中表达降低,上调miR-142-3p 可抑制缺氧诱导的PC12细胞凋亡及炎症因子表达,提示miR-142-3p可作为减轻缺氧诱导的PC12 细胞损伤的分子靶点。WU 等[17]报道表明,麻醉剂右美托咪定通过调节miR-199a 保护PC12 细胞免受氧化损伤。本研究显示,依托咪酯上调缺氧诱导的PC12细胞中miR-142-3p 表达,而下调miR-142-3p 可逆转依托咪酯对缺氧诱导的PC12 细胞活性、凋亡及炎症因子表达的影响,提示其可能通过上调miR-142-3p 减轻缺氧诱导的PC12细胞损伤。
总之,依托咪酯通过上调miR-142-3p 表达抑制细胞凋亡和炎症反应,对缺氧诱导的PC12细胞表现出良好的保护作用。这可能为改善缺氧引起的神经细胞损伤开辟新视野。