APC基因突变致家族性腺瘤性息肉病一例并文献复习
薛福敏,雷 志,李小芹
1)郑州大学附属儿童医院消化内科 郑州 450000 2)郑州大学附属儿童医院儿童遗传代谢性疾病重点实验室 郑州 450000
家族性腺瘤性息肉病(familial adenomatous polyposis,FAP) 是一种发病率约为1/8 300的常染色体显性遗传病,其特征是结直肠中有几百至数万个不等的腺瘤[1]。FAP的发病与结肠腺瘤性息肉病(adenomatous polyposis coli,APC)基因突变有关,然而APC基因突变位点的异质性与患者的发病年龄、并发症以及预后密切相关,因此尽可能明确APC基因精确的突变位点,对于明确诊断、治疗方案的选择及预后至关重要。作者回顾性分析了1例以间断便血为主诉的FAP患儿的基因检测结果、遗传学特点,并复习了相关文献,现总结报道如下。
1 临床资料
患儿,女,1岁11个月,以“间断便血1周”为代主诉于2021年5月12日就诊。患儿1周前无明显诱因出现便血,表现为黄色成形软便中间断含鲜血,量多少不等,无发热、咳嗽、呕吐、腹胀、腹部异常包块、异常哭闹等不适,未诊治。4 d前排便时见肛门口有一直径约2 cm的肉球脱出,至当地诊所手工推入。入院查体:发育正常,营养中等,全身皮肤、黏膜无黄染、皮疹、黑斑及出血点,全身浅表淋巴结未触及肿大,心、肺、腹部体格检查无异常,神经系统查体无异常。辅助检查:血常规、尿常规、肝功能、肾功能、凝血功能、电解质、传染病四项、心电图、胸腹立位片均大致正常。肝脏、脾脏、肾脏、阑尾、肠系膜淋巴结、腹部彩超均无异常,未见肠套叠。
结肠镜镜下初步诊断为FAP,并行结直肠多发息肉黏膜切除术(图1A)。术后给予禁食水、抗感染、肠外营养支持治疗。出院后嘱其定期复查结肠镜。息肉病理结果:腺瘤样息肉(图1B)。
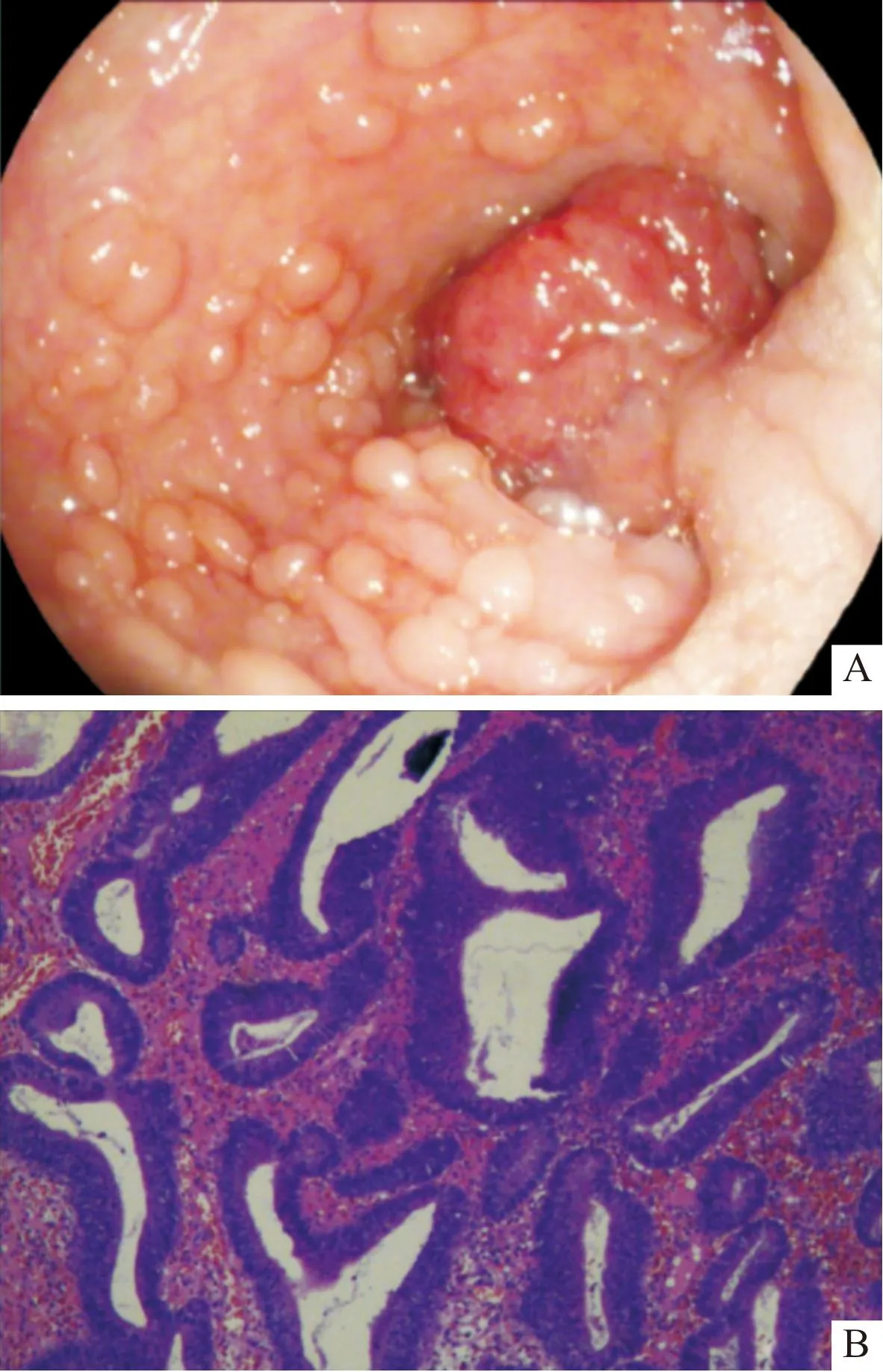
A:结肠镜结果;B:息肉病理结果(HE,×200)
询问家族史,患儿爷爷、父亲均有便血病史,未诊治;奶奶、母亲、弟弟、姑姑均无相关症状。结合患儿病情、辅助检查及家族史,考虑诊断FAP。积极沟通后建议进一步完善全外显子组基因检测。签署知情同意书后,取患儿及其父母、弟弟、爷爷、奶奶、姑姑的新鲜全血2 mL,送北京智因东方诊断科技有限公司,提取全基因组DNA,利用PCR技术、高通量测序分析突变位点,并行Sanger测序验证。结果显示该患儿存在APC基因杂合变异(NM_000038:c.6662T>C),为错义突变(图2)。Sanger测序发现,患儿父亲、爷爷该位点为杂合变异,其弟弟、母亲、姑姑、奶奶均为野生型(图2)。FAP家系图见图3(箭头指示为先证者)。HGMD数据库中有该变异的报道1篇[2],ClinVar数据库对该变异的致病性分析结果为临床意义未明。该变异在普通人群数据库(ExAC、gnomAD、千人基因组亚洲人群数据库)中的频率较低,为低频变异。根据美国医学遗传学和基因组学学会指南,该变异判定为临床意义未明。电话随访其父亲及爷爷,结肠镜均可见结直肠多发息肉。综合患儿症状、体征、家族史、结肠镜及基因检测结果,确诊FAP。
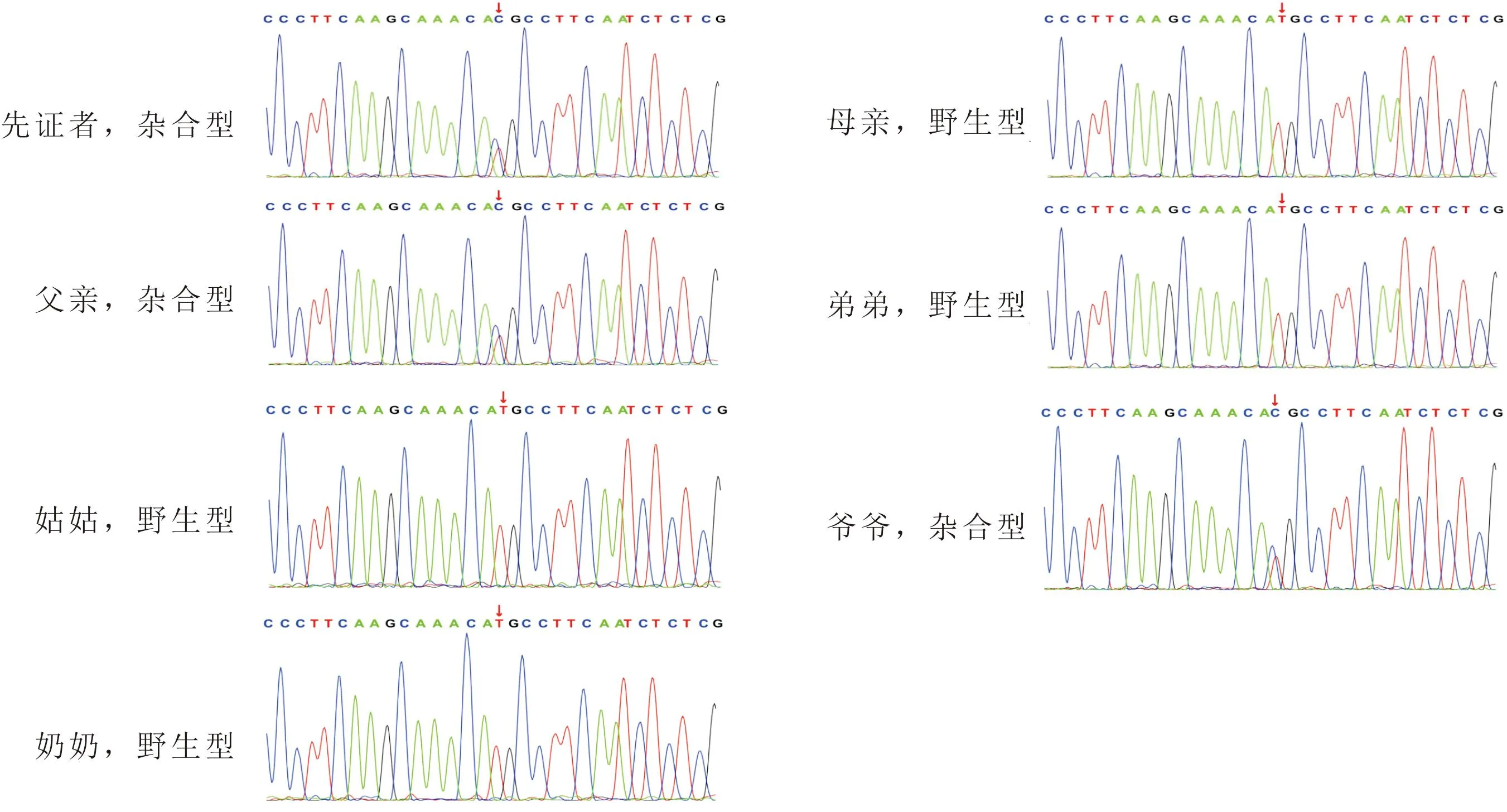
图2 先证者及其父母、相关亲属APC基因Sanger测序结果
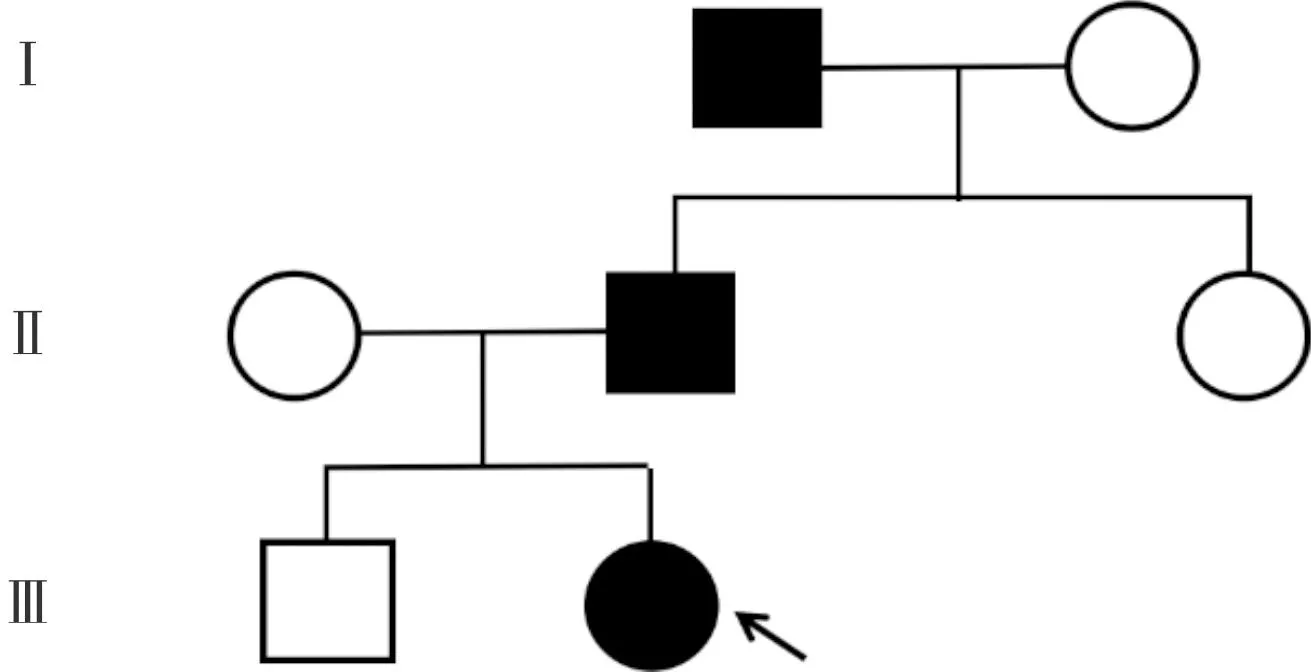
图3 FAP家系图
2 讨论
FAP是由APC基因突变引起的一种家族性癌前病变,其特征是结直肠大量腺瘤或息肉形成。研究[3-4]发现,大多数息肉通常在儿童期开始发育;到青春期,大约50%的FAP息肉可进展为腺瘤;到35岁时这一概率增至95%。一般来说,息肉出现10 a后开始有致癌的风险,40~50岁时,结直肠癌的发生风险接近100%[5-6]。
FAP的分型一般依据息肉的数量及发病年龄而定。结直肠腺瘤性息肉数量大于1 000枚,且发病年龄在20岁之前,可判定为经典型FAP,该型癌变率为100%;而轻表型FAP息肉数量一般小于100枚,发病年龄50~55岁,癌变率约为69%;介于二者之间的为中间型FAP[7]。结合患儿症状及结肠镜下表现,该患儿应属于中间型FAP,且患儿发病年龄较小,恶变风险相对较大,因此,应定期复查结肠镜,动态监测病情变化,做到早发现、早治疗。
广泛的临床表型异质性是 FAP 的特征。大多数FAP患者可潜伏多年无临床症状,但随着腺瘤逐渐增多增大,可能会引起便秘、腹泻、腹痛、腹部包块、便血、梗阻、体重减轻等相关症状,甚至可发展为结直肠癌。由于FAP本质上是一种全身性疾病,因此会合并一些肠外表现:如十二指肠和壶腹周围腺瘤或癌、胃的良性囊性腺息肉、视网膜色素上皮的先天性肥大、骨瘤、牙齿发育异常、甲状腺癌、硬纤维瘤、肝母细胞瘤等[8]。
FAP临床表型的异质性与APC基因突变位点不同有关。APC基因位于染色体5q21上,可编码2 843个氨基酸,大部分APC基因突变为移码突变、无义突变或错义突变。研究[9-11]发现APC基因密码子1 300附近的突变与结直肠癌的高风险相关,胃十二指肠腺瘤与密码子564~1 493的变异有关,视网膜色素上皮的先天性肥大主要与APC基因密码子463~1 387的突变相关,而硬纤维瘤则与密码子1 445~1 578的突变相关。FAP合并肝母细胞瘤及脑肿瘤的患者以密码子457~1 309的突变较多见,而合并甲状腺瘤的FAP患者以密码子1 286~1 513突变多见[12]。此外,研究[13]发现APC的突变位点与发病年龄亦存在相关性。
FAP的诊断需结合患者的临床症状、家族史、结肠镜检查及基因检测。若根据症状及家族史高度怀疑FAP,需进一步完善结肠镜及基因检测协助诊疗。基因检测对于FAP的诊断和治疗方案的选择十分重要,APC基因致病位点与患者的发病年龄、并发症的发生、治疗方案的选择及预后密切相关。本篇报道中患儿及其父亲、爷爷APC基因存在相同突变(c.6662T>C),该突变目前在国际上仅有1篇报道[2],而该报道中主要是描述APC基因(c.6662T>C:p.Met2221Thr)和MSH6基因(c.3488A>T:p.Glu1163Val)复合突变致病Peutz-Jeghers 综合征。本报道中患儿及其父亲、爷爷均无口唇、指端黑斑等Peutz-Jeghers综合征的典型体征,结合患儿症状、体征、结肠镜、黏膜病理、基因检测结果等,考虑诊断FAP。APC基因(c.6662T>C)单独突变可引起FAP,但并不会导致Peutz-Jeghers综合征。
FAP的治疗需要结合患者的年龄、症状、辅助检查及基因突变位点。若患者年龄较小,息肉数量较少且未合并严重的并发症,建议结肠镜下息肉切除;这种治疗方案有创伤小、术后恢复快等优点。如果患者有结肠癌家族史、息肉数量多、体积大、累及范围广,则建议行手术治疗;手术方案主要有全直肠结肠切除术+Brooke回肠造口术、结肠次全切除术+回肠直肠吻合术、全直肠结肠切除术+回肠肛管吻合术、结肠全切除+回直肠吻合术、全结肠切除直肠黏膜剥脱+回肠储袋肛管吻合术和全结直肠次全切除+经直肠肌鞘内回肠肛管吻合术等。每种术式均有其优缺点,具体选择何种术式需结合患者的诉求、息肉的数量及家族史综合考虑。亦有报道一些药物如塞来昔布、舒林酸等非甾体抗炎药可减少息肉的数量及生长速度,因此可用于FAP的治疗[14-15],但其长期的疗效及不良反应仍需进一步观察。
综上所述,FAP易发展为结直肠癌,因此早诊断、早治疗、动态监测对于该病的预后十分重要。APC基因检测可早期诊断FAP,同时致病位点的明确可以为FAP的个体化治疗提供新思路。

