岩藻多糖对氧糖剥夺诱导的新生大鼠海马脑神经元的影响
时英才,雷瑞瑞,周栩平,张 网,段佳佳
1)驻马店市中心医院新生儿科 河南驻马店 463000 2)郑州大学第三附属医院新生儿科 郑州 450052
缺氧缺血(hypoxic-ischemic,HI)脑损伤是最常见的新生儿疾病,严重威胁新生儿的身心健康。新生儿HI脑损伤的发生发展过程非常复杂,涉及炎症反应、氧化应激、神经毒性、细胞凋亡和自噬等[1-2],目前尚无有效的治疗方法。
岩藻多糖(fucoidan,Fuc)是一种从褐藻中提取的硫酸化多糖,具有抗炎和抗氧化特性[3-4]。有研究[5]发现,Fuc可以调节磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶 B(Akt)信号通路,该通路参与了调节细胞存活和死亡。在帕金森病小鼠模型[6-7]中,Fuc可以防止多巴胺能神经元死亡,发挥神经保护作用。因此,我们建立了氧糖剥夺(oxygen-glucose deprivation,OGD)诱导的新生大鼠脑神经元损伤模型,设计了本研究,以便深入探讨Fuc在HI脑损伤后的保护作用,并确定其潜在的分子机制。
1 材料与方法
1.1 材料新生24 h内的SD大鼠购自北京维通利华实验动物有限公司,动物许可证号:SYXK(京)2016-0003,雌雄比1∶1。Fuc,纯度99%,购自美国Sigma公司。DMEM培养基、胰蛋白酶和胎牛血清购自美国Gibco公司。MTT试剂、BCA蛋白浓度检测试剂盒购自碧云天生物技术有限公司。超氧化物歧化酶(SOD)活性和丙二醛(MDA)含量检测试剂盒购自南京建成生物工程研究所。AnnexinⅤ-FITC/PI细胞凋亡检测试剂盒购自日本TaKaRa公司。PI3K/Akt信号通路特异性抑制剂LY294002购自美国Invitrogen公司。Trizol试剂、反转录试剂盒、实时荧光定量PCR试剂盒、ECL化学发光试剂购自赛默飞世尔科技有限公司。白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)和诱导型一氧化氮合酶(iNOS)PCR引物由上海生工生物工程有限公司合成。兔抗鼠Cleaved Caspase-3、Cleaved Caspase-9、自噬标志物蛋白微管相关蛋白1轻链3(LC3)、Beclin-1、P62、PI3K、磷酸化PI3K(p-PI3K)、Akt和磷酸化Akt(p-Akt)单克隆抗体均购自美国CST公司,GAPDH抗体购自武汉博欧特生物科技有限公司,辣根过氧化物酶标记的山羊抗兔二抗购自安诺伦(北京)生物科技有限公司。含B27的神经基础培养基购自上海爱必信生物科技有限公司。
1.2 新生大鼠原代海马神经元的分离和培养[8]小心分离新生大鼠的海马体并置于D-Hank′s平衡盐溶液中,用胰蛋白酶(含EDTA)在37 ℃研磨和消化15 min。将细胞悬液以1×106个/mL的密度接种于96孔板,用含HEPES和体积分数10%胎牛血清的DMEM培养基培养12 h。随后除去DMEM培养基并更换为含有B27的神经基础培养基,每2 d更换一次培养基。
1.3 OGD处理方法新生大鼠海马神经元用原代培养基培养的第7天,取出神经元,更换为无葡萄糖、钙、镁的培养基,放入培养箱中,连续泵送混合气体(体积分数95% N2和5% CO2),37 ℃培养2 h。之后更换为常规培养基并在常氧培养箱中培养24 h。
1.4 实验分组将新生大鼠海马神经元分4组处理:空白组不做任何处理;Fuc组用100 μg/mL的Fuc培养7 d;OGD组按1.3方法诱导培养;OGD+Fuc组首先进行OGD诱导,然后用100 μg/mL的Fuc培养7 d。
1.5 测定指标
1.5.1细胞活性检测 分组处理后,收集神经元,更换新的培养液,添加100 μL MTT溶液37 ℃孵育4 h,随后加入20 μL二甲基亚砜振荡孵育10 min,直至沉淀完全溶解。使用酶标仪检测490 nm波长处的光密度。细胞活力=实验组光密度/空白孔光密度×100%。实验重复3次。
1.5.2神经元凋亡的检测 神经元分组处理后,弃上清,加入胰蛋白酶消化细胞,离心收集并用结合缓冲液重悬。向细胞悬液中添加AnnexinⅤ-FITC 5 μL和PI 5 μL,混匀后室温避光反应15 min,上流式细胞仪测定细胞凋亡率。实验重复3次。
1.5.3神经元中SOD活性和MDA含量的检测 分组处理后,收集神经元,按照SOD活性检测试剂盒和MDA含量检测试剂盒使用说明操作,测定SOD活性和MDA含量。实验重复3次。
1.5.4神经元中IL-1β、TNF-α和iNOS mRNA的检测 神经元分组处理后,采用Trizol法提取总RNA,反转录后行实时荧光定量PCR,以2-ΔΔCt法计算目的mRNA表达水平。IL-1β上游引物5’-CACCTCT CAAGCAGAGCCACAG-3’,下游引物5’-GGGTTC CATGGTGAAGTCAAC-3’;TNF-α上游引物5’-TACTCCCAGGTTCTCTTCAAGG-3’,下游引物5’-GGAAGGCTGACTTTCTCCTGGTA-3’;iNOS上游引物5’-AGGCCACCTCGGATATCTCT-3’,下游引物5’-GATTGTCTCTGGGTCCTCTG-3’;β-actin上游引物5’-CCCATCTATGAGGGTTACGC-3’,下游引物5’-TCTGGTGATGGAGCCTCTTACTGG-3’。实验重复3次。
1.5.5神经元中相关蛋白的检测 神经元分组处理后,在预冷裂解缓冲液中匀浆,匀浆在4 ℃条件下12 000×g离心10 min以获得总蛋白,BCA法分析总蛋白浓度。经SDS-PAGE凝胶分离(上样量50 mg),转PVDF膜(200 mA,2 h),室温下用50 g/L脱脂奶封闭膜2 h;4 ℃条件下加Cleaved Caspase-3、Cleaved Caspase-9、LC3、Beclin-1、P62、PI3K、p-PI3K、Akt及p-Akt抗体(均1∶1 000稀释)孵育过夜。用PBST洗涤3次,加二抗(1∶2 000稀释)室温下孵育2 h。采用Quantity One软件分析条带的灰度值,以目的蛋白与内参β-actin条带灰度值的比值为目的蛋白相对表达水平。实验重复3次。
2 结果
2.1 4组细胞活力、凋亡的比较4组凋亡相关蛋白Cleaved Caspase-3和Cleaved Caspase-9的表达见图1和表1,细胞活力和凋亡率测定结果见表1。结果显示,OGD可抑制新生大鼠海马神经元活力,促进神经元凋亡;Fuc可以拮抗OGD的上述作用。
2.2 4组神经元炎症和氧化应激指标的比较4组神经元中IL-1β、TNF-α和iNOS mRNA表达,SOD活性和MDA含量测定结果见表2。结果显示,OGD增强了新生大鼠海马神经元炎症反应和氧化应激水平,Fuc可以拮抗OGD的上述诱导作用。
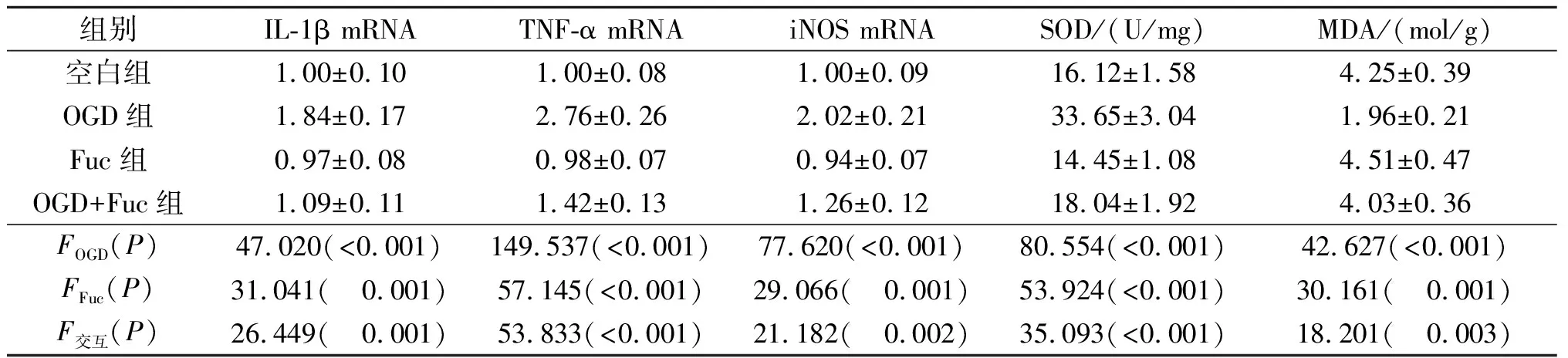
表2 4组神经元中IL-1β、TNF-α和iNOS mRNA表达,SOD活性和MDA含量的比较(n=3)
2.3 4组神经元自噬相关蛋白表达的比较见图2和表3。结果显示,OGD增强了新生大鼠海马神经元的自噬,Fuc可以拮抗OGD的诱导作用。
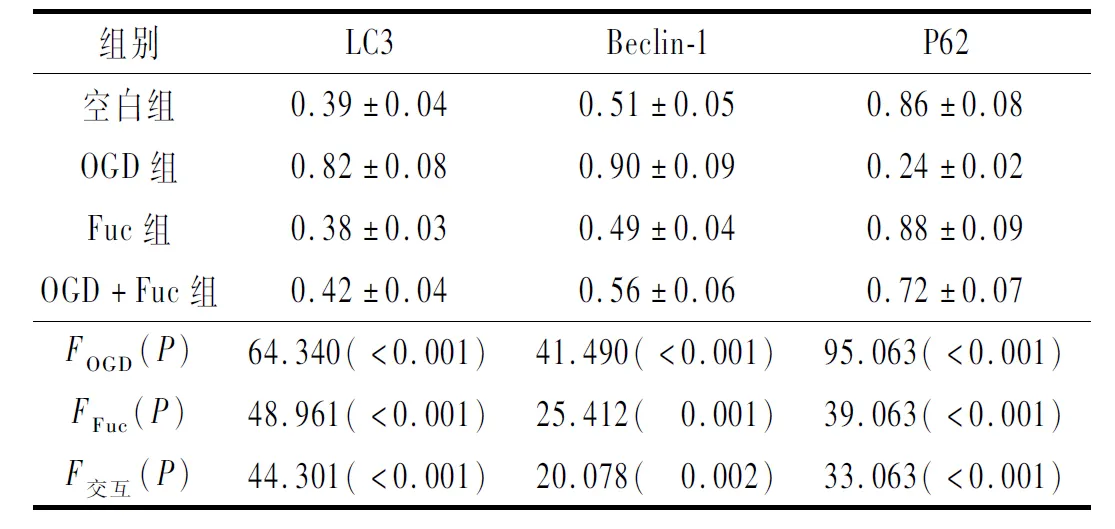
表3 4组神经元中自噬相关蛋白表达的比较(n=3)
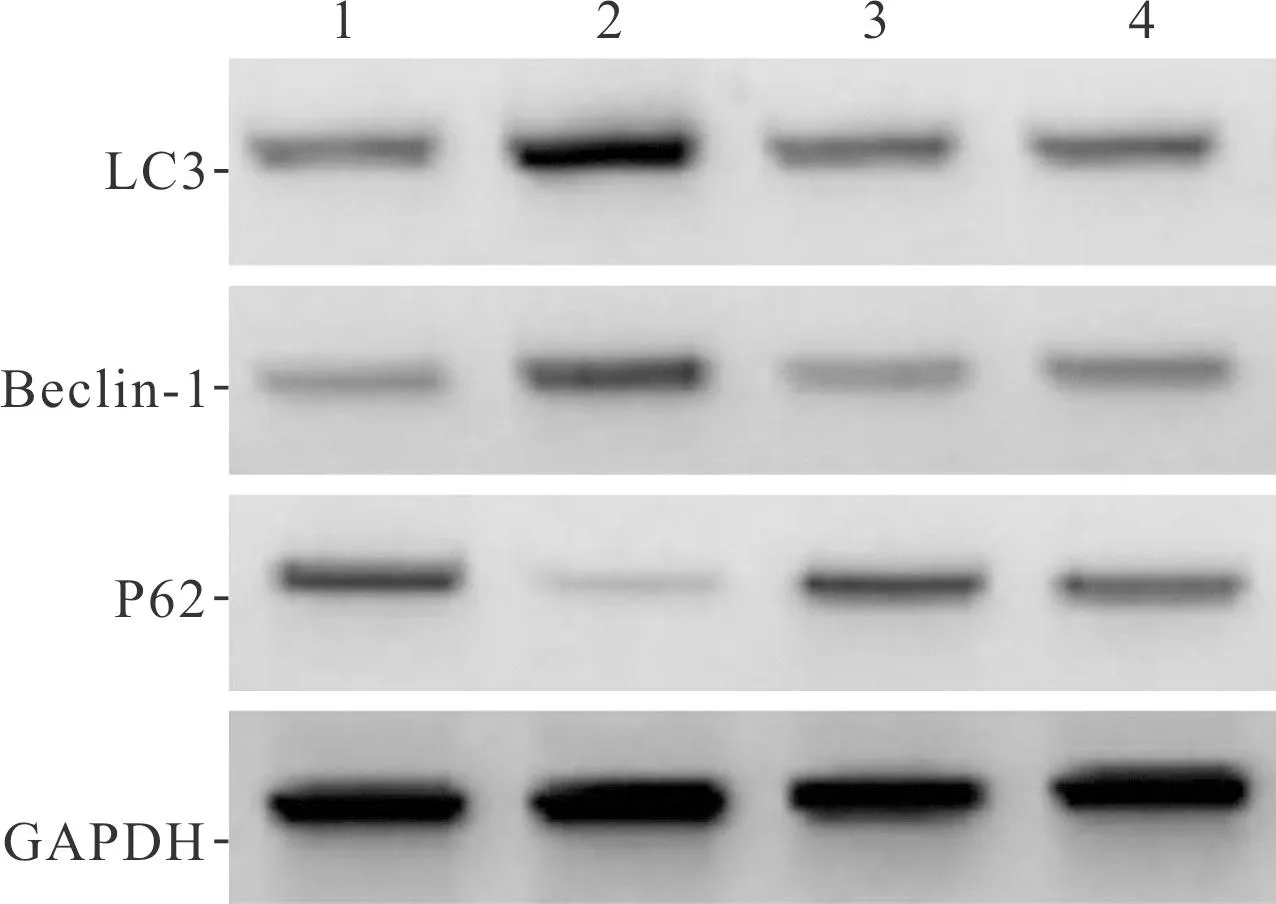
1:空白组;2:OGD组;3:Fuc组;4:OGD+Fuc组
2.4 4组神经元中PI3K/Akt信号通路蛋白表达的比较见图3和表4。结果显示,OGD抑制了新生大鼠海马神经元中PI3K/Akt信号通路的磷酸化激活,Fuc可以拮抗OGD的抑制作用。
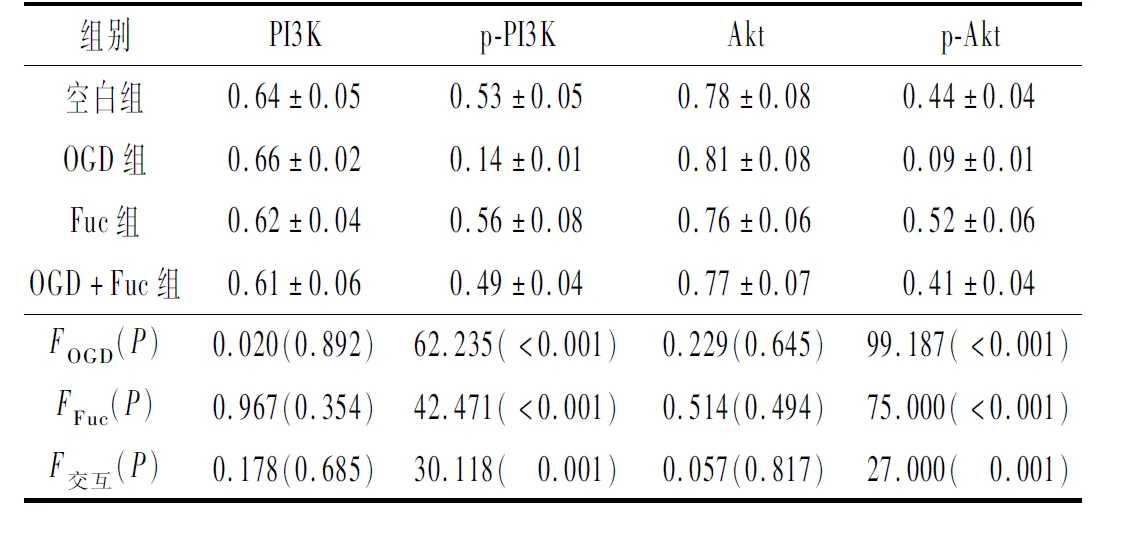
表4 4组细胞中PI3K、p-PI3K、Akt和p-Akt的表达水平比较(n=3)
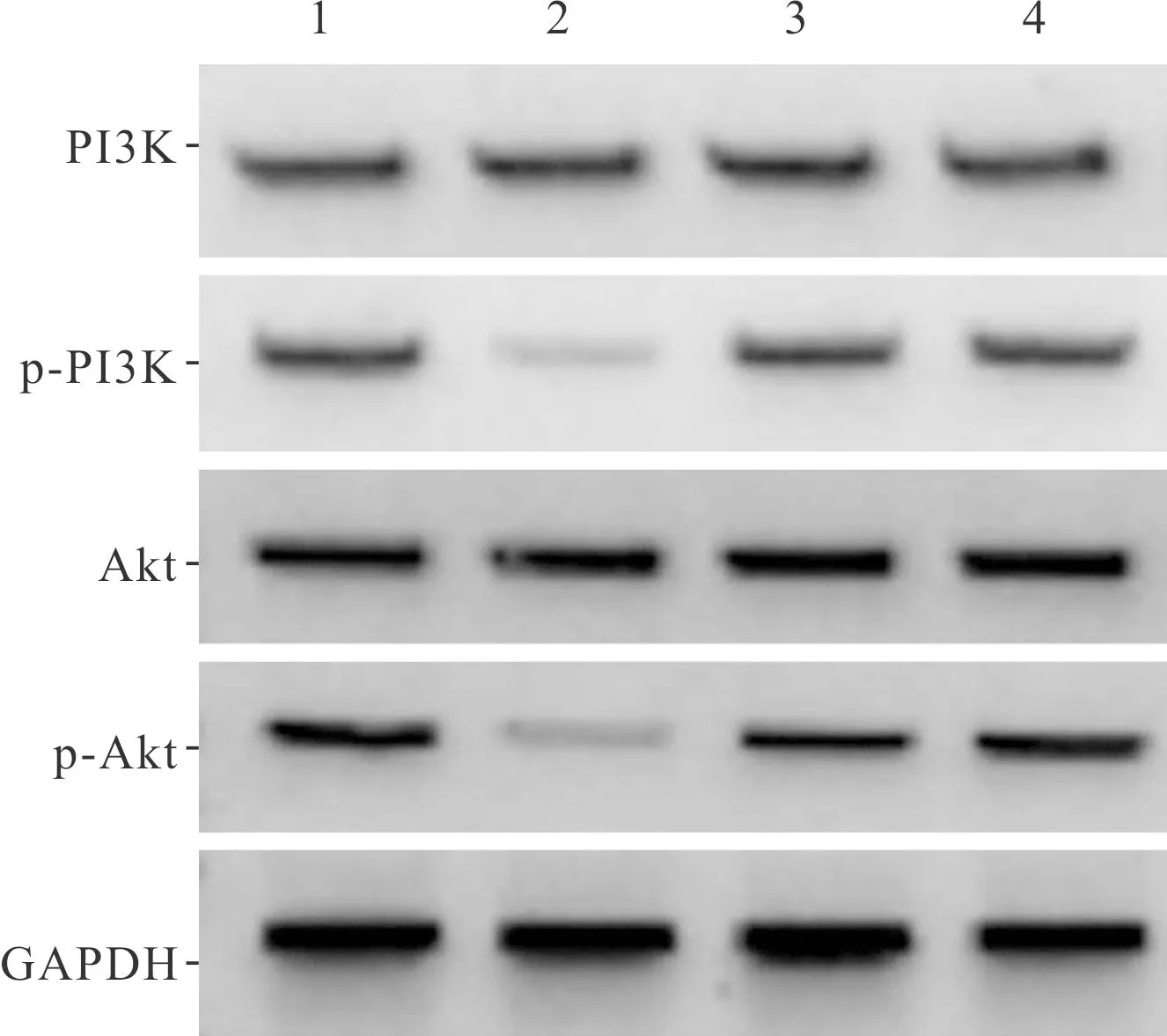
1:空白组;2:OGD组;3:Fuc组;4:OGD+Fuc组
3 讨论
本研究利用体外OGD模型发现,Fuc能够增强新生大鼠海马神经元的活力,减轻其凋亡,具有拮抗OGD的作用,表明其对OGD诱导的海马神经元损伤具有保护作用。
越来越多的证据[9-10]表明炎症在HI损伤中起着重要作用。在本研究中,Fuc降低了OGD诱导的新生大鼠海马神经元IL-1β、TNF-α和iNOS mRNA的表达,降低了抗氧化酶SOD活性,增加了膜脂过氧化物MDA含量,表现为降低OGD诱导的大鼠海马神经元的炎症和氧化应激水平,提示Fuc可能通过减少炎症因子的表达和减轻氧化应激损伤来发挥其神经保护作用。
自噬在HI脑损伤中起着重要作用,过度激活的自噬可导致神经元快速死亡[11-12]。PI3K/Akt通路参与调节细胞存活和死亡[13]。激活PI3K/Akt通路可以在HI脑损伤中发挥神经保护作用[14-15]。当PI3K激活时,Akt可以磷酸化TSC2,解离TSC1/TSC2复合物,调节下游自噬相关蛋白Beclin1、LC3和P62的表达,参与自噬的调控[16]。LC3位于自噬体膜上,在完整自噬体的形成中起重要作用。Beclin-1在溶酶体融合和自噬形成中起重要作用,是另一个重要的自噬标志物。P62水平升高,LC3水平降低,表明自噬流完成[17]。本研究结果表明,OGD可使新生大鼠海马神经元中p-PI3K、p-Akt和P62的表达降低,而LC3和Beclin-1蛋白表达增加;Fuc可逆转OGD诱导的p-PI3K、p-Akt和P62表达降低;提示Fuc可以通过激活PI3K/Akt信号通路以减轻神经元自噬,从而减轻OGD诱导的神经元损伤。
总之,本研究证明了Fuc能够有效减轻OGD诱导的新生大鼠海马神经元损伤,其潜在机制可能与激活PI3K/Akt信号通路有关。

