CD4+/CD8+联合缺氧诱导因子-1α检测对结直肠癌患者术后复发的评估价值
裴建灰,朱乐恒,朱晓龙
平煤神马医疗集团总医院普外科,河南平顶山 467000
世界卫生组织(World Health Organization,WHO)报道,结直肠癌是发病率仅次于肺癌的全球第二大恶性肿瘤,好发于40 岁以上中老年人群[1],其发病机制尚不明确,目前多认为与环境、饮食习惯及遗传等因素有关[2]。手术是目前针对结直肠癌最为有效的治疗手段,能够有效延长患者的生存时间,提高其生活质量[3]。然而研究发现,结直肠癌患者术后仍有较高的复发风险,对其预后产生不利影响。因此,寻求有效的临床指标评估结直肠癌患者的术后复发情况,对改善患者预后尤为重要。CD4+和CD8+T 淋巴细胞是机体重要的免疫调节细胞,在肿瘤细胞的增殖和转移过程中发挥积极的免疫调节作用[4]。缺氧诱导因子(hypoxia-inducible factor,HIF)-1α是一种具有转录活性的DNA 结合蛋白,与细胞增殖和凋亡具有紧密联系[5]。相关研究报道,CD4+/CD8+和HIF-1α均是结直肠癌手术患者预后的重要影响因素[6-7]。本研究探讨CD4+/CD8+联合HIF-1α检测对结直肠癌患者术后复发的评估价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2019 年5 月至2021 年5 月于平煤神马医疗集团总医院行腹腔镜手术治疗的结直肠癌患者。纳入标准:符合结直肠癌临床诊断标准[8],经病理检查确诊为结直肠癌;接受腹腔镜手术且术前检查及术后病理证实未发生淋巴结转移及远处转移。排除标准:合并其他恶性肿瘤;合并心、肺等器官严重疾病;既往有腹部重大手术史。依据纳入和排除标准,本研究纳入124 结直肠癌患者,肿瘤类型:结肠癌55 例,直肠癌69 例;临床分期:Ⅰ期60 例,Ⅱ期64 例;分化程度:低分化8 例,中分化73 例,高分化43 例。本研究经医院伦理委员会审批通过,所有患者均知情同意。
1.2 检测方法
术前采集所有患者空腹静脉血2 ml,分别取100 μl 抗凝全血加入2 个试管中,2 个试管各加入CD4、CD8 抗体20 μ l,室温避光孵育15 min,然后分别加入500 μl 细胞裂解液,振荡混匀后室温避光孵育10 min,采用免疫荧光标记技术检测上层血清中CD4+、CD8+T 淋巴细胞水平,计算CD4+/CD8+。
术前采集所有患者空腹静脉血2 ml,3000 r/min离心10 min 后取上层血清,采用酶联免疫吸附试验检测血清HIF-1α水平。
1.3 观察指标
比较不同临床特征结直肠癌患者的CD4+/CD8+和HIF-1α水平。根据复发情况将患者分为未复发组(n=100)和复发组(n=24),比较两组患者的CD4+、CD8+、HIF-1α水平及CD4+/CD8+,分析结直肠癌患者术后复发的影响因素。分析CD4+/CD8+、HIF-1α单独及联合检测对结直肠癌患者术后复发的评估价值。
1.4 统计学分析
采用SPSS 23.0 软件对数据进行统计分析,计数资料以例数和率(%)表示,组间比较采用χ2检验;符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验;采用Logistic 回归模型分析结直肠癌患者术后复发的影响因素;绘制受试者工作特征(receiver operating characteristic,ROC)曲线,分析CD4+/CD8+、HIF-1α单独及联合检测对结直肠癌患者术后复发的评估价值。以P<0.05 为差异有统计学意义。
2 结果
2.1 不同临床特征结直肠癌患者CD4+/CD8+和HIF-1α水平的比较
Ⅱ期结直肠癌患者的CD4+/CD8+明显低于Ⅰ期患者,HIF-1α水平明显高于Ⅰ期患者,差异均有统计学意义(t=5.196、5.934,P<0.01)。不同分化程度结直肠癌患者的CD4+/CD8+和HIF-1α水平比较,差异均有统计学意义(F=76.704、21.812,P<0.01),CD4+/CD8+随分化程度的升高而升高,HIF-1α水平随分化程度的升高而降低。(表1)
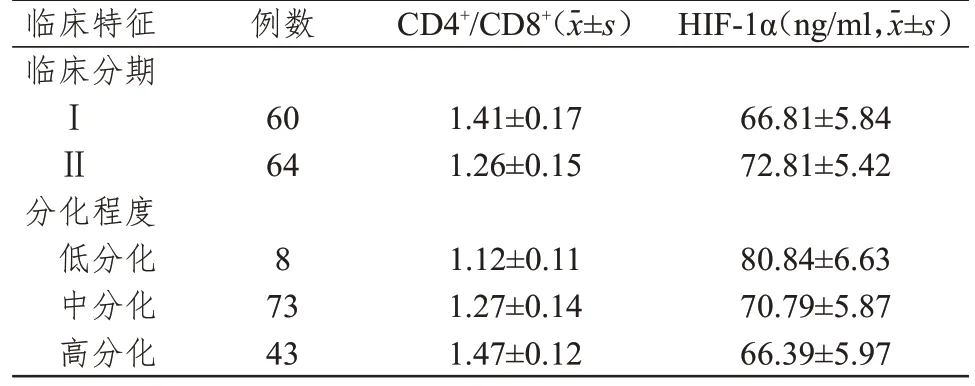
表1 不同临床特征结直肠癌患者的CD4+/CD8+和HIF-1α水平
2.2 复发组和未复发组患者CD4+、CD8+、HIF-1α水平及CD4+/CD8+的比较
复发组患者的CD4+水平及CD4+/CD8+均低于未复发组,CD8+、HIF-1α水平均高于未复发组,差异均有统计学意义(P<0.05)。(表2)
表2 复发组和未复发组患者CD4+、CD8+、HIF-1α水平及CD4+/CD8+的比较(±s)
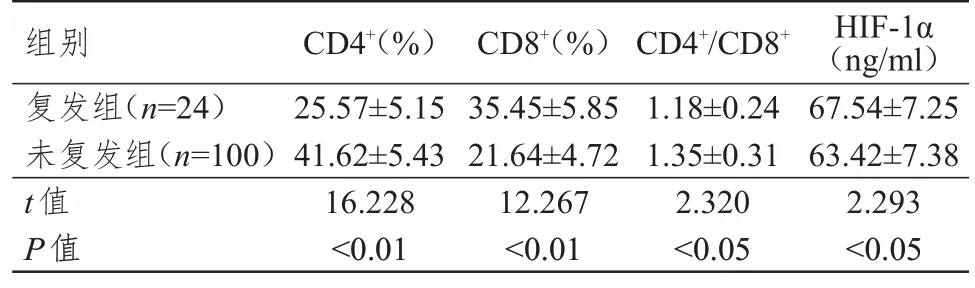
表2 复发组和未复发组患者CD4+、CD8+、HIF-1α水平及CD4+/CD8+的比较(±s)
组别复发组(n=24)未复发组(n=100)t值P值CD4+(%)25.57±5.15 41.62±5.43 16.228<0.01 CD8+(%)35.45±5.85 21.64±4.72 12.267<0.01 CD4+/CD8+1.18±0.24 1.35±0.31 2.320<0.05 HIF-1α(ng/ml)67.54±7.25 63.42±7.38 2.293<0.05
2.3 结直肠癌患者术后复发影响因素的多因素Logistic 回归分析
多因素Logistic 回归分析结果显示,CD8+、HIF-1α均是结直肠癌患者术后复发的独立危险因素(P<0.01),而CD4+和CD4+/CD8+均是结直肠癌患者术后复发的独立保护因素(P<0.01)。(表3)
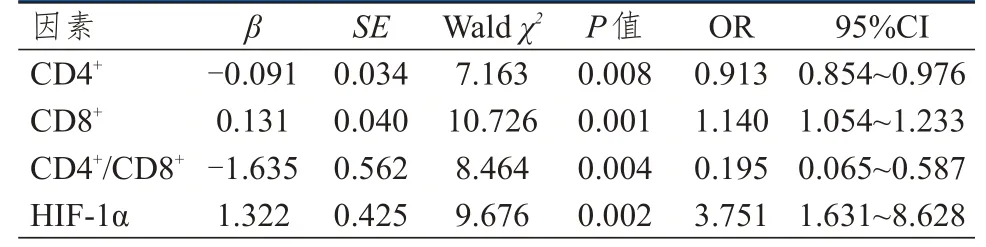
表3 结直肠癌患者术后复发影响因素的多因素Logistic回归分析
2.4 CD4+/CD8+、HIF-1α单独及联合检测对结直肠癌患者术后复发的评估价值
ROC 曲线显示,CD4+/CD8+联合HIF-1α检测评估结直肠癌患者术后复发的曲线下面积为0.872,高于CD4+/CD8+、HIF-1α单独检测的0.784、0.790。(表4、图1)
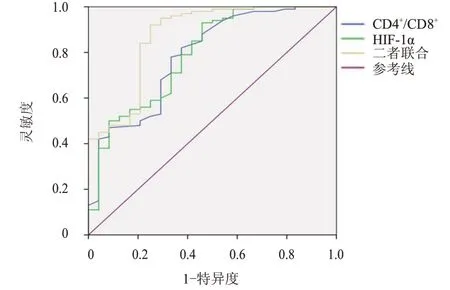
图1 CD4+/CD8+、HIF-1α单独及联合检测评估结直肠癌患者术后复发的ROC曲线
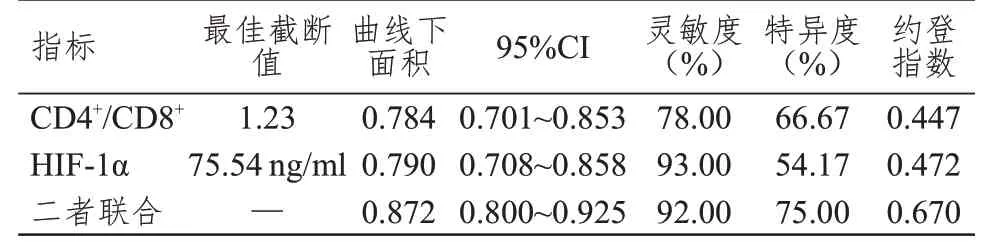
表4 CD4+/CD8+、HIF-1α单独及联合检测对结直肠癌患者术后复发的评估价值
3 讨论
结直肠癌作为病死率位居全球第二的恶性肿瘤,已对人类的生活质量和生命健康造成严重威胁[9]。研究证实,结直肠癌患者术后复发风险较高,而常规检查方法(如CT、B 超检查等)对患者术后复发风险的评估具有一定的局限性,因此需借助血清学指标进行评估[10]。张静等[11]研究指出,CD4+T 细胞对机体抗肿瘤免疫功能具有调节作用,而CD8+T 细胞可对肿瘤细胞进行特异性杀灭,因此CD4+/CD8+可直接反映机体的抗肿瘤免疫力。杨宁波等[12]研究表明,HIF-1α在多种类型肿瘤中呈高表达,可直接参与肿瘤进展、血管生成及肿瘤细胞转移等过程。然而CD4+/CD8+与HIF-1α联合检测对结直肠癌患者术后复发的评估价值少有报道,因此本研究探讨CD4+/CD8+联合HIF-1α检测对结直肠癌患者术后复发的评估价值,旨在为临床治疗结直肠癌及评估其预后提供参考。
本研究结果显示,Ⅱ期结直肠癌患者的CD4+/CD8+明显低于Ⅰ期患者,HIF-1α水平明显高于Ⅰ期患者,差异均有统计学意义(P<0.01);CD4+/CD8+随分化程度的升高而升高,HIF-1α水平随分化程度的升高而降低。表明CD4+、CD8+及HIF-1α在结直肠癌发生发展过程中发挥重要作用。相关研究指出,免疫功能低下是导致结直肠癌患者术后复发的因素之一[13]。刘梦瑶等[14]研究发现,CD4+T 细胞通过识别肿瘤细胞表面抗原,激活免疫系统,促进肿瘤细胞凋亡。于晓洁和丘木水[15]的研究表明,CD4+T 细胞可调节机体的免疫平衡,其水平与结直肠癌患者的预后呈正相关。CD8+T 细胞可分化出具有杀伤效应的细胞毒性T 细胞和具有免疫调节功能的调节性T 细胞,进而提高机体免疫力,杀灭肿瘤细胞[16-17]。HIF-1α可直接对肿瘤细胞的缺氧耐受性进行调控,通过激活机体内糖酵解相关因子,提高肿瘤细胞的缺氧耐受性及侵袭性,进而促进肿瘤发生浸润和转移[18]。孙艳丽等[19]研究指出,HIF-1α通过结合靶基因序列调控机体缺氧反应基因的表达,进而调节肿瘤细胞能量代谢平衡,保持肿瘤细胞供血供氧稳定。本研究结果还显示,复发组患者的CD4+水平及CD4+/CD8+均低于未复发组,CD8+、HIF-1α水平均高于未复发组,与相关研究报道的结果相似[20-21]。表明CD4+、CD8+T 细胞及HIF-1α均可能与结直肠癌复发有关。本研究的多因素Logistic 回归分析结果显示,CD8+、HIF-1α均是结直肠癌患者术后复发的独立危险因素(P<0.01),而CD4+和CD4+/CD8+均是结直肠癌患者术后复发的独立保护因素(P<0.01),与孙国钢和宋新江[22]的研究结果部分相同。本研究的ROC 曲线显示,CD4+/CD8+联合HIF-1α检测评估结直肠癌患者术后复发的曲线下面积为0.872,高于CD4+/CD8+、HIF-1α单独检测的0.784、0.790。表明CD4+/CD8+联合HIF-1α检测对结直肠癌患者术后复发具有一定的评估价值。
综上所述,CD4+/CD8+联合HIF-1α检测对结直肠癌患者术后复发具有一定的评估价值,可为临床干预及治疗提供参考。

