基于铁死亡相关基因骨肉瘤预后模型的构建与验证△
范以东,秦刚,刘金富,苏国威,肖世富,刘俊良,李威材,吴广涛
1广西中医药大学研究生院,南宁 530222
2广西中医药大学第一附属医院骨病创伤骨科,南宁 530022
骨肉瘤(osteosarcoma,OS)是一种主要由间充质细胞引起的恶性肿瘤,主要发生在长管状骨中[1]。OS 是发病率仅次于多发性骨髓瘤的第二常见的原发性骨恶性肿瘤,占所有骨肿瘤的15%[2]。随着医疗水平的提升,OS 患者的5 年生存率可达到70%,但治疗效果不佳且转移的患者,其5 年生存率低于30%[3]。虽然新辅助化疗的出现提高了OS 患者的5 年生存率,但OS 患者的生存情况仍然较差。二代测序(next-generation sequencing,NGS)技术的出现彻底改变了临床研究、基础医学和应用医学,通过NGS 技术有可能发现新的预后生物标志物,为OS 患者的个体化治疗提供依据,有助于预测患者预后和提高治疗效果[4]。因此,确定新的靶点至关重要。铁死亡是一种铁依赖性,区别于坏死和凋亡的细胞死亡模式,其特征在于脂质活性氧(reactive oxygen species,ROS)的积累[5],由Stockwell 等于2012 年首次提出[6]。铁死亡在细胞形态学和生物学方面各有特点,形态学方面表现为线粒体体积变小、双层膜密度增加、线粒体嵴减少或消失,生物学方面主要表现为谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)失活,导致脂质过氧化物积累,Fe2+氧化脂质产生ROS,从而发生铁死亡[7]。研究表明,铁死亡可以影响多种肿瘤的发生发展,包括结直肠癌[8]、胶质母细胞瘤[9]、乳腺癌[10]、胃癌[11]等。本研究应用生物信息学方法通过公共数据库探讨铁死亡相关基因(ferroptosis related gene,FRG)在OS 中的表达及与患者预后的关系,并分析FRG 在OS 中的作用机制,构建FRG相关的OS 预后模型,旨在为OS 的诊断、治疗及预后评估提供参考依据,现报道如下。
1 材料与方法
1.1 数据来源与整理
从UCSC Xena 数据库(http://xena.ucsc.edu/)中获取88例OS患者的转录组测序数据和其中85例患者的临床资料(2 例患者生存状态不明,1 例患者总生存时间不明,故予以删除)。在基因型-组织表达(Genotype-Tissue Expression,GTEx)数据库(https://www.gtexportal.org/home/)中获取396例正常骨组织样本,对所有GTEx 数据进行log2(x+1)转换。使用“limma”包对数据进行合并和矫正。从FerrDb数据库(http://www.zhounan.org/ferrdb)中下载FRG,所有数据下载截止日期为2022年12月12日。
1.2 获取差异表达的FRG
以错误发现率(false discovery rate,FDR)<0.05,|log2FC|≥2 为过滤条件筛选正常骨组织与OS组织中的差异表达基因。从筛选的差异基因列表中进一步提取差异表达的FRG。
1.3 基因富集分析
利用R 语言“org.Hs.eg.db”“enrichplot”包对差异表达的FRG 进行基因本体(Gene Ontology,GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析,探索OS 中FRG 的生物学功能。
1.4 预后模型的构建
采用单因素Cox 回归模型分析差异表达的FRG 对OS 患者总生存期的影响,初步筛选与预后相关的基因。然后使用R 语言“glmnet”包进行最小绝对收缩和选择算子(least absolute shrinkage and selection operator,Lasso),最终依据最佳λ值构建一个基于FRG 的预后模型。每例患者的风险值公式:风险值=,其中xi为每个FRG 的表达量,Coefi为相应的基因系数,将其求和后即为该患者的风险评分。根据风险评分的中位值将患者分为高风险组和低风险组。
1.5 预后模型的分析
应用R 语言“survival”包绘制高风险组和低风险组患者的生存曲线,比较两组患者的生存情况,采用受试者工作特征(receiver operating characteristic,ROC)曲线分析总体风险评分对预后的预测价值。应用R 语言“pheatmap”包绘制两组患者的风险评分、生存状态分布图和模型基因表达热图。对两组患者进行主成分分析(principal component analysis,PCA),观察两组患者的分布是否具有差异。同时分析风险评分、转移情况和性别是否为OS 患者预后的独立影响因素。
1.6 单基因富集分析
为探究预后相关基因在OS 进展过程中的潜在机制,采用单基因基因集富集分析(gene set enrichment analysis,GSEA)预测9 个预后相关基因的KEGG 下游途径。通过R 语言“clusterProiler”包对9 个预后相关基因进行单基因GSEA 分析,将基因表达矩阵中的正常样本删除,保留肿瘤样本作为GSEA 分析的输入文件。同时在MSigDB 数据库(https://www.gsea-msigdb.org/gsea/msigdb)中下载“c2.cp.kegg.v7.5.1.symbols.gmt”基因集,用以评估可能的相关途径。|NES|>1、p-val<0.05、q-val<0.25 的通路被认为是显著富集的,展示富集最显著的前5 条通路。
1.7 预后相关基因的验证
1.7.1 预后相关基因的选择 通过查阅文献发现,酰基辅酶A 合成酶家族成员2(acyl-CoA synthetase family member 2,ACSF2)、脂肪酸去饱和酶2(fatty acid desaturase 2,FADS2)在OS 的相关研究中仍是空白,而参与预后模型构建的其他基因与OS 的关系已有了一定的研究。因此,本研究选择ACSF2、FADS2作为验证的目标基因。
1.7.2 仪器与设备 U2OS、MG63 细胞系购自武汉普诺赛生命科技有限公司,hFOB1.19(人SV40 转染成骨细胞)及hFOB1.19 细胞专用培养基均购自上海沪震生物科技有限公司,去基因组与逆转录一管化三代预混液(MR05101M)购自莫纳生物科技有限公司,荧光定量聚合酶链反应(quantitative polymerase chain reaction,qPCR)仪Light-Cycler®96 购自瑞士Roche 公司,梯度PCR 仪Biometra Tone 96 购自德国耶拿公司,超微量分光光度计NANODROP ONE 购自美国Thermo Fisher Scientific 公司。
1.7.3 细胞培养 以hFOB1.19 成骨细胞系作为对照组,OS 细胞系U2OS 和MG63 作为实验组。应用hFOB1.19 细胞专用培养基培养hFOB1.19 细胞,培养基包含DMEM/F12、0.3 g/L G418 及10%胎牛血清,将细胞置于34 ℃、5%CO2培养箱中孵育,隔2天更换1 次新的培养基。当瓶壁细胞密度达90%左右时,按1∶2 传代。U2OS、MG63 细胞在37 ℃、5%CO2培养箱中孵育。
1.7.4 qPCR 检测ACSF2、FADS2基因表达 当细胞培养至密度达90%左右时,应用Trizol 法提取样本总RNA,并采用MR05101M 合成互补DNA(complementary DNA,cDNA),然后进行qPCR。反应条件:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火30 s,共40 个循环。以β-肌动蛋白(β-actin)作为内参,采用2-△△Ct法计算ACSF2、FADS2mRNA 相对表达量。设置3 个复孔并计算均数和标准差,引物序列见表1。

表1 β-actin、FADS2、ACSF2 引物序列
1.8 统计学方法
采用R 语言4.1.1 版对生物信息学数据进行统计分析,采用Lasso 回归分析筛选预后相关基因并构建预后模型;采用Kaplan-Meier 法绘制生存曲线,组间比较采用Log-rank 检验;采用ROC 曲线评估预后模型对OS 患者1、3、5 年生存率的预测价值;采用单因素和多因素Cox 回归模型分析OS 患者总生存期的独立影响因素。采用GraphPad Prism 8.4.0 软件对qPCR 实验数据进行统计分析,符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,多组间两两比较采用LSD-t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 差异表达的FRG
通过差异分析共获得表达上调基因1404 个,下调基因1597 个。从FerrDb 数据库中共下载得到258 个FRG,将其与正常骨组织和OS 组织中的差异表达基因取交集,共得到57 个差异表达的FRG。(图1)
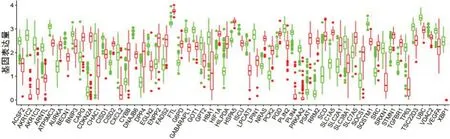
图1 差异表达基因的箱线图
2.2 GO 及KEGG 富集分析
GO 富集分析结果显示,在生物过程(biological process,BP)方面,FRG 主要与对营养水平的反应、缺氧反应、细胞对化学应激的反应等有关;在细胞成分(cellular component,CC)方面,FRG 主要与线粒体外膜、细胞器外膜、黑素体等有关;在分子功能(molecular function,MF)方面,FRG 主要与铁离子结合、泛素样蛋白连接酶结合、转氨酶活性等有关。KEGG 通路富集分析结果显示,FRG 主要参与多种疾病的神经退行性变、线粒体自噬、化学致癌-活性氧以及铁死亡等途径。(图2)
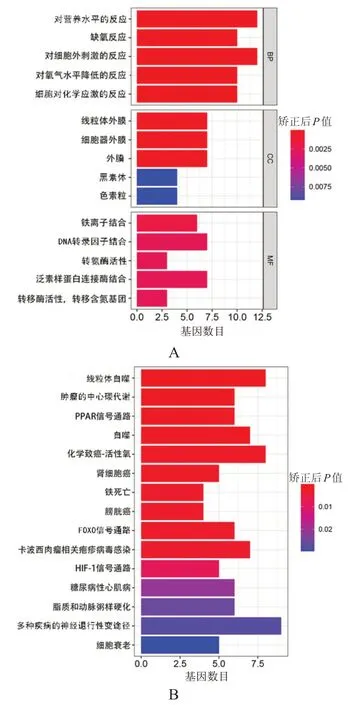
图2 OS中FRG基因的GO和KEGG富集分析
2.3 预后模型的构建
采用单因素Cox 回归模型分析差异表达的FRG对患者总生存期的影响,共得到12个预后相关基因,绘制森林图(图3A)。随后将上述12 个基因纳入Lasso 回归模型进一步筛选,回归模型的类型为Cox,采用10 倍交叉验证,最大迭代次数设为1000,筛选最佳lambda 值来确定最优模型,最终得出预后最相关的9 个FRG(图3B、3C)。其中,B 细胞淋巴瘤/白血病-2 相互作用蛋白3(B-cell lymphoma/leukemia-2 interacting protein 3,BNIP3)、FADS2、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)为高风险基因,ACSF2、芳香烃受体核转运因子样蛋白(aryl hydrocarbon receptor nuclear translocator like,ARNTL)、葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)、细胞因子信号转导抑制因子1(suppressor of cytokine signaling 1,SOCS1)、转化生长因子β受体1(transforming growth factor beta receptor 1,TGFBR1)、磷酸葡萄糖酸脱氢酶(phosphogluconate dehydrogenase,PGD)为低风险基因,分别计算每例患者的风险评分,按照风险评分的中位值将患者分为高风险组(42 例)和低风险组(43 例)。
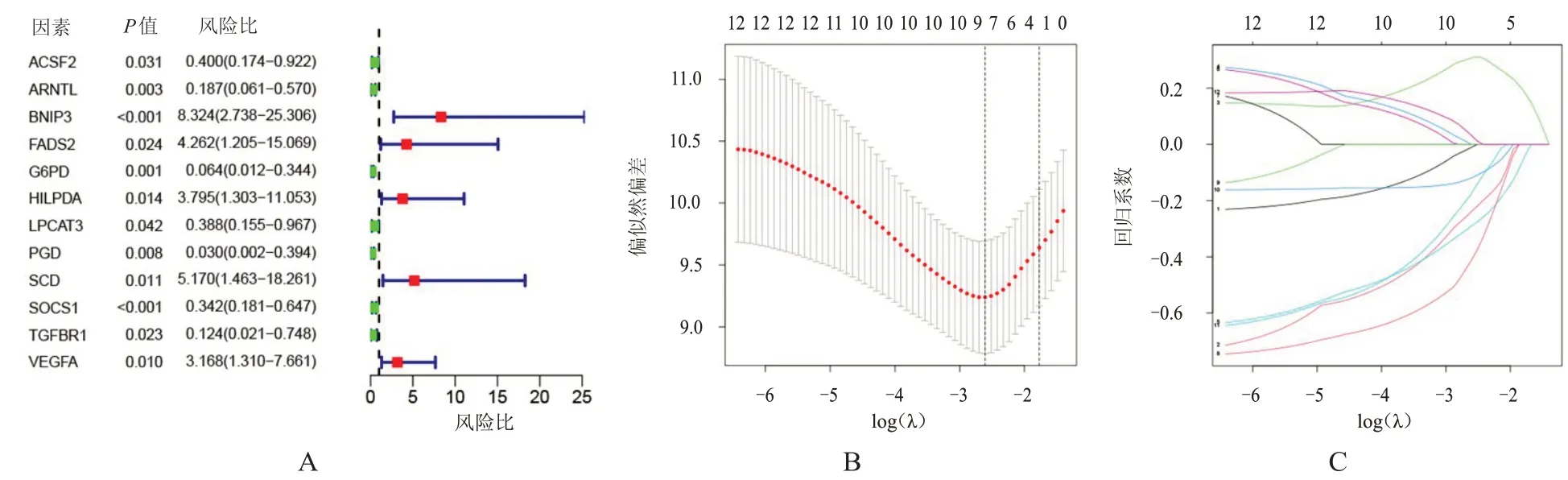
图3 预后模型基因的筛选
2.4 预后模型分析
将高风险组和低风险组患者进行PCA,从图中点的分布可以看出两组患者的分布具有显著差异,以PC1 为分割线,低风险组患者主要分布在图中的左侧,高风险组患者主要分布在右侧(图4A)。生存分析显示,低风险组患者的生存情况明显优于高风险组,差异有统计学意义(P<0.01)(图4B)。使用ROC 曲线验证风险评分对OS 患者1、3、5 年生存率的预测价值,结果显示,风险评分预测OS 患者1、3、5 年生存率的曲线下面积分别为0.815、0.845、0.838(图4C)。在风险曲线中,随着风险评分的增大,死亡患者逐渐增加,生存时间逐渐缩短(图5A、5B)。风险热图显示,随着风险评分的增大,BNIP3、FADS2、VEGFA的表达量增加,ACSF2、ARNTL、G6PD、SOCS1、TGFBR1、PGD的表达量降低(图5C)。
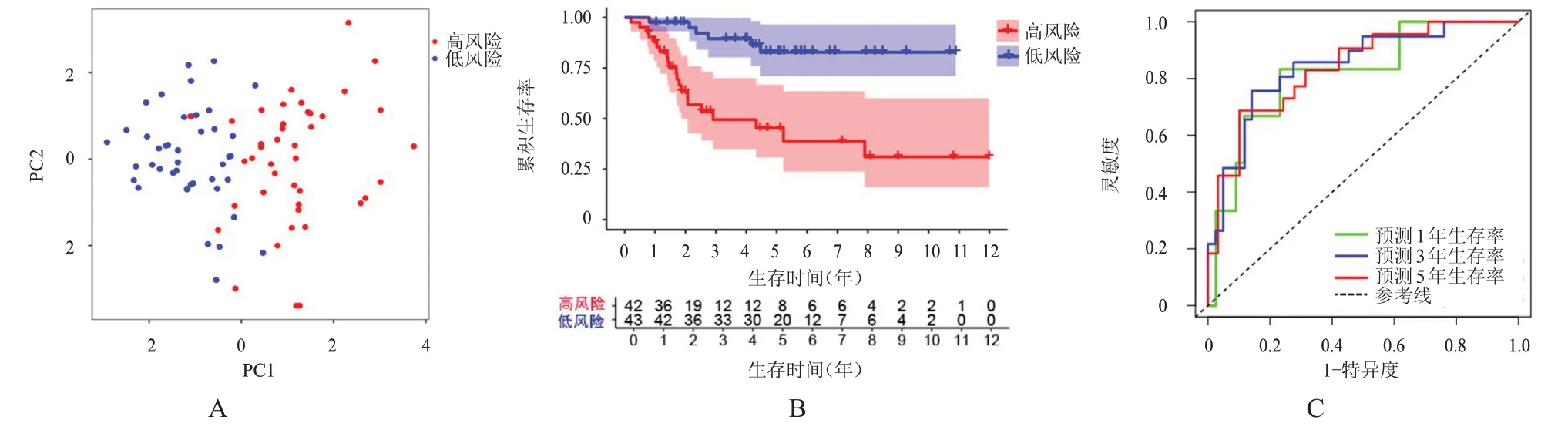
图4 高风险组(n=42)和低风险组(n=42)OS患者的生存分析与预后预测
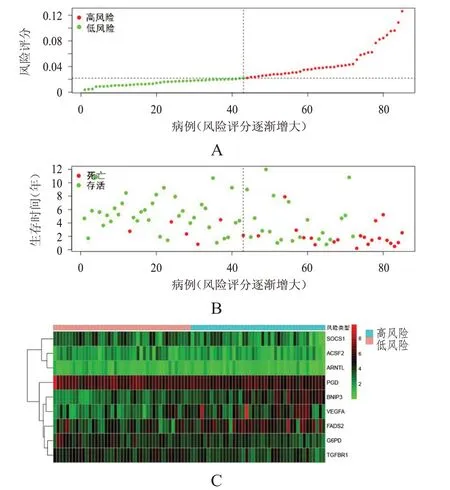
图5 预后模型中OS患者生存风险状态图
2.5 预后影响因素分析
单因素和多因素分析结果显示,转移和风险评分均是OS 患者预后的独立影响因素(P<0.01),性别不是OS患者预后的独立影响因素(P>0.05)。(图6)
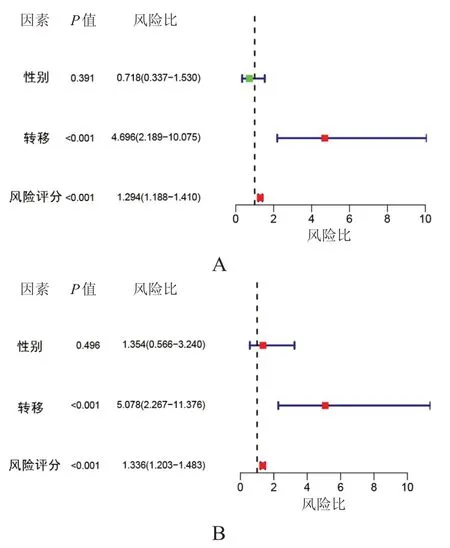
图6 OS患者预后的影响因素分析
2.6 单基因GSEA 分析
GSEA 结果显示,这些预后相关基因主要与原发性免疫缺陷、趋化因子信号通路、嗅觉转导、自噬的调控、维甲酸诱导基因-Ⅰ(retinoic acid inducible gene-Ⅰ,RIG-Ⅰ)样受体信号通路、剪接体、细胞质DNA 感应通路等密切相关。其中,PGD与VEGFA未发现符合条件的显著富集通路。(图7)
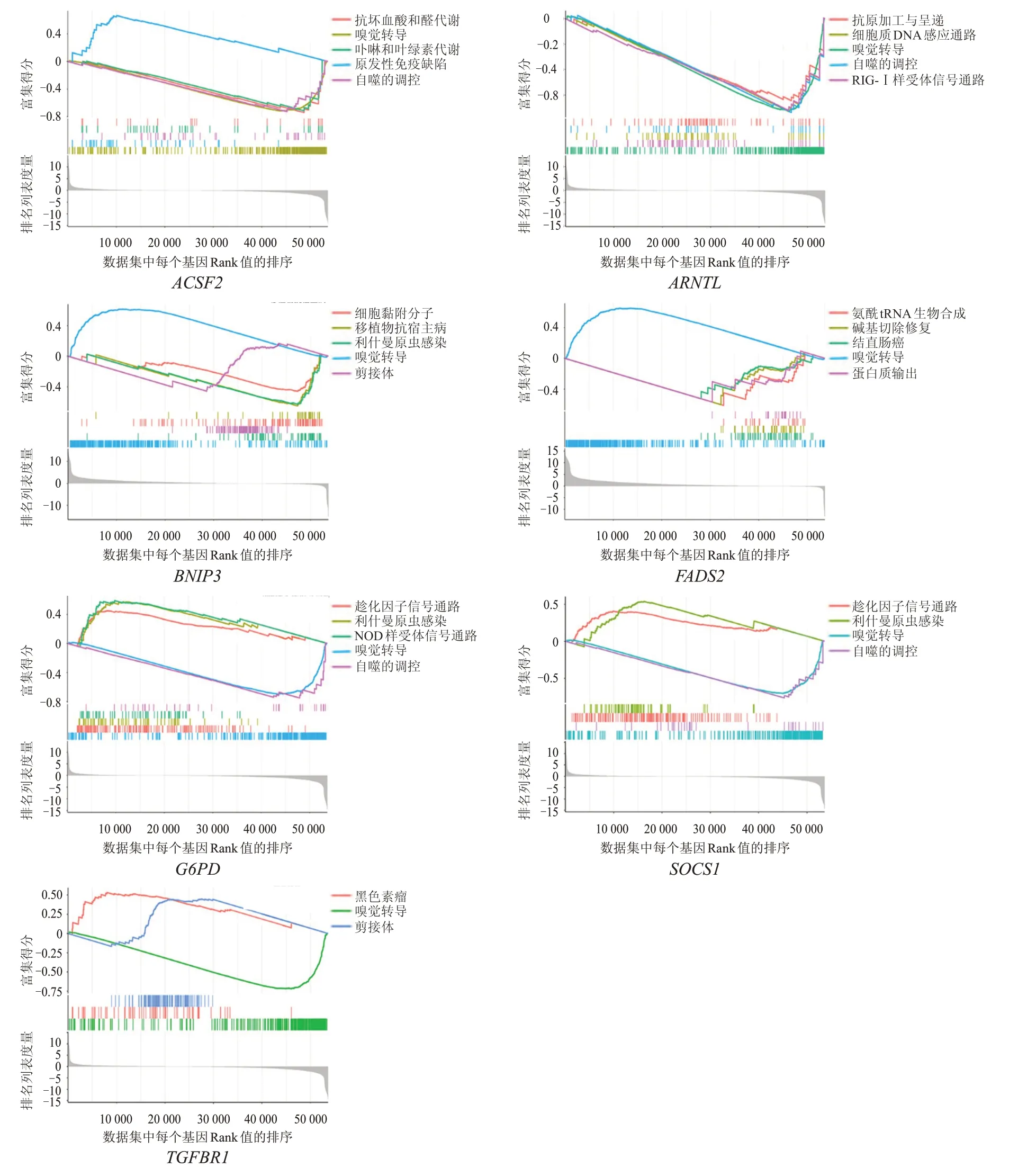
图7 OS患者预后相关基因的单基因GSEA分析
2.7 ACSF2、FADS2 mRNA 相对表达量的比较
U2OS 和MG63 细胞中FADS2mRNA 相对表达量均高于hFOB1.19细胞,差异均有统计学意义(P<0.05);MG63 细胞中ACSF2mRNA 相对表达量高于hFOB1.19 细胞,差异有统计学意义(P<0.05)。hFOB1.19 和U2OS 细胞中ACSF2mRNA 相对表达量比较,差异无统计学意义(P>0.05)。(表2)
表2 不同细胞中ACSF2、FADS2 mRNA相对表达量的比较(±s)
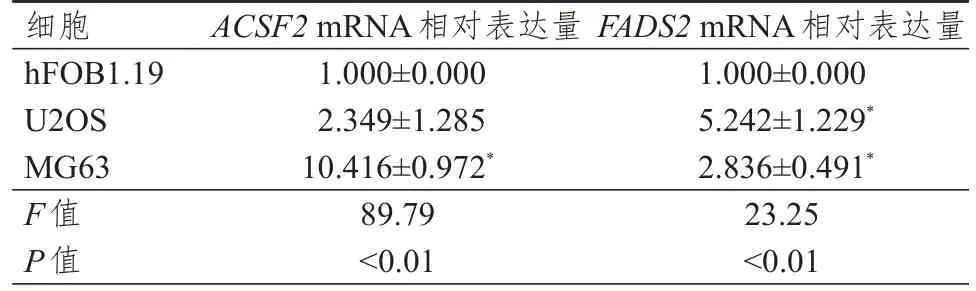
表2 不同细胞中ACSF2、FADS2 mRNA相对表达量的比较(±s)
注:*与hFOB1.19细胞比较,P<0.05
细胞hFOB1.19 U2OS MG63 F值P值ACSF2 mRNA相对表达量1.000±0.000 2.349±1.285 10.416±0.972*89.79<0.01 FADS2 mRNA相对表达量1.000±0.000 5.242±1.229*2.836±0.491*23.25<0.01
3 讨论
虽然新辅助化疗的出现提高了OS 患者的无复发生存率和总生存率,但随后的几十年间,OS 的治疗效果并没有得到太大提升,似乎到了瓶颈期[12]。铁死亡自2012 年被提出后,10 余年间相关研究不断增多,逐渐成了医学领域的研究热点,在多种类型的肿瘤中均有相应研究。虽然有研究表明铁死亡与OS 的发生发展关系密切,但其作用机制尚不清楚。通过生物信息学探索与预后有关的FRG 有望成为一种突破OS 治疗瓶颈的新方法。
本研究筛选出57 个差异表达的FRG,通过GO与KEGG 富集分析发现,这些FRG 与缺氧反应、线粒体外膜、细胞器外膜、铁离子结合等有关,FRG主要参与多种疾病的神经退行性变、线粒体自噬、化学致癌-活性氧以及铁死亡等途径,这些均与肿瘤的发生发展密切相关。缺氧反应在体内肿瘤微环境中具有重要地位。有研究表明,缺氧条件促进了OS 细胞的侵袭和迁移[13]。
本研究筛选了9 个基因进行预后模型的构建。ACSF2 主要位于线粒体内,可以通过与辅酶A(coenzyme A,CoA)形成硫酯来催化脂肪酸代谢中的初始反应[14]。研究发现,ACSF2 在溃疡性结肠炎中表达显著下调,且与免疫相关通路显著相关,铁死亡抑制剂可逆转ACSF2的表达,证明ACSF2在介导铁死亡过程中具有重要作用[15]。FADS2是铁死亡的限速因子,具有催化脂肪酸去饱和的作用,可诱导宿主细胞中的铁死亡,并阻碍丙型肝炎病毒的复制[16]。ARNTL是哺乳动物生物钟的核心组成部分,可通过抑制egl-9家族缺氧诱导因子2(egl-9 family hypoxia inducible factor 2,EGLN2)的转录来抑制铁死亡,而阻断ARNTL降解或抑制EGLN2活化可以诱导铁死亡发生[17]。G6PD 被认为是肝细胞癌患者预后的危险因素,可通过抑制细胞色素p450 氧化还原酶(cytochrome p450 oxidoreductase,POR)的表达促进肿瘤细胞生长、侵袭和转移,同时减少铁死亡[18]。PGD可以减少细胞中的糖酵解,增加戊糖磷酸途径(pentose phosphate pathway,PPP),从而保护细胞免受ROS 的侵害[19]。铁死亡与ROS 关系密切,未来需要更多研究探索PGD 与铁死亡之间的关系。SOCS1是细胞因子信号转导抑制因子家族成员,在细胞生长和分化过程中发挥重要作用,可通过与p53 相互作用抑制肿瘤发生发展[20]。溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11)和亚精胺/精胺N1-乙酰转移酶1(spermidine/spermine N1-acetyltransferase 1,SAT1)在铁死亡过程中具有关键作用,且SOCS1 能够抑制谷胱甘肽(glutathione,GSH)的表达,证明SOCS1 能够提高细胞对铁死亡的敏感性[21]。TGFBR1又称激活素受体样激酶(activin receptor-like kinase,ALK)4/5,在细胞中主要参与氧化应激反应[22]。在肾近端肾小管上皮细胞中,ALK4/5 信号通路已被证明与铁死亡相关,阻断ALK4/5 信号通路可抑制铁死亡[23]。VEGFA 被认为是一种重要的血管生长因子,研究发现,当子宫内膜基质细胞发生铁死亡时,p38-促分裂原活化的蛋白激酶(mitogen-activated protein kinase,MAPK)/信号转导及转录激活因子6(signal transduction and activator of transcription 6,STAT6)信号转导会抑制VEGFA 和白细胞介素-8(interleukin-8,IL-8)的表达[24]。因此,铁死亡可能通过旁分泌VEGFA和IL-8对邻近病变产生血管生成作用,从而在子宫内膜异位症的进展过程中发挥关键作用。
本研究成功构建了基于FRG 的骨肉瘤风险预后模型,发现ACSF2、ARNTL、G6PD、PGD、FADS2、SOCS1、BNIP3、TGFBR1、VEGFA等9 个FRG 能够作为OS 患者的预后生物标志物,并采用qPCR 技术验证了ACSF2和FADS2在OS 细胞与正常成骨细胞中的表达情况,为OS 患者的临床治疗和预后评估提供了参考。然而本研究也存在一定的局限性,需要更多的样本及基础研究进一步验证。

