硫唑嘌呤联合美沙拉嗪治疗溃疡性结肠炎的效果分析
王国瑞,张威,邓平
溃疡性结肠炎(ulcerative colitis,UC)是一种主要病变于直肠、结肠黏膜层的慢性肠道炎性疾病,病因尚不明确,临床症状主要为腹泻、腹痛、便血等,可发作于任何年龄段,严重影响患者身心健康[1]。临床常采用激素类、5-氨基水杨酸类及免疫抑制剂类药物治疗UC,但约有30%患者会在接受激素治疗后复发,产生激素抵抗型UC[2]。美沙拉嗪是一种水杨酸制剂,具有抗炎作用,但其单独治疗UC疗效并不理想[3]。硫唑嘌呤是一种免疫抑制剂,目前已逐渐应用于炎症性肠病的治疗当中,可抑制免疫功能[4]。本研究选取我院收治的64例UC患者为研究对象,旨在探讨美沙拉嗪与硫唑嘌呤联合治疗的效果及对患者肠黏膜屏障功能、氧化应激反应、炎症因子水平的影响。现报告如下。
1 资料与方法
1.1 一般资料 经我院医学伦理委员会审核通过(审批号:202004023),选取我院2021年1月—2023年1月收治的UC患者64例为研究对象,依据随机抽签法分为对照组和联合组,各32例。其中对照组男15例,女17例;年龄24~55(39.72±7.59)岁;病程9~28(18.53±4.57)个月;病情程度:中度23例,重度9例。联合组男14例,女18例;年龄25~56(40.08±7.54)岁;病程10~29(19.24±4.62)个月;病情程度:中度22例,重度10例。2组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 入选标准 纳入标准:(1)符合《炎症性肠病诊断与治疗的共识意见》[5]中相关标准;(2)经检查确诊为UC;(3)病情程度为中度或重度;(4)为激素抵抗型溃疡性结肠炎;(5)经基因检测后证实可使用本研究药物;(6)患者或其家属知情本研究且签署同意书。排除标准:(1)病情程度为轻度;(2)研究前1个月使用过抗生素、糖皮质激素、止泻药等;(3)有腹部手术史;(4)伴有严重并发症;(5)对本研究药物过敏;(6)合并免疫系统疾病;(7)合并其他胃肠道疾病;(8)伴有血液系统疾病。
1.3 方法 治疗期间嘱患者饮食清淡,禁烟禁酒,忌饮咖啡、浓茶,给予营养支持,不另外使用抗生素或益生菌治疗。
1.3.1 对照组 采用美沙拉嗪肠溶片(葵花药业集团佳木斯鹿灵制药有限公司,国药准字H19980148,规格:0.25 g)治疗,1克/次,3次/天。
1.3.2 联合组 采用硫唑嘌呤片(上海上药信谊药厂有限公司,国药准字H31021422,规格:50 mg)联合美沙拉嗪肠溶片治疗,美沙拉嗪用法用量同对照组,硫唑嘌呤1.5毫克/千克/次,1次/天,最多不超过100 mg/d。2组均持续服药4周。
1.4 观察指标 (1)临床疗效。 于治疗前、治疗4周后行结肠镜检查,依据Baron评分[6]评估肠黏膜状态。显效:治疗后结肠镜检查结果显示肠黏膜恢复正常或基本正常,便血、腹痛、腹胀、腹泻等临床症状消失,溃疡面愈合;有效:结肠镜检查结果显示肠黏膜恢复,便血、腹痛、腹胀、腹泻等症状发生次数较治疗前明显减少;无效:未达到上述标准。总有效率=1-无效率。(2)肠道菌群计数。治疗前、治疗4周后采集患者0.5 g大便标本,连续稀释10倍后接种在培养基上,计算每1 g大便湿重内肠球菌、大肠埃希菌、乳酸杆菌及双歧杆菌计数。(3)肠黏膜屏障功能指标。比较2组治疗前、治疗4周后尿淀粉酶(UAMY)、D-乳酸(D-LA)、二胺氧化酶(DAO)水平,抽取患者静脉血,以3 000 r/min离心10 min后取上清液,置于-50 ℃环境中待检,UAMY采用速率法检测,DAO采用酶联免疫吸附法(ELISA)检测,D-LA采用比色法检测。(4)氧化应激水平。 比较2组治疗前、治疗4周后超氧化物歧化酶(SOD)、丙二醛(MDA)及过氧化脂质(LPO)水平,取上述血清,采用ELISA法检测。(5)炎症因子水平。 比较2组治疗前、治疗4周后干扰素(INF-γ)、白细胞介素(IL-1β、IL-17、IL-23)水平,取上述血清,采用ELISA法检测。(6)不良反应发生情况。 包括骨髓抑制、皮疹、黏膜出血等。

2 结果
2.1 2组临床疗效比较 联合组临床总有效率高于对照组,差异有统计学意义(P<0.05)。见表1。
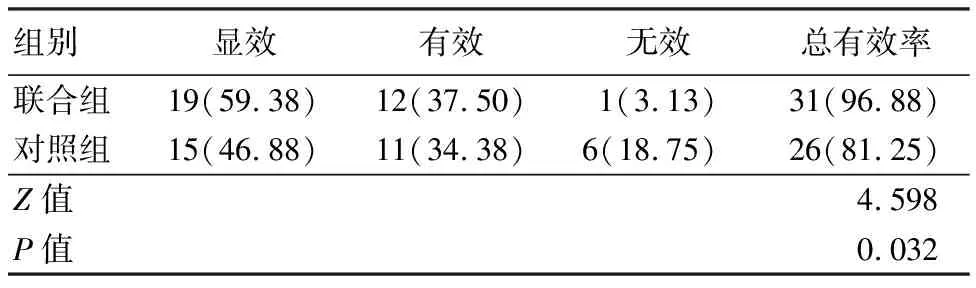
表1 2组临床疗效比较 (n=32)
2.2 2组肠道菌群计数比较 治疗前,2组肠道菌群计数比较差异无统计学意义(P>0.05)。治疗后,2组肠球菌、大肠埃希菌计数均低于治疗前,且联合组低于对照组;2组乳酸杆菌、双歧杆菌计数均高于治疗前,且联合组高于对照组,差异有统计学意义(P<0.05)。见表2。
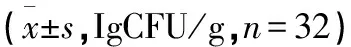
表2 2组肠道菌群计数比较
2.3 2组肠黏膜屏障功能指标比较 治疗前,2组肠黏膜屏障功能指标比较差异无统计学意义(P>0.05);治疗后,2组D-LA、UAMY及DAO水平均低于治疗前,且联合组低于对照组,差异有统计学意义(P<0.05)。见表3。

表3 2组肠黏膜屏障功能指标比较
2.4 2组氧化应激水平比较 治疗前,2组氧化应激水平比较差异无统计学意义(P>0.05)。治疗后,2组SOD水平均高于治疗前,且联合组高于对照组;2组LPO、MDA水平均低于治疗前,且联合组低于对照组,差异有统计学意义(P<0.05)。见表4。

表4 2组氧化应激水平比较
2.5 2组炎症因子水平比较 治疗前,2组炎症因子水平比较差异无统计学意义(P>0.05);治疗后,2组IL-1β、IL-17、INF-γ及IL-23水平均低于治疗前,且联合组低于对照组,差异有统计学意义(P<0.05)。见表5。

表5 2组炎症因子水平比较
2.6 2组不良反应发生率比较 治疗期间,联合组出现骨髓抑制3例、皮疹1例、黏膜出血1例,不良反应发生率为15.63%(5/32);对照组出现骨皮疹2例,不良反应发生率为6.25%(2/32)。2组不良反应发生率比较差异无统计学意义(χ2=0.642,P=0.423)。
3 讨论
UC是一种病程长、易反复的弥漫性炎性疾病,可能与基因、免疫异常、炎性反应等有关,严重影响患者日常生活。美沙拉嗪是一种属于5-氨基水杨酸制剂的抗炎药物,可缓解UC患者临床症状,鲁峻等[7]研究显示其对UC患者的疗效可达70%,但该药需长时间服用且较易出现副作用,单一用药疗效欠佳。硫唑嘌呤属于免疫抑制剂,可抑制核酸合成,减轻激素依赖[8]。正常情况下,人体菌群处于平衡状态,但当肠球菌及大肠埃希菌等致病菌水平升高或移位时可导致肠道感染等疾病,而双歧杆菌及乳酸菌为有益菌,可抑制有害菌生长[9]。本研究结果显示,治疗后,联合组临床疗效高于对照组,肠道菌群改善程度大于对照组,提示美沙拉嗪联合硫唑嘌呤治疗UC可提高疗效,改善肠道菌群平衡。多项研究[10-11]证实,肠黏膜屏障功能异常是导致UC的主要因素,当肠道黏膜受损时会引起炎症反应。D-LA可反映肠道通透性,DAO可反映肠黏膜结构完整性,二者水平升高则表示黏膜功能受损,且此时UAMY在UC患者体内常呈高表达[12-14]。本研究结果显示,治疗后,联合组肠黏膜功能指标水平低于对照组,提示联合治疗可改善肠黏膜受损,促进肠黏膜恢复。
有研究[15]指出,氧自由基水平升高可导致炎症反应加剧,而炎症及氧化应激在UC病情发展中有着重要作用。UC患者体内炎症会刺激活性氧自由基分泌,引起肠黏膜脂质过氧化损伤,最终导致溃疡形成。SOD具有抗氧化作用,可抑制活性氧自由基的产生;LPO可参与UC的病情发展过程;MDA可用于评价脂质过氧化及氧化应激程度,与病情相关[16-17]。本研究探讨美沙拉嗪联合硫唑嘌呤治疗对INF-γ及IL-1β的影响,其中IL-1β具有促进炎症因子合成、释放的作用,可促使病情发展;IL-17、INF-γ及IL-23均为促炎因子,会破坏肠黏膜,损害肠道内细胞[18-19]。结果显示,治疗后,联合组SOD水平高于对照组,LPO、MDA及炎症因子水平均低于对照组,提示联合治疗能有效改善患者氧化应激反应,抑制炎症发展。分析其原因在于,美沙拉嗪可通过抑制白三烯及前列腺素的合成抑制炎症,硫唑嘌呤可通过抑制T淋巴细胞核酸的合成,进而达到缓解肠道损伤的效果,二者协同作用可从多途径抑制炎症,改善黏膜损害,促进病情恢复[20]。本研究还显示,治疗期间2组不良反应发生率比较差异无统计学意义,表明联合治疗不会增加不良反应发生率,安全性有保障。
综上所述,硫唑嘌呤联合美沙拉嗪治疗UC患者疗效显著,可改善患者肠道菌群失衡状态及氧化应激反应,抑制炎性反应,促进肠黏膜功能恢复。但本研究未对患者进行随访,远期疗效不明,有待后续开展长期随访,延长观察时间,以探讨远期疗效。

