超声次谐波辅助压力估测技术的影响因素
张艳芬 郑 帅 陈治光 程令刚 汪洪斌 李 睿 张雨康 张 巍 何 文*
(1. 首都医科大学附属北京天坛医院超声科,北京 100050;2. 南华大学衡阳医学院附属长沙中心医院超声诊断科,长沙 410007)
次谐波辅助压力检测(subharmonic-aided pressure estimation, SHAPE)是一种基于微气泡非线性振荡的压力估测技术[1],在适当的环境压力下,微气泡会在驱动频率的二分之一处产生次谐波信号[2-3],通过利用生长阶段次谐波信号幅度无创估算静水压[4]。影响次谐波产生及信号强度的因素,和确定与压力相关的次谐波信号范围机械指数 (mechanical index,MI)范围,均可能会影响SHAPE技术测压的稳定性及准确性。因此,明确并定量分析SHAPE技术的影响因素,并确定临床使用超声造影剂进行SHAPE技术测压时,最佳的造影剂浓度及流速,对临床有效利用SHAPE技术进行无创压力监测具有重要意义。
1 材料与方法
1.1 材料与设备
实验装置包括水槽(长95 cm、宽95 cm、高85 cm)、500 mL 0.9%(质量分数)氯化钠注射液(以下简称生理盐水)、带流速控制阀输液管(内径3.5 m)(图1)。
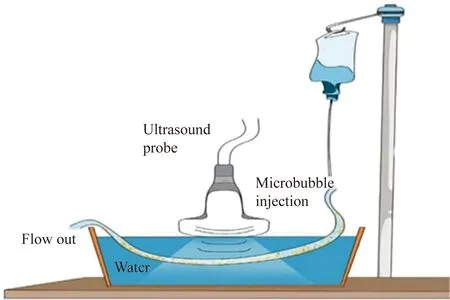
图1 体外模拟实验装置示意图Fig.1 Schematic diagram of the in vitro simulation experimental device
仪器设备: 带有凸阵4C探头的超声扫描仪(Logic E20, GE Healthcare, Waukesha, WI,美国)。
超声造影剂:示卓安(sonazoid,GE Healthcare, Oslo, Nor way,美国),氢化卵磷脂酰丝氨酸膜包裹的全氟丁烷气体[直径为(2.6±0.1)μm],生理盐水。
1.2 操作方法
(1)不同浓度超声造影剂微泡制备:sonazoid冻干粉1支16 μL全氟丁烷微球融入2 mL随附注射用水,充分溶解后按sonazoid/生理盐水:1.6 μL/100 mL、3.2 μL/100 mL、4.8 μL/100 mL、6.4 μL/100 mL配比,分别注入生理盐水中充分摇匀,共使用10支sonazoid冻干粉,3 600个检测点。
(2)实验装置搭建:将水槽装满水静置1 h,将配置好的生理盐水袋挂至输液架(距水槽内输液管5 cm处),输液管固定在水下3 cm处,以图像清晰为标准,在测试操作过程中,当输液管在水下3 cm时,混响伪影的干扰较小。超声扫描探头置于输液管上方水平面处,超声扫描仪器调节二维总增益37,深度10 cm。
(3)滴注流速控制:利用输液管控制阀,调节流速分别为2 mL/min、4 mL/min、6 mL/min、8 mL/min、10 mL/min,并在不同浓度及不同流速下分别进行次谐波幅度检测。
(4)次谐波数据测量:所有测量都是在室温(约25℃)下进行,超声扫描仪传输频率为4.5 MHz, MI范围0.001~1.0,启动Subharmonic模式,设备的次谐波发射频率为2.5 MHz。在动态流动条件下,MI调至最低(0.001),并逐次增加0.02,直到1.0,每次动态图像存储10 s(图2),并间隔60 s再进行下一次图像的采集, 在采集图像的过程中,持续对造影剂配置液充分摇匀,对每个动态图像进行时间强度曲线(time-intensity curve, TIC)分析,获得5个次谐波幅度,并记录每个浓度及流速均按上述操作进行数值测量,从每个采集动态图像中提取次谐波幅度值约3 600个。
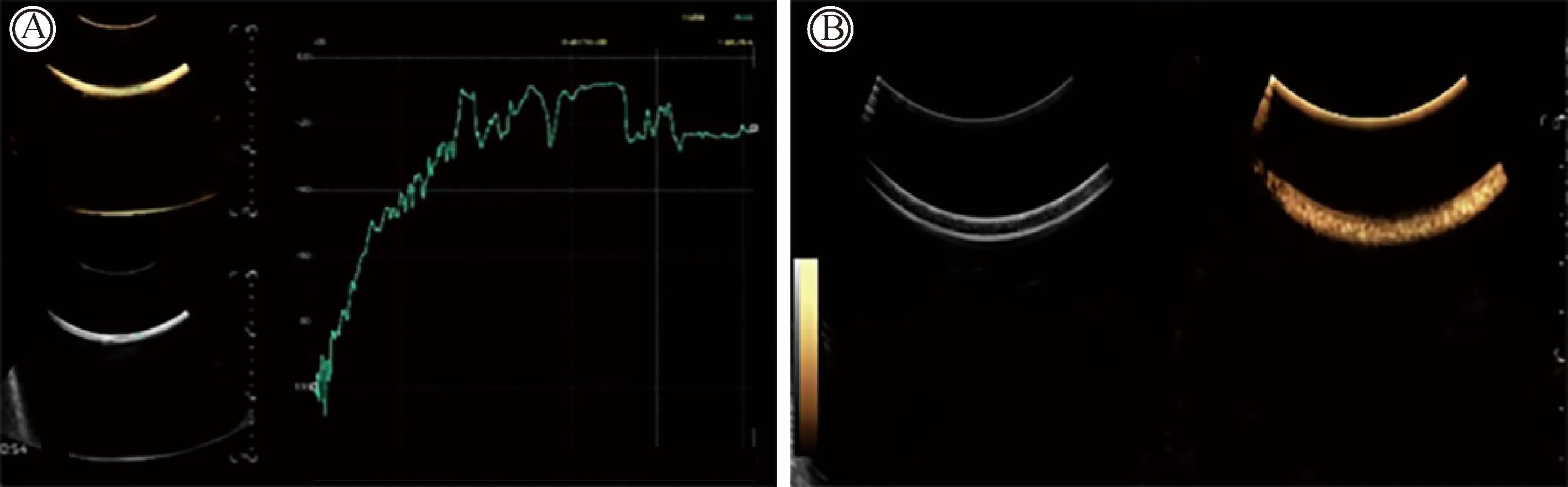
图2 超声造影剂SHAPE曲线图(A)和流动液体下微泡次谐波产生图(B)Fig.2 SHAPE curve of ultrasonic contrast agent(A) and microbubble subharmonic generation diagram in flowing liquid(B) SHAPE:subharmonic-aided pressure estimation.
1.3 统计学方法

2 结果
2.1 次谐波幅度与MI散点图总拟合线
Sonazoid冻干粉与生理盐水配置液浓度分别为1.6 μL/100 mL、3.2 μL/100 mL、4.8 μL/100 mL、6.4 μL/100 mL,在不同流速下测定次谐波幅度,应用SPSS 22.0统计软件绘制散点图并添加总拟合线(图3),在S形曲线中出现两个明确的拐点:MI和次谐波幅度分别为(0.04,-61.94 dB)、(0.38,-10.06 dB),其中快速增长阶段的次谐波幅度范围-61.94~-12.82 dB。
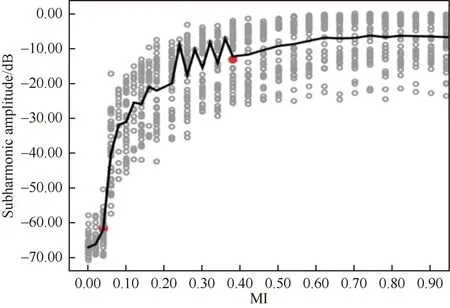
图3 Sonazoid微泡次谐波幅度与MI的散点图及总拟合内插线图Fig.3 The scatterplot and total fitting interpolation diagram of the harmonic amplitude and MI
2.2 不同MI、浓度及流速下,次谐波幅度的比较
相同流速及MI时,不同浓度下,次谐波幅度值最大相差:-10.0 dB;相同浓度及MI,不同流速时,次谐波幅度值最大相差:12.84 dB;相同浓度及流速时,不同MI最大差值:35.96 dB;不同浓度和流速下次谐波幅度差异有统计学意义(P<0.05)。
2.3 造影剂测压的最佳浓度及流速
对造影剂不同浓度及不同流速间的次谐波幅度进行比较,拟合快速增长阶段,次谐波的幅度与MI的线性相关(P<0.000)(表1)。
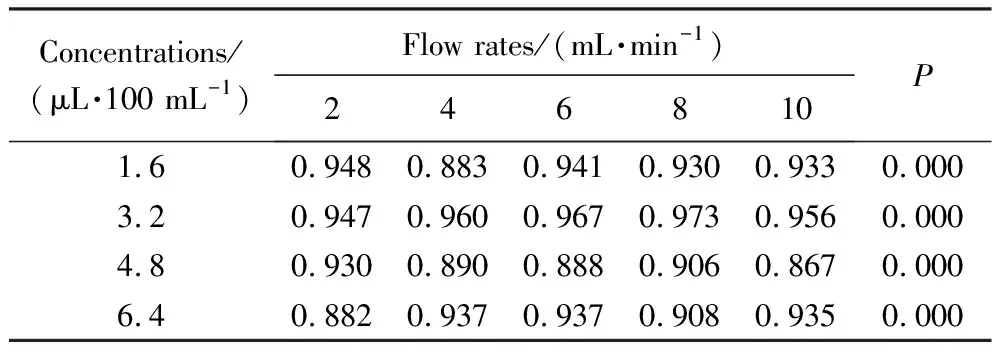
表1 快速增长阶段不同浓度及流速下,次谐波幅度与MI的相关系数Tab.1 In the rapid growth stage, the correlation coefficients between the subharmonic amplitude and MI at different concentrations and flow rates
当浓度为3.2 μL/100 mL,流速为8 mL/min时,次谐波幅度与MI相关系数最大(图4),次谐波幅度平均值:(-31.60±8.15)dB。
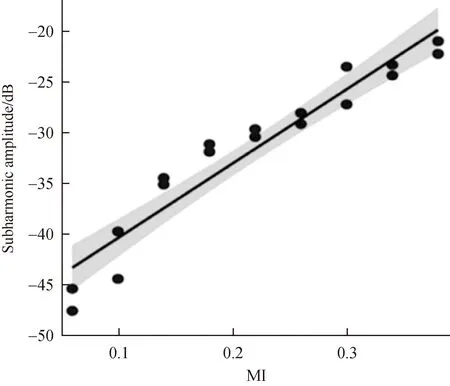
图4 次谐波幅度与MI的散点图总拟合线图Fig.4 Scatterplot total fitting diagram of the amplitude of the subharmonics and MI
2.4 验证线性模型的可靠性
残差分析,评估线性模型的拟合曲线的可靠性:r2=0.922 04,标准误(standard error)=1.223 67(图5)。
2.5 快速增长阶段:不同浓度及流速下,增加相同的MI时,次谐波幅度的增长情况
不同浓度及流速下,在增加相同的MI时,增长的次谐波幅度差异无统计学意义(P值均>0.05)(图6),其中MI相差0.04时,次谐波增长幅度平均差值:(3.18±1.55)dB,95%可信区间:(2.80~3.56)dB。
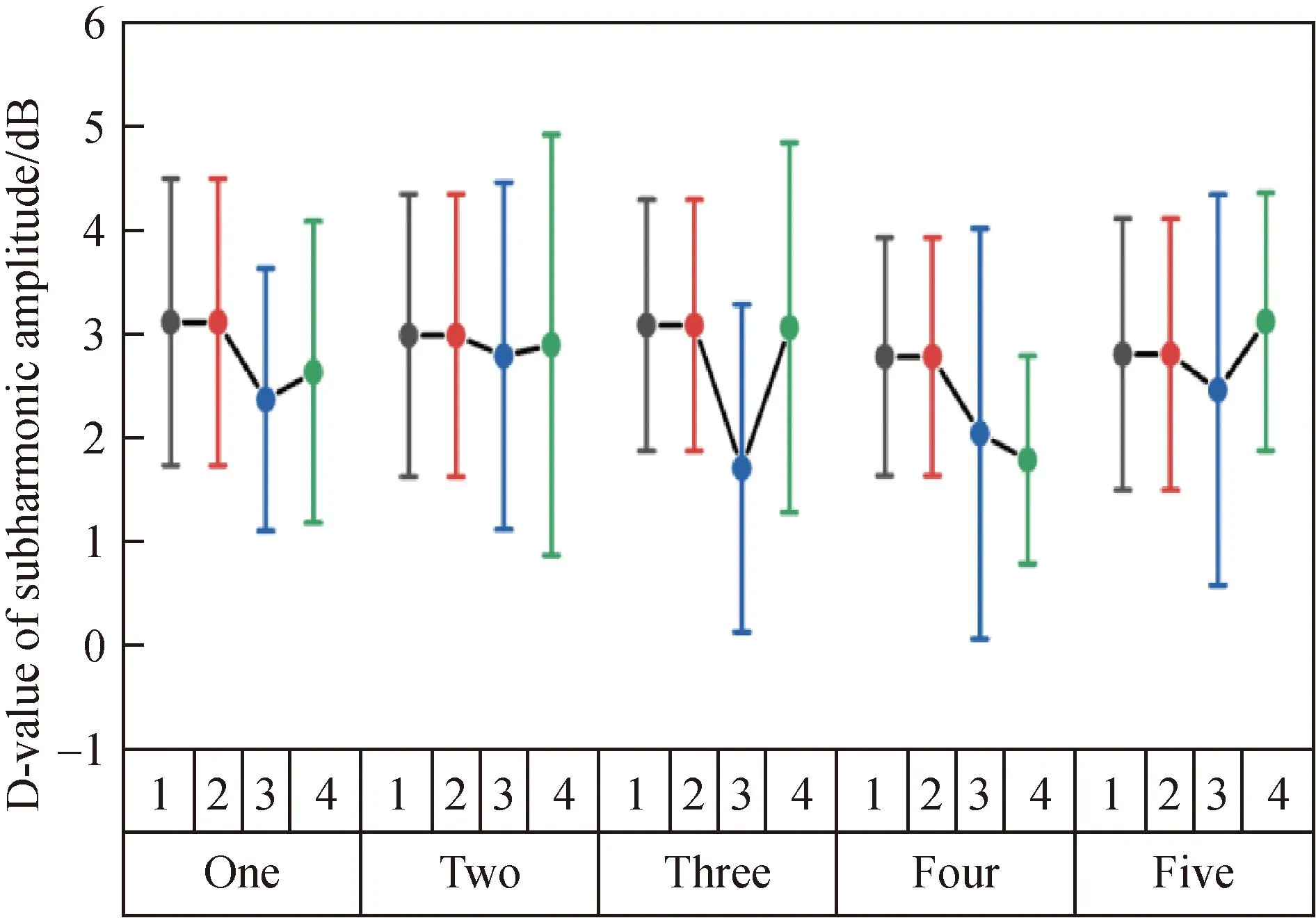
图6 不同浓度及流速下,MI相差0.04时,次谐波增长幅度平均差值的误差图Fig.6 Error diagram of average difference of subharmonic growth amplitude when MI difference is 0.04 at different concentrations and flow rates
2.6 在快速增长阶段: MI逐步增加,次谐波幅度及其幅度变化情况
次谐波幅度与MI相关系数最大时(微泡配置液浓度为3.2 μL/100 mL,流速为8 mL/min),在快速增长阶段,随着机械指数的增加,次谐波幅度不断增加,而增加的幅度逐渐减小,呈负相关(r=0.905),从9 dB降至0.31dB(图7)。
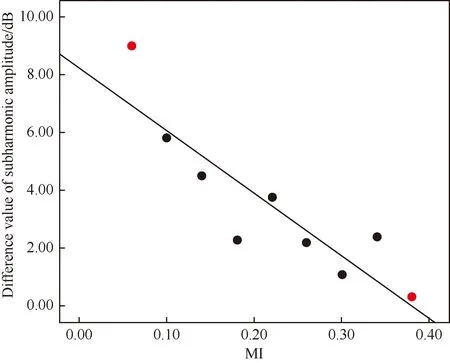
图7 微泡配置溶液在最优浓度和流速下的次谐波振幅变化差和MI的散点图Fig.7 Scatter plot of subharmonic amplitude difference and MI of microbubble configuration solution at optimal concentration and flow rateMI: mechanical index.
3 讨论
SHAPE技术需要通过利用超声造影剂作为压力传感器[5],超声造影剂微泡在超声激发下可以激发出次谐波,次谐波幅度值随着环境压力的增加而线性降低[6]。Halldorsdottir等[7]研究测试了五种超声造影剂(levovist、optison、definity、ZFX、sonazoid),发现sonazoid是次谐波压力估测最敏感的造影剂。Hoeve等[8]研究表明,使用单分散的微气泡可能有助于提高SHAPE的灵敏度。
SHAPE技术是在实现最小均方根差(root-mean-square difference,RMSD)的基础上,得出随时间变化的次谐波信号预测环境压力,但获得的压力拟合曲线并没有捕获峰值压力[4]。SHAPE拟合曲线无明确的拐点精确次谐波的快速增长阶段,这使临床应用SHAPE技术测压时,与压力相关的次谐波幅度范围及MI范围存在不确定性。
研究[9-12]表明SHAPE技术可无创估测门静脉高压、肿瘤组织间渗透压、心腔内压力、颅内压力等。为了满足临床诊断的需要,需要进一步的研究来提高压力敏感性。有研究[13]表明造影剂的次谐波产生受造影剂的幅值和浓度的影响,通过调节微泡的环境压力灵敏度可以提高微泡的次谐波幅值。因此,定量分析与压力相关的次谐波幅度范围及MI范围、超声造影剂微泡浓度及滴注流速是至关重要的。
为了减少SHAPE技术的无效测压及测压误差,有必要对与声压相关的MI范围及次谐波幅度范围,及超声造影剂浓度及滴注流速进行定量分析。本文研究构建了一个动态流体的体外模拟实验,在超声波作用后,流体中的微气泡振动的主要因素有:流体的黏性、流体的压缩性、温度效应、气体成分、气泡表面张力、气泡的初始条件、约束界面边界条件、边界条件等,这些因素将极大地影响约束气泡的运动形态。本文研究是在常温且同一种造影剂微泡(气体成分、气泡表面张力、气泡的初始条件均相同)的实验条件下进行的,实验中sonazoid微泡直径(2.6±0.1)μm, 而流体管的内径3.5 mm,微泡远小于周围流体的容积尺度,可以将流体简化为无界流场,因此本文研究中的刚性管壁对微泡产生的压力可忽略,可避免流体中微泡在超声波作用后所引起的振动规律所致的干扰因素,对本研究结果的影响。
本文研究应用SPSS 22.0统计软件拟合曲线出现了两个明显的拐点,MI和次谐波幅度分别为(0.04,-61.94dB)、(0.38,-10.06 dB),将整个曲线明确划分为三个阶段:发生阶段、快速增长阶段和饱和阶段,这与Cheung等[14]的研究结果是一致。本文研究中快速增长阶段MI 0.04至0.38,次谐波幅度由-61.94 dB增长到-12.82 dB,增长了49.12 dB,而Cheung等[14]和Sarkar等[15]的研究认为在次谐波的增长区域,在压力范围为130 KPa到320 KPa时,次谐波水平增加了68 dB,与文本研究的结果在趋势上是一致的,但是在次谐波增长幅度的定量上存在差异,可能与次谐波快速增长区域点的确定上存在差异有关。本文研究中快速增长阶段MI为0.04~0.38时次谐波散射的环境灵敏度最高,在此范围内SHAPE技术测及次谐波幅度与环境压力相关。
当静水压(0~186 mmHg,1 mmHg=0.133 KPa)增高时, 次谐波信号下降9.6 dB[15]。本文研究结果中,相同流速及MI时,不同浓度下,次谐波幅度值最大相差10.0 dB;相同浓度及MI,不同流速时,次谐波幅度值最大相差12.84 dB;相同浓度及流速时,不同MI最大差值35.96 dB。超声造影剂不同浓度、滴注流速及不同MI引起次谐波幅度的变化,而且在相同MI下,造影剂不同流速及浓度时次谐波幅度的差异有统计学意义,即不同流速下次谐波的幅度不同。验证了不同MI范围、次谐波幅度范围、造影剂浓度及滴注流速,都会引起SHAPE技术测压结果不同。
在次谐波幅度快速增长阶段,次谐波幅值随声压增大而迅速增大,且与环境静水压存在良好的相关性[15]。拟合次谐波幅度与MI的线性模型,确定最佳浓度为3.2 μL/100 mL,滴注流速为8 mL/min,随着机械指数增加,次谐波幅度增加,二者呈正相关(r=0.973)。根据残差分析评估线性模型是可靠的,即在浓度为3.2 μL/100 mL,滴注流速为8 mL/min时,利用超声造影剂次谐波幅度估测静水压最好。
在不同浓度及流速下,增加相同的MI时,增长的次谐波幅度无统计学意义,即增加相同的MI时,增长的次谐波幅度值与浓度及滴注速度无关,这与Gupta等[16]的研究结果一致。Gupta等[16]认为次谐波信号的相对变化与红细胞压积与超声造影剂浓度都无关。本文研究表明在快速增长阶段超声造影剂浓度及流速相同时,随着MI的增加,次谐波幅度不断增长,而增加的幅度逐渐减小,增加的幅度从9 dB降至0.31 dB。这可能随着MI增加,超声造影剂微泡被破坏,使次谐波的增长幅度逐渐降低有关。
本文研究仍存在一些局限性:①在持续滴注的过程中对流速的控制由人工进行,可能会存在偏差,在滴注过程可能会出现造影剂微泡分布不均,引起次谐波幅度变化差异。②生理盐水和超声造影剂配置液在管腔中流动的内压及外压环境稳定,而人体内血液系统及血压存在波动,二者间存在差异,还需要进一步临床应用验证。
综上所述,与声压相关的MI及次谐波幅度范围,超声造影剂浓度及流速对SHAPE技术有影响。当快速生长阶段边界发生变化时,在一定范围内,微泡次谐波振幅的变化和声压之间存在一定的相关性。本文实验中相关性最好的快速生长期边界为MI在0.04~0.38范围内。明确并量化这些影响因素,可提高SHAPE技术的准确性和有效性。本文研究为该技术的进一步临床应用提供了理论依据。后续将进一步研究微泡在动物及人体内的环境压。
利益冲突所有作者均声明不存在利益冲突。
作者贡献声明张艳芬:实验设计、数据分析、撰写论文;郑帅、陈治光、李睿:体模实验搭建、数据收集;程令刚、汪洪斌:文献调研、数据收集及整理;张雨康:实验操作质量控制;张巍:提出研究思路,调整并修改论文;何文:总体把关,审定论文。

