阿司匹林对表皮生长因子受体酪氨酸酶抑制剂诱导小鼠皮疹的改善作用及其机制
焦敏,滕威,2,沈皓,2,龚福恺,于鲁海,2,吴建华,2
1 新疆维吾尔自治区人民医院药学部,乌鲁木齐 830001;2 新疆维吾尔自治区临床药学研究所
随着分子生物学和基因组学的发展,晚期非小细胞肺癌的治疗已经从使用传统的细胞毒性化疗药物发展到靶向治疗药物,而表皮生长因子受体酪氨酸酶抑制剂(EGFR-TKI)是目前研究最多的靶向治疗药物[1]。但患者应用EGFR-TKI 后皮疹的发生率为10%~90%,多数为中度至重度皮疹,严重影响生活质量,甚至会中断靶向药物的治疗,尤其是丘疹脓疱型皮疹,其严重程度与肿瘤靶向治疗的临床疗效和生存率有关[2]。对于EGFR-TKI导致的皮疹,国内外指南主要给予生活指导(保湿、防晒等)、局部外用药物等方式进行治疗,尚无有效的治疗或预防药物[3-4]。研究显示,EGFR-TKI 合并阿司匹林的患者皮疹发生率降低,且皮疹程度较轻,部分患者停用阿司匹林后再次出现皮肤相关不良事件,提示阿司匹林可能具有降低EGFR-TKI 导致皮疹发生率的作用[5]。2022 年3 月—8 月,本研究观察了阿司匹林对EGFR-TKI 诱导小鼠皮疹的改善作用,并探讨其可能的机制,为降低EGFR-TKI 所致皮疹发生率提供新的思路。现报告如下。
1 材料与方法
1.1 材料 动物:雄性Balb/c 小鼠50 只,体质量18~20 g,购自上海必凯科翼生物科技有限公司,实验动物生产许可证号SCXK(沪)2018-0006;动物饲养于新疆康智睿动物实验中心,自由摄食饮水,12 h照明,温度(25 ± 2)℃,相对湿度55% ± 10%;本研究通过新疆康智睿动物实验中心伦理委员会审查(XJKZHr2022021101)。药物与主要试剂:阿司匹林购自德国Bayer 公司,EGFR-TKI 靶向药物盐酸厄洛替尼片购自上海创诺制药有限公司,盐酸米诺环素胶囊购自瀚晖制药有限公司,肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)均购自上海酶联生物科技有限公司。
1.2 皮疹模型建立与阿司匹林干预方法 将雄性Balb/c 小鼠适应性喂养1 周,给予EGFR-TKI建立皮疹模型。方法如下:于给药前24 h对每只小鼠头颈、背、腰等处用电动剃须刀进行脱毛,在所需局部涂一层油脂;2~3 min后用温水洗去脱落的被毛,纱布擦干局部。给予厄洛替尼水溶液100 mg/kg 灌胃,1 次/天,共14 d。建模成功标准参见万亮琴等[17]的研究。将建模成功的40 只雄性Balb/c 小鼠随机分为模型组、阿司匹林高剂量组、阿司匹林中剂量组、阿司匹林低剂量组,每组10 只,另取10 只正常雄性Balb/c小鼠作为对照组。阿司匹林高、中、低剂量组分别灌胃给予阿司匹林1.13、0.75、0.38 mg,对照组灌胃给予100 mg/kg蒸馏水,1次/天,共30 d。
1.3 皮肤及一般情况观察 记录各组小鼠皮肤情况,同时记录饮食、饮水、排尿、排便、精神状态及瘙痒等情况。
1.4 皮肤水分检测 将各组小鼠麻醉,在室内恒温恒湿的环境下,将皮肤水分测试分析仪的探头对准裸露的皮肤,检测皮肤水分。每只小鼠取3 个部位进行检测,取平均值。
1.5 皮肤炎症情况观察 采用皮肤炎症评分测试。取各组小鼠,对其背部皮肤炎症情况进行评分,评价内容包括红疹出现的部位(1~3处计1分,全身计5 分)、脱屑(1~5 分)、渗出(1~5 分)、皮肤增厚(1~2分)。
1.6 皮肤病理情况观察 采用HE 染色。将各组小鼠处死,眼球取血1 mL 收集于血清分离管,同时切取裸露皮肤。将皮肤组织用10%甲醛固定,常规石蜡包埋,脱蜡、水化、苏木素染色、分化与反蓝、伊红染色与脱水。切片风干封片后,100 倍显微镜下观察皮肤组织病理改变及皮肤增厚情况。
1.7 血清TNF-α、IL-1β 水平比较 采用ELISA 法。取各组眼球血,室温放置2 h或4 ℃过夜,1 000 r/min离心20 min,取上清,-80 ℃保存。参照ELISA 试剂盒检测血清TNF-α、IL-1β 水平,严格按照试剂盒说明书进行操作。
1.8 统计学方法 采用SPSS20.0 统计软件。计量资料采用S-W 正态性检验,呈正态分布以表示,多组间比较采用方差分析,两组间比较采用t检验,重复测量数据采用重复测量的方差分析;非正态分布以M(P25,P75)表示,两组间比较采用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠皮肤及一般情况比较 对照组小鼠皮肤及饮食、饮水、排尿、排便、精神状态等一般情况均正常;模型组与阿司匹林低剂量组小鼠背部皮肤出现皮疹、结痂、脱屑,以及饮食减少、饮水增多、排尿增多、排便减少等情况,伴随焦躁不安、不停地抓挠背部等行为;阿司匹林高、中剂量组小鼠皮肤皮疹、结痂、脱屑等均较模型组好转,阿司匹林干预后第2 周开始饮食慢慢恢复正常,状态由焦躁变得温顺。仅模型组小鼠出现轻度瘙痒,其余各组小鼠均未出现瘙痒。
2.2 各组小鼠皮肤水分及炎症情况评分比较 各组皮肤水分比较差异无统计学意义(P<0.05)。红疹部位、脱屑、渗出、皮肤增厚评分:对照组<阿司匹林高剂量组<阿司匹林中剂量组<阿司匹林低剂量组、模型组(P均<0.05);模型组和阿司匹林低剂量组小鼠红疹部位、脱屑、渗出、皮肤增厚评分比较差异均无统计学意义(P均>0.05)。见表1。
表1 各组小鼠皮肤水分及炎症情况评分比较()
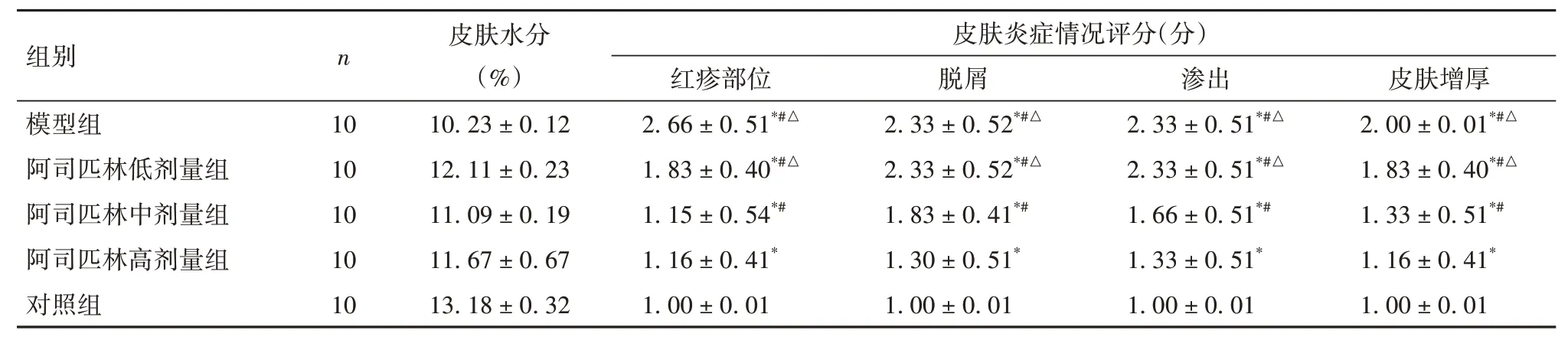
表1 各组小鼠皮肤水分及炎症情况评分比较()
注:与对照组比较,*P<0.05;与阿司匹林高剂量组比较,#P<0.05;与阿司匹林中剂量组比较,△P<0.05。
?
2.3 各组小鼠皮肤病理情况比较 对照组小鼠皮肤组织表皮各层未见炎症反应,未见异常改变;模型组小鼠皮肤组织可见毛囊周围中性粒细胞增多伴堵塞,脓样嗜中性粒细胞在毛囊管外面集群并致毛囊炎症,且有表皮增厚现象,真皮内大量淋巴细胞浸润、表皮角化过度,真皮浅层大量炎症细胞浸润,呈慢性炎症増生性改变;阿司匹林高、中剂量组有轻微表皮增厚现象,真皮内淋巴细胞浸润较轻,真皮浅层有少量炎症细胞浸润,阿司匹林低剂量组真皮浅层有较多炎症细胞浸润,但三组炎症情况均较模型组明显减轻。见OSID码图1。
2.4 各组小鼠血清TNF-α、IL-1β 水平比较 血清TNF-α、IL-1β 水平:对照组<阿司匹林高剂量组<阿司匹林中剂量组<阿司匹林低剂量组、模型组(P均<0.05)。模型组和阿司匹林低剂量组小鼠血清TNF-α、IL-1β 水平比较差异均无统计学意义(P均>0.05)。见表2。
表2 各组小鼠血清TNF-α和IL-1β水平比较(pg/mL,)

表2 各组小鼠血清TNF-α和IL-1β水平比较(pg/mL,)
注:与对照组比较,*P<0.05;与阿司匹林高剂量组比较,#P<0.05;与阿司匹林中剂量组比较,△P<0.05。
?
3 讨论
EGFR-TKI 致皮肤相关不良反应发生率高,多数为中度至重度皮疹,严重影响患者的生活质量,甚至会导致靶向药物的治疗中断。研究显示,30%应用EGFR-TKI 的患者由于皮肤毒性需要进行剂量延迟或停药[6-7]。因此,减轻EGFR-TKI 相关皮疹具有重要的临床意义,而现有的治疗方法主要以局部用药为主,包括抗生素类、激素类、维生素类和维A 酸类等。对于服用EGFR-TKI 的患者,国内外指南建议轻度皮疹予以生活指导(保湿、防晒等),中、重度皮疹予以局部激素、免疫抑制剂治疗,同时建议靶向药物减量或停用[3-4]。
EGFR-TKI 导致皮疹的发生可能有以下几个原因:①影响皮肤角质形成细胞。EGFR-TKI 阻断了EGFR与配体的结合,抑制角质形成细胞从G1至S期的DNA 合成和细胞分化,阻碍了角质形成细胞从基底层向角质层的正常迁移过程,增加了细胞之间的黏附,进一步加快了角质层的受损,表现出皮肤屏障功能发生障碍[8];同时,EGFR-TKI 激活EGFR 信号,产生抗凋亡因子,从而阻止角质形成细胞过早凋亡[9];另一方面,角质形成细胞在外因的作用下会介导T 淋巴细胞发生活化,并产生炎症趋化因子等多种活性物质,进一步激活角质形成细胞增殖、分化,破坏皮肤屏障等,病理改变如皮疹[10]。②影响细胞炎症因子表达。在皮损过程中,异常高表达的炎症因子白细胞介素(IL)-17、IL-20、IL-22 等,刺激角质形成细胞增殖的效应较强[11-12];EGFR-TKI 可增加角质形成细胞皮脂腺脂质中COX-2 的表达,继而引发由中性粒细胞和淋巴细胞介导的炎症反应,也可以通过特异性受体来触发细胞内信号,如NF-κB、丝裂原活化蛋白激酶(MAPK)等,进一步调控IL-6、IL-8、TNF-α、IL-1β 等促炎因子表达,联同趋化因子、细胞黏附蛋白等激活免疫细胞,从而引起皮疹[13-14]。③影响皮肤屏障功能。研究表明,吉非替尼和厄洛替尼均可抑制表皮葡萄球菌诱导的防御素HBD2 和HBD3 表达,使表皮细胞防御能力降低,增加了金黄色葡萄球菌等致病菌感染皮肤的机会,进而引起丘疹等皮肤损害[15-16]。
国内研究多采用中医药治疗EGFR-TKI 所致皮疹。万亮琴等[17]研究显示,验方“芪银三两三”可改善大鼠皮肤角质形成细胞增殖及分化障碍,从而发挥抗皮肤炎症作用。张琴等[18]使用芪防归芍汤治疗气血亏虚兼风热型EGFR-TKI 相关皮疹,取得了较好疗效。王霖等[19]使用新癀片对EGFR-TKI 相关皮疹的40 例患者进行为期4 周的治疗,大多数患者的皮疹得到了缓解,并能有效降低血清IL-1β 水平。王红岩等[20]对54例EGFR-TKI相关皮疹患者使用止痒平肤液治疗,结果显示能减轻患者用药后的瘙痒情况,且减少患者皮疹的发生率。国外对于EGFRTKI 所致皮疹的治疗研究较少,仅一项回顾性研究表明非甾体类抗炎药对EGFR-TKI 所致皮疹具有一定的治疗作用[21]。另一项研究发现,小剂量阿司匹林能降低接受吉非替尼治疗患者的皮疹发生率,表明阿司匹林可能具有拮抗EGFR-TKI 所致皮疹的作用[22]。
阿司匹林是一种临床应用广泛的非甾体类抗炎药,主要用于治疗疼痛、发热和外周炎症,另外由于其具有抗血小板作用,临床上也常用于心血管疾病的预防和治疗。研究显示,吉非替尼合并使用阿司匹林患者的皮疹发生率降低,皮肤病变有所改善,而当患者停用阿司匹林后可能再次出现皮肤相关不良事件[23]。但目前关于阿司匹林减轻EGFR-TKI 所致皮疹的作用机制尚不明确。由于EGFR-TKI 导致皮肤屏障功能障碍,伴随皮肤角质层的破坏,会导致皮肤水油调节失衡,皮肤锁水功能下降,水分容易丢失[21],当皮肤屏障功能发生障碍及伴随皮肤水分丢失后,皮肤抵御外界微生物及细菌的功能下降,会引起皮肤瘙痒,同时瘙痒容易引起自发挠痒行为,可能又会加重皮肤损伤,导致细菌感染等,从而形成恶性循环[7]。本研究结果显示,对照组小鼠皮肤及一般情况均正常,模型组小鼠背部皮肤出现皮疹、结痂、脱屑,从第1 周开始出现饮食减少、饮水增多、排尿增多、排便减少等情况,伴随焦躁不安、抓挠背部等行为及轻度瘙痒,皮肤组织有表皮增厚现象,真皮内大量炎症细胞浸润,提示EGFR-TKI 会导致大鼠皮肤屏障功能受损及皮肤组织炎症细胞浸润;与模型组比较,阿司匹林高、中剂量组小鼠皮肤皮疹、结痂、脱屑等均较模型组好转,从第2 周开始饮食慢慢恢复正常,且皮肤组织仅有轻微表皮增厚现象,真皮浅层有少量炎症细胞浸润,提示高、中剂量阿司匹林可以减轻EGFR-TKI 诱导的皮疹情况。本研究还显示,阿司匹林高、中剂量组小鼠红疹部位、脱屑、渗出、皮肤增厚评分及血清TNF-α、IL-1β 水平均较模型组降低,提示高、中剂量阿司匹林可以减轻EGFRTKI诱导小鼠的炎症反应。
综上所述,阿司匹林可减轻EGFR-TKI 诱导的小鼠皮疹情况,其机制可能与降低血清TNF-α、IL-1β水平从而抑制炎症反应有关,为治疗EGFR-TKI 引起的皮疹提供新的思路。

