pH 和pCO2 对抗体五聚甘露糖修饰水平的影响研究
陈孝欢,孙瑞强
(1.复旦大学 生命科学学院,上海 200438;2.上海药明生物技术有限公司,上海 200131)
目前,生物制药领域的主流药物类型仍然是重组抗体类蛋白药物,该类药物的糖基化修饰对药效有重要影响,由于N-型糖基化修饰中的五聚甘露糖(Man 5)能与人体细胞中的甘露糖受体结合,可以显著加速抗体类蛋白药物在人体中的清除速率。人体内源性抗体的高聚甘露糖含量极少(<0.1%)[1],而通过中国仓鼠卵巢细胞(CHO)表达的重组抗体的高聚甘露糖比例更高,通常在1%~20%[2]。细胞培养过程中许多工艺参数均会影响目的蛋白的Man 5 修饰比例,例如培养基、添加物、温度、渗透压和pH等[3]。其中关于pH 对Man 5 修饰水平影响的研究中,极端pH 条件(pH <6.5 或pH >7.5)均会影响高尔基体功能,从而使Man 5 修饰水平大大提高[4]。而在常规pH 培养范围内,有学者观察到高pH 有利于降低Man 5 比例[5];也有学者提出,不同细胞系下,pH 对Man 5 的影响作用存在差异[6]。由于哺乳动物细胞培养常使用CO2气体降低培养体系中的pH,所以低pH 条件下通常还伴随高pCO2的情况,在未详细探究pCO2对Man 5 影响的情况下,将Man 5 水平变化的原因归结为pH 稍显片面,有可能忽略真实原因。
本文使用盐酸和CO2对pH 和pCO2分别进行控制,并通过完全析因实验设计方法(简称全因子设计,cfDoE),研究了胞外pH(pHe)和pCO2与Man 5修饰水平的关系[pH 的研究水平分别为6.85±0.05 和7.35±0.05,pCO2的研究水平分别为(30±10) mmHg和(130±10) mmHg],通过胞内pH(pHi)检测、细胞周期检测和关键糖苷酶转录水平检测初步探究了在工艺条件影响下,Man 5 水平发生变化的潜在内因。
1 材料与方法
1.1 细胞株
本文所用细胞株为重组了Fc 端融合蛋白基因的单克隆,由上海药明生物技术有限公司细胞株构建部使用CHO-K1 宿主转染构建而成,可正常生长和表达目的蛋白。
1.2 试剂与仪器
培养所用培养基均为化学限定培养基。基础培养基CD CHO,美国Introgen 公司;基础培养基ActiPro以及补料培养基Cell Boost 7a 和Cell Boost 7b,美国Cytiva 公司;pH 指示剂pHrodo Green AM Intracellular,美国Thermo Fisher 公司;碘化丙啶/核糖核酸酶染色缓冲液PI/RNase Staining Buffer,美国BD 公司;pCO2电极,美国Metteler Toledo 公司;3 L 玻璃生物反应器,荷兰Applikon 公司;生物反应器控制器,美国Thermo Fisher 公司;Vi-CELL XR 细胞计数仪,美国Beckman公司;Cedex Bio HT 生化分析仪,瑞士Roche 公司;BGA 348EX 血气分析仪,美国Siemens 公司;Accuri C6 流式分析仪,美国BD 公司;ISF1-X CO2摇床,瑞士Kuhner 公司。
1.3 种子细胞培养
从液氮罐中取出冻存细胞后,放置在37 ℃水浴2 min 复苏,接种至装有CD CHO 培养基的摇瓶中,置于36.5 ℃、6% CO2的摇床中120 r/min 悬浮培养。之后每3 天传一次代,传代初始密度为0.20×106cells/mL。
1.4 批次补料培养
将种子细胞以0.4×106cells/mL 接种至3 L 玻璃生物反应器中,初始培养体积为1 500 mL,搅拌转速为250 r/min, 初始培养温度为36.5 ℃,培养第5 d 降温至31 ℃;初始培养pH 为7.0±0.2,第6 d 更改pH设置,开启pCO2控制,详细控制方案如表1 所示。溶氧设置目标值为40%,在培养第3 d、5 d、7 d、10 d分别进行补料,CB7a 补料体积为45 mL,CB7b 补料体积为4.5 mL。

表1 pHe 和pCO2 控制方案
1.5 细胞培养日常参数检测
每日取样3 mL 进行日常参数检测,检测内容包括细胞计数检测活细胞密度和细胞活率,血气分析仪检测离线pH 和pCO2,生化分析仪检测葡萄糖浓度和乳酸浓度。
1.6 抗体表达量和糖基化分析
抗体表达量由生化分析仪检测完成;糖型分析由上海药明生物技术有限公司分析科学部支持,使用高效液相方法完成。
1.7 pHi 检测
对批次补料培养第8 d、10 d、12 d 和收获日(14 d)的细胞进行pHi检测(检测时间代号分别为D8、D10、D12、D14),依据pHrodo Green AM Intracellualr pH 试剂的protocol 染色孵育后,使用流式细胞仪进行荧光强度分析,激发波长为488 nm,接收波长为533 nm。荧光强度越高代表pHi值越低。
1.8 细胞周期检测
对批次补料培养收获日的细胞进行细胞周期检测,使用PI/RNase Staining Buffer 避光染色孵育15 min后,使用流式细胞仪进行染色分析,以低流速进样20 000 events, 在PE-A/count 中标取不同周期阶段的细胞组群,单倍体峰为G0/G1 期,中间过渡区为S 期,二倍体峰为G2/M 期,并统计各期细胞的比例。
1.9 GnT Ⅰ、α-Man Ⅱ和GnT Ⅱ酶转录水平检测
将批次补料培养收获日细胞液300×g 离心5 min,收集细胞,-80 ℃冻存。由上海药明生物技术有限公司蛋白质科学部支持,对GnT Ⅰ、α-Man Ⅱ和GnTⅡ三种糖苷酶进行RT-RNA 检测。
1.10 cfDoE 方案与结果分析方法
使用Minitab软件设计两因子两水平的全析因实验,pHe的高低水平分别为7.35±0.05 和6.85±0.05,pCO2的高低水平分别为(130±10) mmHg和(30±10) mmHg,中心点重复两次,详细实验方案如表1。实验完成后依次将Man 5 比例、G0/G1 期细胞比例、GnT Ⅰ、α-Man Ⅱ和GnT Ⅱ三种糖苷酶转录水平作为响应变量进行统计分析,以P<0.05 为显著性判断标准,识别pHe、pCO2和pHe*pCO2交互作用对各响应变量影响的显著性。
2 结果与分析
2.1 细胞生长结果
本实验的pH 和pCO2控制曲线如图1(A)和图1(B),从6 d 开始设置cfDoE 控制条件后,pH 和pCO2基本维持在目标范围。细胞生长结果如图1(C)和图1(D),各实验条件的活细胞密度曲线基本可比,而细胞活率存在差异,其中低低水平组合(BR 1)的细胞活率下降最明显,高高水平组合(BR 4)的细胞活率维持最高。本实验的代谢结果如图1(E),高高组合在7 ~9 d 乳酸浓度最高,随后缓慢消耗。总体来看,高pCO2条件下有明显后期堆积乳酸的趋势,是一个不稳定因素,而低pH 条件可以更好地稳定乳酸代谢表现。


图1 细胞培养结果
2.2 蛋白产量结果
本实验蛋白产量结果如图2,从培养4 d 开始,发酵液中有少量产物蛋白产生,8 ~12 d 为产量快速增长时期,由此提示,外界环境对产物蛋白产生影响的关键时期为培养6 d 后,进一步佐证了批次补料培养中将影响Man 5 的条件设置在降温后的合理性。

图2 蛋白产量结果
本实验目的蛋白产量的析因分析P值汇总如表2,从P值来看,各条件对蛋白产量无显著性影响,因子效应图不再展示。此结果充分说明析因结果中的响应效应是由实验设计因子引起,而非因子条件下蛋白产量降低所引起。

表2 蛋白产量析因分析P 值汇总
2.3 pHe 和pCO2 对Man 5 水平影响的析因分析
pHe和pCO2对Man 5 水平影响的主效应和交互效应如图3 和图4 所示,对应的效应P值如表3 所示。从析因分析结果来看,从培养8 d 开始,pCO2即对Man 5 有显著性负效应,该效应一直维持至培养结束;pCO2对Man 5 产生显著性影响的时间早,影响效果最显著,是降低Man 5 修饰比例的关键因子。而pH 对Man 5 比例产生影响的时间较晚,从12 d 才开始表现正效应,影响效果相对轻微。两者的交互作用也是从12 d 开始产生,呈微弱反向交互作用;在低pCO2情况下,pH 越低Man 5 修饰比例越低;在高pCO2情况下,pH 越高Man 5 修饰比例越低。

图3 cfDoE 实验设计主效应图

图4 cfDoE 实验设计交互效应图

表3 cfDoE 实验Man 5 比例P 值汇总
2.4 pHi 检测结果
本实验的pHi检测结果如图5 所示,由于实验数据较多,为方便比较,以中位荧光值代表pHi强度,采用热图对数据进行分析,颜色越深代表中位荧光值越高,pHi越低;颜色越浅代表中位荧光值越低,pHi越高。

图5 cfDoE 实验pHi 检测结果
从结果来看,条件添加后的pHi随时间变化而变化,且与培养条件有一定相关性:在条件添加早期(培养8 d),pCO2越高,pHi酸化越明显;但是随着培养时间增加,pHi逐渐碱化,且初始酸化越明显的条件,碱化越迅速,碱化强度也越大;而低pCO2组在条件添加早期酸化并不明显,但是随着培养时间增加,pHi逐步酸化。这一现象与高pCO2降低Man 5 比例效应时间早、效果强,而HCl 控制的低pH 降低Man 5 比例的效应时间晚、效果相对较弱有一定对应关系。
以上现象说明高pCO2和低pH 两个因素均能酸化胞内pH,两者的作用方式存在差异:(1)无论pH高低,由于CO2的可透膜性,高pCO2条件均可快速酸化生物膜内环境,胞质pH 在被酸化后,细胞启动内环境调节系统,从而呈现了后期的碱化现象;(2)而低pCO2下的低pH 条件可能是由于细胞长期处于低pH 环境中,缓慢渗透适应,使得胞内pH 逐步降低。由此猜测,以上两种酸化方式导致胞内不同细胞器所处的环境有所差异,从而表现出不同的代谢和糖基化现象。在高pCO2条件下,大量的CO2不仅可以跨过细胞膜,还可以穿透细胞器膜[7],从而影响各细胞器的功能,线粒体因为过度酸化而功能受损,乳酸代谢因此异常,而高尔基体和内质网的功能由于酸化环境得到保护和维持,有利于蛋白的翻译后修饰,Man 5比例因此而降低;而在低pCO2低pHe条件下,通过细胞膜上离子通道对H+的转运调节仅能影响胞质pH,其他细胞器不易受到影响,所以该条件下的细胞代谢稳定,Man 5 修饰水平降低不明显。
由此可见,pHi越早酸化,且酸化程度高时,糖蛋白从被表达开始就能被充分糖基化修饰,Man 5 修饰水平则可以维持在较低水平。
2.5 细胞周期检测结果
培养结束时G0/G1 期细胞比例的因子效应图如图6 所示,pHe的影响P值为0.086,pCO2的影响P值为0.046,此时G0/G1 期细胞比例与pCO2水平有明显正相关性,即pCO2水平越高,G0/G1 期细胞比例越高。当细胞处于不同的周期时,其生命活动形式有所差异,G0/G1 期的细胞为下一次分裂繁殖做准备,会大量合成蛋白质,产物蛋白也在这一时期被表达修饰,当G0/G1 期细胞占比更大时,说明承担蛋白质表达修饰的载体工具较多,蛋白翻译后修饰越充分,这也许也是高pCO2条件下Man 5 比例低的原因之一。
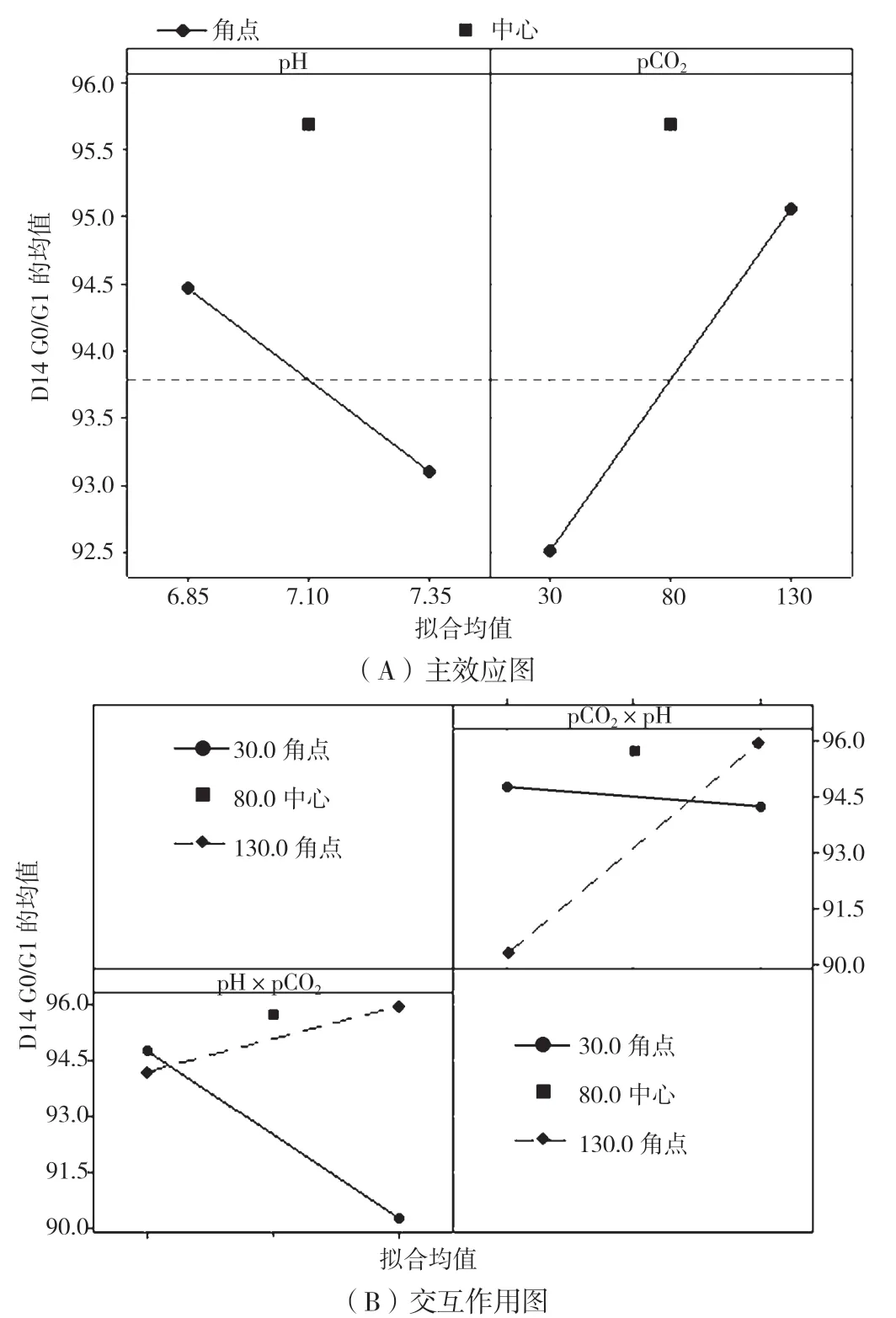
图6 cfDoE 实验G0/G1 期细胞比例效应图
2.6 关键糖苷酶转录水平检测结果
培养结束时GnT Ⅰ、α-Man Ⅱ和GnT Ⅱ三种酶转录水平的因子效应图如图7 所示。pHe对以上三者的影响P值分别为0.745、0.557 和0.827,pCO2对以上三者的影响P值分别为0.402、0.323 和0.202,说明pHe和pCO2对三种糖苷酶转录水平无显著性影响,由此可见各条件未对细胞的糖苷酶表达量水平产生实际影响,Man 5 水平的改变更有可能是高尔基体中糖苷酶所处pH 环境改变后,酶活性改变引起的。这也侧面印证了pHi是影响糖基化修饰水平的关键因素。
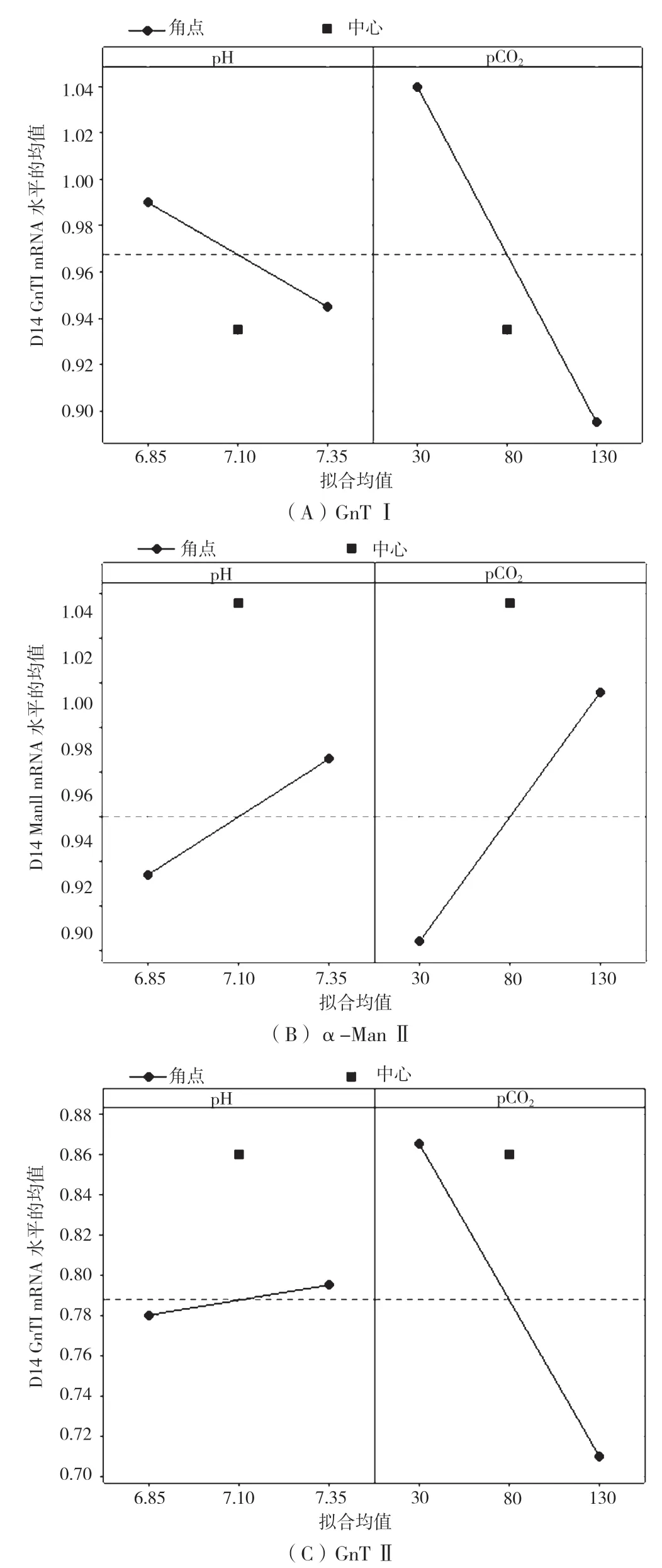
图7 cfDoE 实验糖苷酶转录水平主效应图
2.7 讨论
两因素两水平的析因实验结果确定了降低Man 5修饰比例的主要因素是高pCO2,pHe以及pHe和pCO2的交互作用为次要因素。主因子和交互因子对蛋白产量均无统计学意义上的显著性影响,可以排除蛋白产量对Man 5 比例的影响,进一步确认了因子效应的有效性。在乳酸代谢方面,仅低pCO2低pHe条件有稳定的代谢表现,所有高pCO2条件均有乳酸代谢异常的风险,而中心点水平的pCO2(80 mmHg)乳酸代谢正常,这为高pCO2应用在降Man 5 时的参数范围提供参考。在降低Man 5 比例的机理研究方面,pHi和G0/G1期细胞比例均与效应因子呈一定相关性,其中高pCO2降低Man 5 的主要原因可能有两方面:(1)可能是由于大量CO2快速透膜酸化胞质pH 环境,稳定了内质网-高尔基体的低pH 状态,为糖基化修饰提供了安全稳定的场所;(2)可能是由于高pCO2环境下,G0/G1 期细胞比例上升,糖基化修饰场所增加,糖蛋白的糖基修饰更充分。此外,研究条件下三个糖苷酶转录水平在效应因子作用下无显著性变化。
综合来看,高pCO2是降低Man 5 的关键因素,也是引起细胞培养乳酸代谢异常的风险因素,低pHe一定程度上也能降低Man 5 比例,虽然效果不及高pCO2,但是能很好地控制乳酸代谢,稳定细胞培养表现。
3 结论
对于培养pH 影响Man 5 修饰水平方面,前人的研究仅停留在pH 一个方面,忽略了pH 变化所引起的pCO2改变对Man 5 的影响,从而有相互冲突的研究结论,对降低Man 5 修饰水平的工艺策略制定存在一定误导性。本研究对培养pH 和培养pCO2进行分别控制,通过全因子设计的研究方法,全面评估了pH(6.85 ~7.35)和pCO2(30 ~130 mmHg)对Man 5 的影响,确认了影响Man 5 修饰水平的主要因素是pCO2;同时,pHi、G0/G1 期细胞比例和GnT Ⅰ、α-Man Ⅱ和GnT Ⅱ酶转录水平检测结果进一步揭示了pCO2引起Man 5 水平变化的真相。本研究为降低Man 5 修饰水平提供了新的思路,也加深了细胞培养工艺参数对抗体Man 5 修饰水平影响的认识。

