热性惊厥患儿外周血NOD样受体蛋白3炎症小体表达水平及临床意义
杨丽丽,李斌,倪海东
(南通大学附属医院儿科,江苏 南通 226001)
热性惊厥(febrile seizures,FS)是儿科常见的一种危重症,临床特征以突发全身强直性、阵挛性抽搐为主[1]。热性惊厥预后一般良好,但不及时救治,持续的惊厥发作可导致神经系统的功能障碍,引起癫痫等神经系统后遗症,导致预后不良[2]。因此,FS的早期评估和及时防治尤为重要。目前,FS的发病机制仍未完全阐明,常认为与儿童神经系统的发育不完全、神经元异常放电有着紧密关联[3]。研究[4]表明,炎症反应参与了FC的发病机制,炎症细胞因子表达增高会促进神经损伤,增加FC向癫痫的进展风险。NOD样受体蛋白3(NOD-like receptor protein 3,NLRP3)炎症小体是目前研究较为深入的炎症小体,是由受体蛋白NLRP3、衔接蛋白ASC及Caspase-1蛋白所组成的寡聚体复合物,其能够诱导白细胞介素1β(IL-1β)、IL-6等促进炎症因子的表达,激活炎症反应,参与了多种疾病炎症损伤的病理过程[5]。研究[6]发现,NLRP3炎症小体在FS炎症反应过程中发挥了重要作用。但目前关于NLRP3炎症小体对FS患儿诊治的临床意义研究尚缺乏。为此,本研究通过检测FS患儿血清NLRP3炎症小体水平,分析其与FS发病的关系,并探讨其预后判断意义。
1 资料与方法
1.1 一般资料
选取2019年5月至2021年11月于南通大学附属医院收治的90例FS儿童作为研究对象(FS组),其中男性58例,女性32例,年龄(2.14±1.09)岁,52例单纯性热性惊厥患儿(SPS组);38例复杂性热性惊厥患儿(CFS组)。纳入标准:(1)符合指南中关于FS诊断标准[7];(2)首次发病,于发病24 h内入院就诊;(3)年龄6个月~5岁;(4)既往无癫痫发作史。排除标准:(1)有原发性的颅脑损伤患儿;(2)有颅内感染的患儿;(3)确诊癫痫的患儿;(4)合并维生素D缺乏低钙性抽搐症者;(5)其他电解质紊乱引起的抽搐;(6)合并代谢性疾病引起的抽搐。另选取同期因上呼吸道感染导致发热的25例患儿作为发热对照组(性别、年龄与FS组相匹配),其中男性17例,女性8例,年龄(2.49±1.15)岁,均排除惊厥、既往FS史、神经系统疾病史者。选取同期25名健康儿童体检者作为健康对照组(性别、年龄与FS组相匹配),其中男性16例,女性9例,年龄(2.35±1.11)岁,均排除既往FS史、神经系统疾病史者。FS组、发热对照组及健康对照组性别、年龄等一般资料对比,差异均无统计学意义(P>0.05)。本研究通过医院伦理委员会审查,且与所有受试对象监护人签署知情同意书。
1.2 方法
1.2.1 标本采集 FS组和发热对照组均于患儿入院24 h抽取外周静脉血8 mL,分为两管,一份为非抗凝血,2 500 r/min离心15 min收集血清;另一份则为EDTA抗凝血;置于-80 ℃下保存待测。健康对照组于体检时收集外周血,同法保存。
1.2.2 血清NLRP3炎症小体的测定 总RNA抽提取:外周静脉血2.5 mL,置于抗凝管,用人淋巴细胞分离液无菌分离外周血单核细胞,并加入TRIzol提取试剂100 μL,三氯甲烷200 μL混匀静置3 min,于4 ℃ 13 000 g离心8 min取上清液加入0.8 mL异丙醇混匀-20 ℃放置15 min后4℃ 13 000 g离心10 min,吸除上清液加入75%乙醇0.75 mL,洗涤沉淀,再次4 ℃ 13 000 g离心5 min,去上清液加无RNA酶的水20 μL,55 ℃条件下孵育5 min取PCR管加入含2 μg RNA的溶液,加1 μL胸腺嘧啶组成的核苷酸链,再加无RNA酶的去离子水至12 μL于PCR仪上放置70 ℃ 5 min,迅速放入冰上冷却,加入5×缓冲液4 μL dNTPs 10 mmol/L 2 μL,RNA抑制剂1 μL和反转录酶1 μL,移液器抽吸混匀PCR仪上42 ℃保持60 min后继续80 ℃灭活5 min,PCR扩增条件:95 ℃预变性10 min,循环条件95 ℃ 15 s,60 ℃ 60 s,共计40个循环扩增结果采用Ct法PCR引物设计由上海生工生物工程股份有限公司合成用于基因检测。使用2-△△Ct法对外周血NLRP3、接头蛋白凋亡相关斑点样蛋白(ASC)、含半胱氨酸的天冬氨酸蛋白水解酶(Caspase-1)的相对表达水平进行计算。
1.2.3 IL-1β、IL-6等其他生化指标的测定 取血清标本,使用酶联免疫吸附法进行IL-1β、IL-6、肿瘤坏死因子-α(TNF-α)和神经烯醇化酶(NSE)的测定。
1.2.4 预后随访及分组 FS患儿均根据病情,予以降温、抗生素等对症治疗。出院后,对患儿随访至出院后6个月,根据患儿是否遗留神经发育后遗症包括智力、运动、语言、癫痫等,将患儿分为预后良好组(n=68)与预后不良组(n=22)。
1.3 统计学分析
2 结果
2.1 FS组、发热对照组及健康对照组血清NLRP3炎症小体及炎症指标比较
3组患儿血清NLRP3炎症小体mRNA表达水平及血清IL-1β、IL-6、TNF-α和NSE水平比较,差异均有统计学意义(P<0.05)。与发热对照组和健康对照组相比,FS组血清NLRP3炎症小体mRNA表达水平增高(P<0.05),且血清IL-1β、IL-6、TNF-α和NSE水平也显著增高(P<0.05)。见表1。
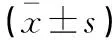
表1 FS组、发热对照组及健康对照组血清NLRP3炎症小体及炎症指标比较
2.2 不同分型FS患儿血清NLRP3炎症小体及炎症指标比较
不同分型FS患儿血清NLRP3炎症小体及炎症指标比较,CFS组血清NLRP3炎症小体mRNA表达水平及IL-1β、IL-6、TNF-α和NSE水平均高于SPS组(P<0.05)。见表2。
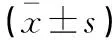
表2 SPS组与CFS组血清NLRP3炎症小体及炎症指标比较
2.3 不同预后患儿血清NLRP3炎症小体及炎症指标比较
不同预后患儿血清NLRP3炎症小体及炎症指标比较,预后不良组血清NLRP3炎症小体mRNA表达水平及IL-1β、IL-6和NSE水平均高于预后良好组(P<0.05)。见表3。
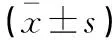
表3 不同预后患儿血清NLRP3炎症小体及炎症指标比较
2.4 血清NLRP3水平与临床资料的相关性
Pearson相关分析显示,FS患儿血清NLRP3水平与IL-1β(r=0.351)、IL-6(r=0.339)、TNF-α(r=0.342)和NSE(r=0.308)水平均呈正相关(P<0.05)。
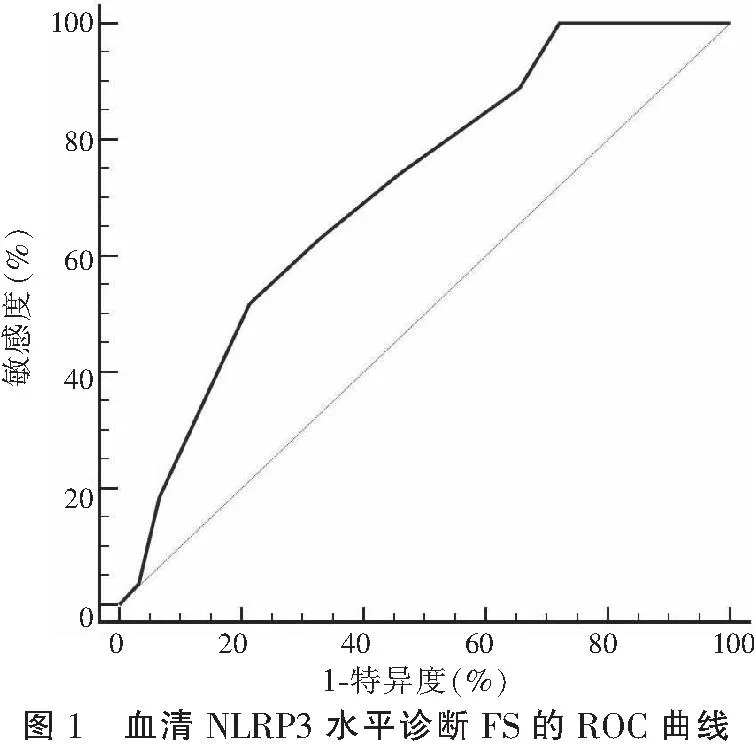
2.5 血清NLRP3水平对FS的诊断效能
ROC曲线分析显示,血清NLRP3水平诊断FS的AUC为0.724(95%CI:0.617~0.814),截断值取2.4时,其敏感度为55.6%,特异度为86.9%。见图1。
2.6 血清NLRP3水平对FS患儿预后不良的预测效能
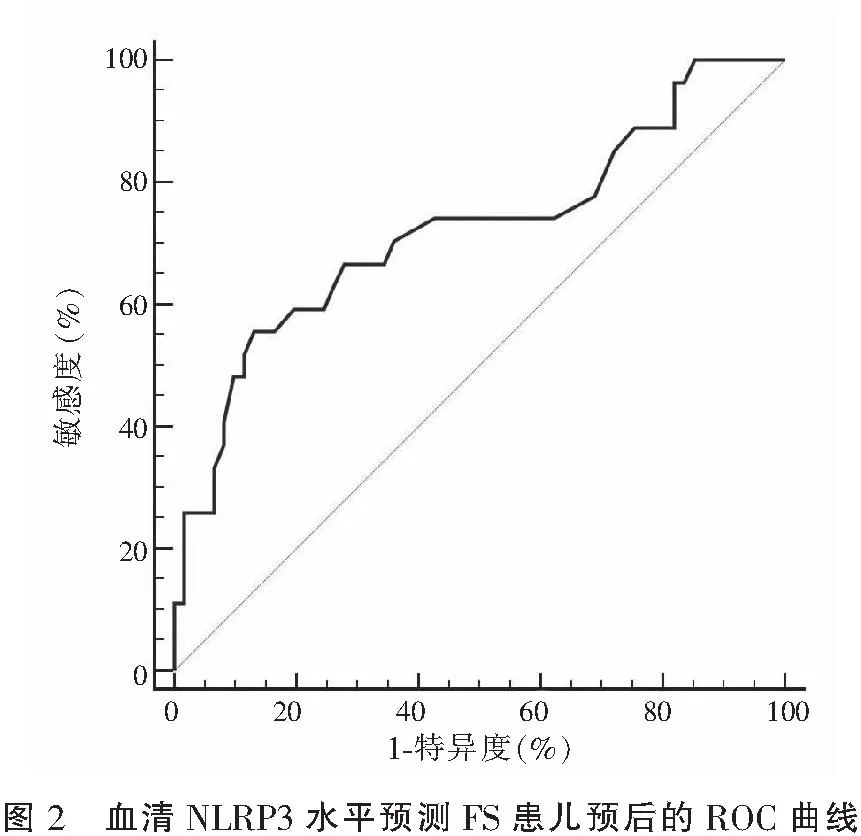
ROC曲线分析显示,血清NLRP3水平预测FS患儿预后的AUC为0.715(95%CI:0.611~0.809),截断值取3.3时,其敏感度为51.9%,特异度为78.7%。见图2。
3 讨论
FS是一种由高热所诱发的惊厥,因突发性神经元异常放电而导致抽搐症状,多见于6个月~5岁儿童。惊厥的反复发作可造成脑神经损伤,引起癫痫等神经系统后遗症,导致预后不良。FS的发病机制至今未完全明确。发热是引起惊厥的重要诱因,而发热的本质在于炎症反应,与高热相关的促炎因子如IL-1β、IL-6等表达增高,是FS发生、持续的关键因素[8]。研究[9]证实,增高的体温引起IL-1β、IL-6等炎症递质表达上调,介导炎症反应,影响神经元传导,从而参与FS的发生并使其加剧。但目前针对促炎因子与热惊厥发生机制的相关研究[10]中,检测的时间点均是在热惊厥发生之后,因此这些促炎因子可能不是导致FS发生的关键因素,且有研究[11]发现热惊厥发生之后产生的促炎因子可能与热惊厥后的成年癫痫发生更为相关。因此,推测FS发生前改变的炎性体可能对高热引起的惊厥发作可能有着更为重要的作用。
NLRP3炎症小体是备受关注的炎症小体,其可通过识别危险相关分子模式来激活炎症反应,是启动先天性免疫反应的重要手段。NLRP3炎症小体是由NLRP3、ASC以及pro-Caspase-1组成的多聚体蛋白复合物。当机体遭受外源病原体侵袭或接收到内源危险信号时,ASC招募效应蛋白pro-Caspase-1,炎症小体自我装配,并水解出具有活性的Caspase-1,进一步剪切释放IL-1β、IL-6等促炎因子成熟体,从而参与下游炎症因子的级联反应[12],由此可见 NLPR3炎性小体活化是IL-1β、IL-6等促炎因子成熟的关键。NLPR3炎症小体作为天然免疫系统的重要组成,在机体免疫炎症反应过程中有着重要作用。研究[13-14]发现,NLPR3炎症小体在川崎病、类风湿关节炎、动脉粥样硬化症等多种疾病中均被激活。还有研究[15]发现,NLRP3炎症小体活化参与了急性热应激所致的系统性炎症反应,热应激组小鼠脑组织NLRP3、Caspase-1、IL-1β蛋白水平与对照组相比升高。提示NLRP3-Caspase-1作为炎症小体的关键组成部分,可能是受高热刺激后最早启动的炎症因子。大鼠癫痫模型中,NLRP3炎症小体的表达水平上调[16]。且NLRP3炎症小体作为炎症反应的“总开关”,参与了FS的发生发展[17]。本研究使用荧光定量PCR对FS患儿血清NLRP3炎症小体表达进行检测,结果发现,FS患儿外周血NLRP3、ASC、Caspase-1 mRNA表达水平相比对照组增高,且CFS组高于SPS组,这与Wang等[18]报道一致,表明NLRP3炎症小体可能参与了FS的发生发展。研究[19]认为,当受到高热刺激后,NLRP3会招募头蛋白ASC,同时在ASC的衔接之下,促进pro-Caspase-1发生水解,产生有活性的Caspase-1,进一步剪切炎症因子IL-1β的前体,形成成熟的IL-1β并分泌至胞外参与一系列炎症反应,进而促进神经递质释放,使得神经元过度兴奋,从而导致FS发生。
为明确NLRP3如何促进FS炎症反应,本研究还对下游IL-1β、IL-6等促炎因子进行检测,发现FS患儿血清IL-1β、IL-6和TNF-α水平均呈高表达,与既往报道[20]一致。IL-1β是重要的促炎因子,能够诱导IL-6和TNF-α的表达,这些因子均与FS的发生相关。本研究还发现,FS患儿外周血NLRP3 mRNA表达水平与IL-1β、IL-6和TNF-α水平均呈正相关,这提示NLRP3的激活可能促进IL-1β分泌,进而参与FS的炎症反应及发生发展。IL-1β、IL-6和TNF-α均是反映炎症反应的常用指标,与FS的发生发展相关。NSE作为一种脑损伤标志物,也能够反映FS患儿病情[21]。本研究发现,FS患儿血清NSE高于对照组,且CFS组高于SPS组,这也提示NSE能够反映FS的发生发展。
本研究还显示,预后不良组外周血NLRP3表达水平高于预后良好组,这说明NLRP3表达与FS患儿预后相关,能够提示患儿脑损伤风险。使用ROC曲线评价NLRP3表达水平对FS诊断和预后判断的价值。结果显示,血清NLRP3水平诊断FS的AUC为0.724,预测预后的AUC为0.715,这表明血清NLRP3表达水平可用于FS的诊断,并具有预后判断价值。
综上,NLRP3炎症小体可能参与了高热相关炎症反应,与FS的发病及病情相关,监测外周血NLRP3炎症小体的表达对于FS的诊治和预后判断有重要意义。但本研究样本量有限,关于NLRP3炎症小体在FS发病及预后中的作用仍有待更多研究探讨。

