MDCT评价骨骼肌减少症与失代偿期肝硬化发生上消化道出血风险的相关性
李枝春,雷燕,朱婷婷,李勇,唐伟,张小明
(1.四川省医学影像重点实验室·川北医学院附属医院放射科;2.川北医学院附属医院检验科,四川 南充 637000)
在肝硬化患者中,营养不良是最常见的共存疾病[1]。肝硬化患者营养不良是由饮食摄入减少、吸收不良、蛋白质合成功能低下和高代谢引起,可表现为全身骨骼肌质量减少[2]。骨骼肌减少症是肝硬化患者,尤其是失代偿肝硬化患者常见的合并症之一[3]。相对于没有合并骨骼肌减少症的肝硬化患者,合并骨骼肌减少症的肝硬化患者的生活质量下降、相关并发症发生风险增加、生存期减少[3-4]。骨骼肌减少症可以作为危险因素预测肝硬化患者发生并发症的风险和预后[5-7]。
肝硬化失代偿期是各种慢性肝炎疾病的终末期,其中急性上消化道出血是最常见的并发症之一,约1/3的肝硬化患者在其病情发生发展过程中并发上消化道出血[8]。肝硬化患者发生急性上消化道出血病情凶险,进展迅速,严重会造成大出血,在短时间内出现休克,引发急性周围循环衰竭,死亡率高[9]。肝硬化患者发生上消化道出血与异常凝血功能、门脉高压等因素有关。然而,骨骼肌减少对失代偿肝硬化患者发生上消化道出血的影响尚不清楚。MDCT不但可以评估肝硬化病情严重程度,还可以在横断面上测量腹壁肌肉的横断面积,通过公式计算骨骼肌指数,用于评估骨骼肌减少症,能够较准确反映肝硬化患者全身骨骼肌的质量[10]。基于此,本研究拟在MDCT上测量失代偿期肝硬化患者腹壁肌肉的横断面积和皮下脂肪,分析失代偿期肝硬化患者发生上消化道出血与骨骼肌减少症的相关性,对早期无创性预测肝硬化患者发生上消化道出血具有重要的临床价值。
1 资料与方法
1.1 一般资料
回顾性分析2019年6月至2022年6月川北医学院附属医院收治并接受腹部MDCT扫描的167例肝硬化患者作为研究对象,依据是否发生上消化道出血分为出血组(n=50)和未出血组(n=117)。纳入标准:(1)年龄≥18岁;(2)乙型肝炎肝硬化失代偿期患者,诊断标准依据2019年中华医学会肝病学分会修订的《肝硬化诊治指南》诊断标准[11];(3)患者入院前1年内未发生上消化道出血;(4)入院后接受胃镜及全腹部MDCT扫描,图像质量良好满足诊断要求,且CT扫描在入院1周内进行;(5)相关临床信息和实验室检查完善。排除标准:(1)合并原发性肝癌或其它恶性肿瘤患者;(2)非乙型肝炎引起的肝硬化患者;(3)肝硬化代偿期患者;(4)明显心肾功能异常患者;(5)仅接受上腹部MDCT扫描;(6)图像质量不佳不能满足诊断要求;(7)相关临床信息和实验室检测不完善。其中男性113例,女性54例,年龄(54.31±10.29)岁。本研究经过医院伦理委员会批准。
1.2 MDCT扫描
扫描机型采用GE LightSpeed VCT 64层螺旋CT。扫描范围从膈肌平面到达耻骨联合平面。扫描参数如下:管电压120 kV,管电流250~300 mA,扫描时间0.5 s/360 °,螺距1.0,采集层厚1.0 mm,重组层厚5 mm,矩阵512×512。扫描方法包括平扫或双期(动脉期+静脉期)动态增强扫描。其中123例仅进行腹部平扫,44例进行腹部平扫+双期动态增强扫描。增强扫描对比剂为碘海醇(扬子江,江苏),使用Medrad vistron CT 高压注射器,19号针头肘正中静脉穿刺团注,注射流率3 mL/s,剂量2 mL/kg,每个患者注射对比剂的最大剂量不超过120 mL。注入对比剂后20~25 s、50~55 s行肝脏双期(动脉期和门静脉期)扫描。
1.3 特征指标收集
详细阅览患者的病历资料,收集患者的年龄、性别、身高、体重等一般资料及入院后24 h内实验室检查指标(总胆红素、白蛋白、凝血酶原时间、国际标准化比值、肌酐、丙氨酸氨基转移酶、门冬氨酸氨基转移酶等)。按照Child-Pugh标准[12]将肝功能分为A-C级, A级5~6分,B级7~9分,C级10~15分;评分标准如下:1分,总胆红素<34 μmol/L,白蛋白>35 g/L,PT延长<4 s,无腹水,无肝性脑病;2分,总胆红素:34~51 μmol/L,白蛋白:28~35 g/L,PT延长:4~6 s,腹水少量,肝性脑病(Ⅰ~Ⅱ期);3分,总胆红素>51 μmol/L,白蛋白<28 g/L,PT延长>6 s,中量或多量腹水,肝性脑病(Ⅲ~Ⅳ期)。腹水半定量依据影像学检查(腹部B超或CT)确定。体质量指数(BMI)计算公式如下:BMI=体重(kg)/身高2(m2)。
1.4 倾向评分匹配
为均衡失代偿期肝硬化出血组和未出血组两组病例的年龄、性别和BMI指标,在比较两组病例的腹部肌肉横断面积和皮下脂肪面积值时最大程度避免年龄、性别和BMI的影响,我们使用年龄、性别和BMI作为协变量来进行倾向评分匹配两组病例,采用一对一最邻近匹配方式,设置卡尺值为0.01。
1.5 腰3椎体水平腹部肌肉横断面积和皮下脂肪面积测量
在PACS上,使用截屏功能截取第3腰椎体最大层面腹部横断位MDCT平扫图像,并传入个人电脑工作站(图片格式JPEG;WL=40;WW=350)。使用Image J软件(ImageJ 1.51(100)Copyright(C)2015)测量腹部肌肉横断面积和皮下脂肪面积。分别由具有5年和7年腹部影像诊断经验的医师在第3腰椎体最大层面腹部横断面MDCT平扫图像上测量腰大肌、竖脊肌、腰方肌、腹直肌和左右两侧腹横、内、外斜肌的横断面积,以及周围皮下脂肪面积,每位医师前后分别测量两次,最后取其两位医师第一次测量值的平均值。通过比较腰3椎体层面所有横断位图像确定第3腰椎最大层面。Image J软件测量步骤:(1)设置比例尺:使用Image J软件打开截屏的腹部横断位MDCT平扫图像,以截屏图像上最左侧自带的比例尺为参考标准,在比例尺的1 cm长刻度画一条直线。然后点击工具栏“Analyze-set scale”选择比例尺,在“Known distance”一栏写入1,单位“Unit of length”一栏写入“cm”。最后点击“OK”完成图像实际长度单位的设定。(2)分割ROI区:双击自动框选工具wand,将Tolerance设置为16,点击图像可自动沿着骨骼肌、皮下脂肪的边缘对其进行分割。(3)计算面积:点击工具栏“Analyze-Measure”就可自动计算面积。见图1。
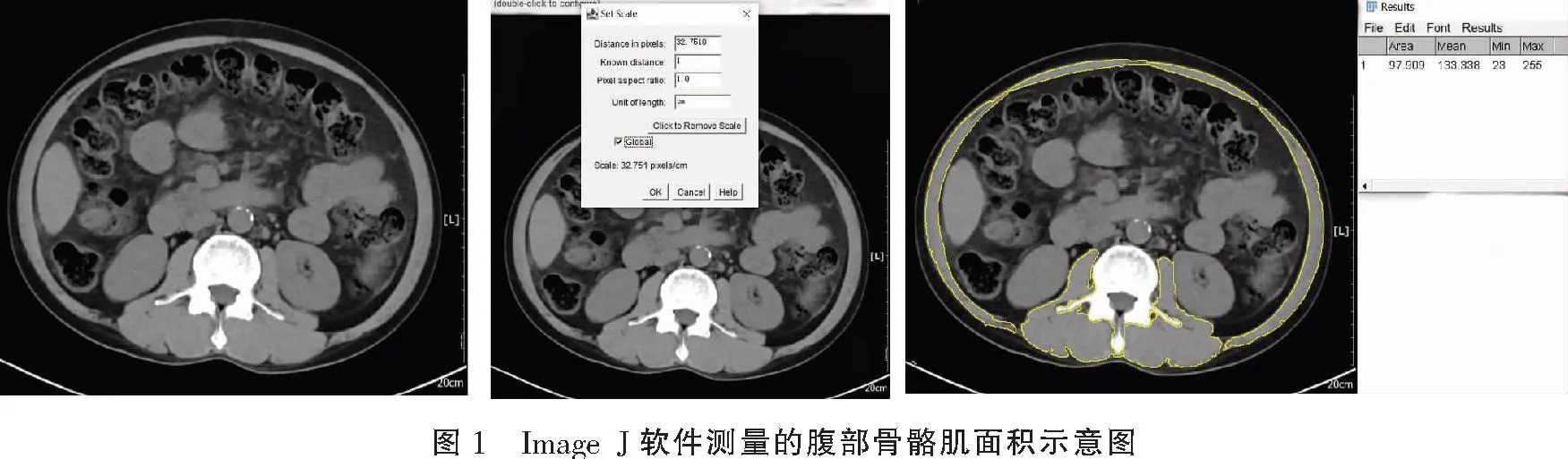
1.6 骨骼肌减少症判断标准
相加第3腰椎体最大层面腹部横断面MDCT图像上腰大肌、竖脊肌、腰方肌、腹直肌和左右两侧的腹横、内、外斜肌的横断面积值,得到第3腰椎体最大层面骨骼肌面积总和L3-SMA。根据L3-SMA值和身高可计算骨骼肌指数SMI,计算公式如下:SMI= L3-SMA(cm2)/身高2(m2)。参考SMI值,可判断肝硬化患者是否合并骨骼肌减少症,判断标准[13]如下:男性<44.77 cm2/m2,女性<32.50 cm2/m2为骨骼肌减少症阈值。
1.7 统计学分析
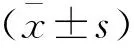
2 结果
2.1 两组患者的临床基本特征、实验室检测指标和Child-Pugh分级与上消化道出血相关性分析
两组患者性别、总胆红素、肌酐、丙氨酸氨基转移酶、门冬氨酸氨基转移酶比较,差异无统计学意义(P>0.05);年龄、BMI、白蛋白、血浆凝血酶原时间、国际标准化比值、肝功能Child-Pugh分级比较,差异有统计学意义(P<0.05)。见表1。
表1 两组患者一般资料比较
2.2 失代偿肝硬化患者出血组和非出血组倾向性评分匹配
经倾向性评分匹配后,肝硬化患者非出血组和出血组各纳入39例患者,2个匹配组之间性别、年龄和BMI三个变量无统计学差异(P>0.05)。见表2。
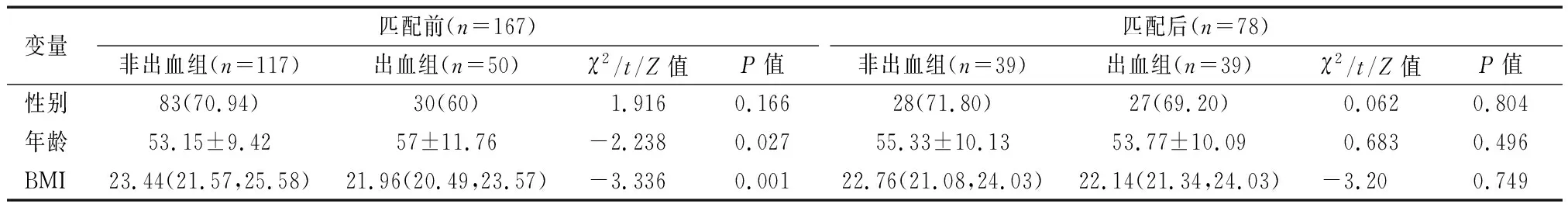
表2 肝硬化失代偿期患者出血组和非出血组倾向性评分匹配
2.3 SMA和SFA测量值的一致性分析
ICC结果显示,对于L3-SMA和SFA的测量,放射科医生1与放射科医生2的观察者内部和观察者之间测量结果存在较好的一致性。见表3。
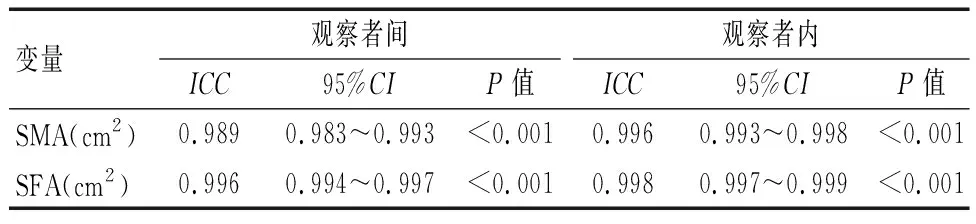
表3 观察者内部和观察者之间SMA和SFA测量值的一致性分析
2.4 两组各指标单因素比较分析
肝硬化出血组的L3-SMA(103.32±25.39 cm2)
和L3-SFA(74.87 cm2)小于非出血组的L3-SMA(116±25.48 cm2)和L3-SFA(66.63 cm2),L3-SMA在两组间差异有统计学意义(P<0.05),L3-SFA在两组间差异无统计学意义(P>0.05)。肝硬化出血组的骨骼肌减少症发生率为74.35%,高于非出血组的35.90%,骨骼肌减少症发生率在两组间差异有统计学意义(P<0.05)。肝硬化出血组和未出血组间肝功能Child-Pugh分级、白蛋白、血浆凝血酶原时间比较,差异有统计学意义(P<0.05);总胆红素、肌酐、国际标准化比值、丙氨酸氨基转移酶、门冬氨酸氨基转移酶无统计学差异(P>0.05)。见图2、图3及表4。
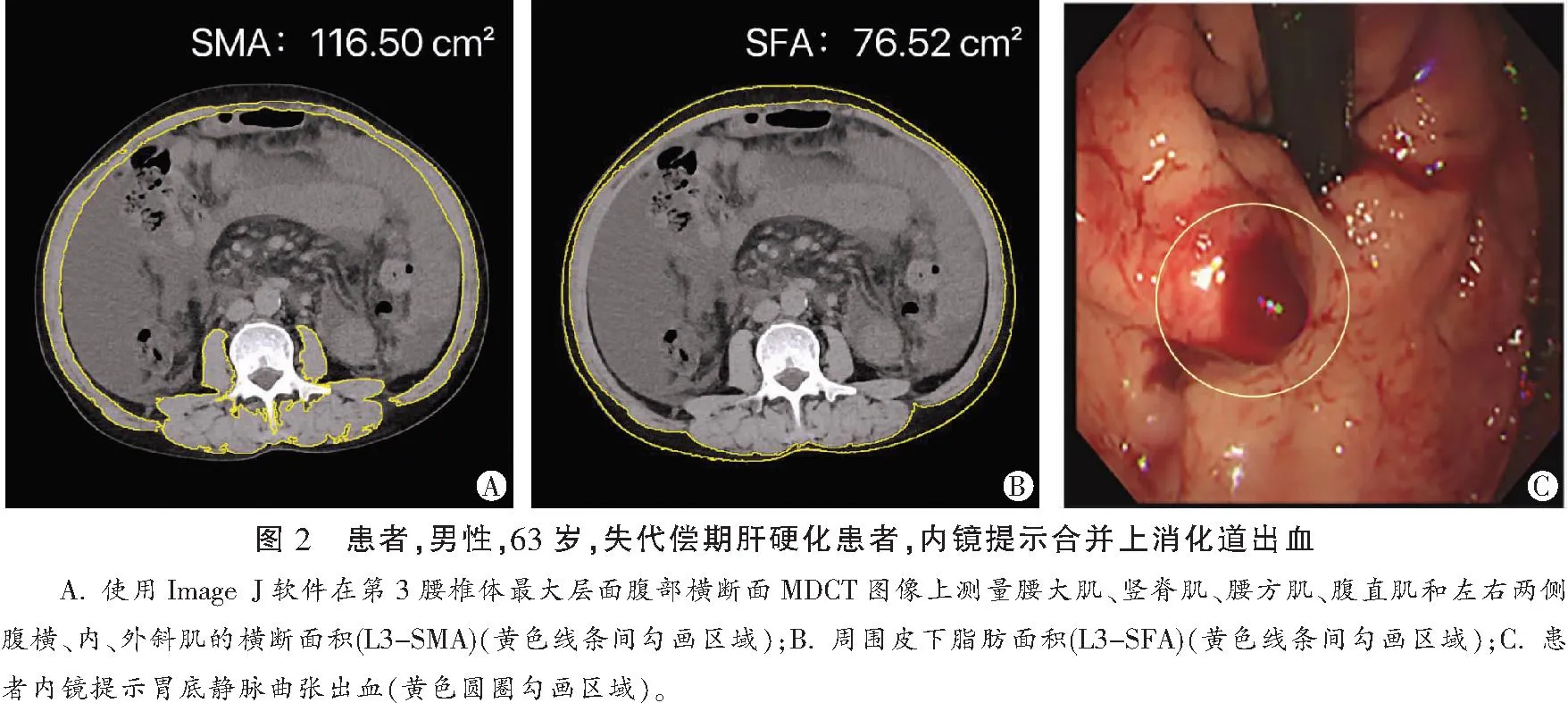
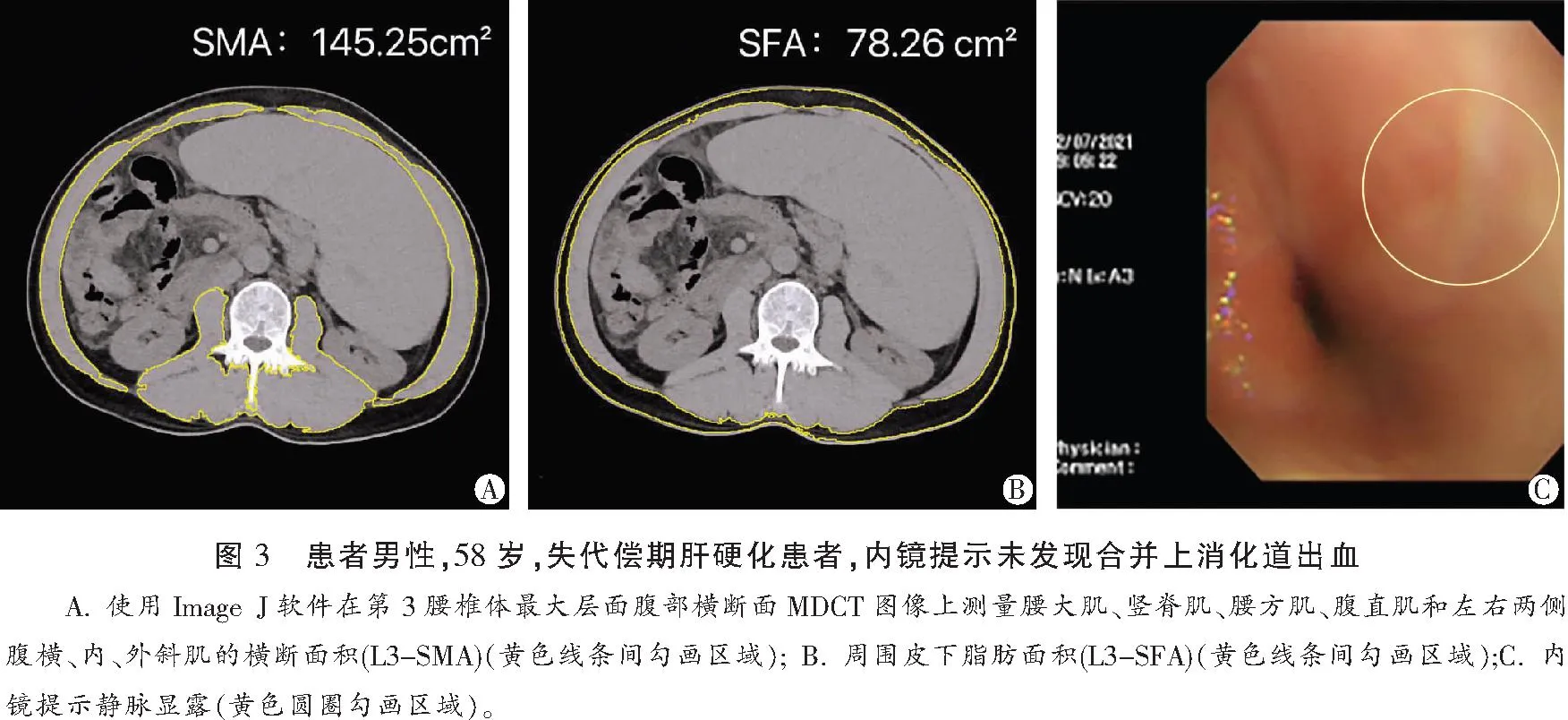
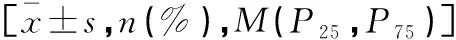
表4 倾向性评分匹配后两组患者一般资料的单因素比较分析
2.5 失代偿期肝硬化患者发生上消化道出血危险因素的多因素Logistic回归分析
以失代偿期肝硬化患者合并上消化道出血为因变量,单因素比较分析结果中有显著性差异的指标[白蛋白、血浆凝血酶原时间、肝功能Child-Pugh 分级(B级、 C级)、SMA、骨骼肌减少症]为协变量,建立多因素Logistic回归模型。多因素Logistic回归结果显示血浆凝血酶原时间、骨骼肌减少症可作为独立危险因素预测失代偿肝硬化发生上消化道出血(P<0.05),合并骨骼肌减少症的肝硬化患者发生上消化道出血的风险是未合并骨骼肌减少症的肝硬化患者的3.724倍。见表5。
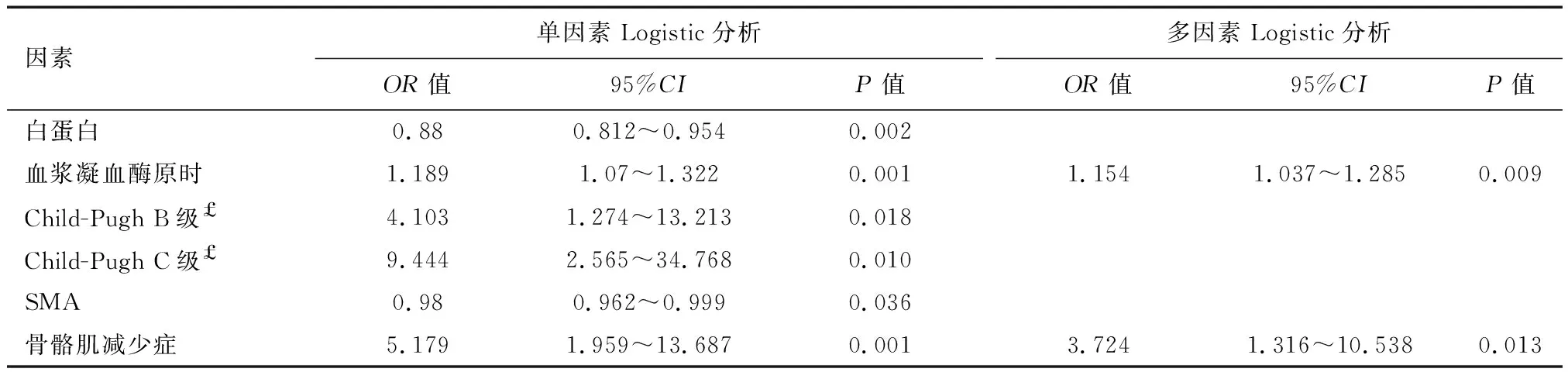
表5 乙型肝炎肝硬化失代偿期患者合并上消化道出血Logistic回归分析
3 讨论
肝硬化失代偿期以门静脉高压和肝功能减退为其主要临床表现。上消化道出血是肝硬化失代偿期者常见且危险的并发症之一[14]。随着肝脏损伤程度加重,肝脏血窦正常结构破坏,门静脉压力增加,血液回流受阻,食管静脉发生曲张,最终发生破裂出血,死亡率高[15]。因此,早期诊断和及时预防可以有效降低上消化道出血的发生。目前,在临床上针对肝硬化上消化道出血首选的检查方法是内镜检查,可以直观的看到食道胃底静脉的曲张程度和是否发生出血[16]。但是内镜检查同样也有一定的局限性,危急重肝硬化患者内镜检查发生出血和死亡的风险性较高。因此需要更加简便且无创的方法来代替内镜预测失代偿期肝硬化患者发生静脉曲张破裂出血的风险。肝硬化患者由于饮食摄入减少、吸收不良、蛋白质合成低下和高代谢容易发生营养不良[1],导致全身骨骼肌质和量下降[2]。在临床上,评估骨骼肌质量可反映肝硬化患者的身体机能状态,合并骨骼肌减少的肝硬化患者生活质量下降、肝硬化相关并发症发生增加、进展加快和生存期缩短,骨骼肌减少与肝硬化患者预后密切相关[17-18]。
MDCT是肝硬化患者在临床上推荐的影像学检查手段,不但可以评估肝硬化病情本身,还可以评估继发性改变。在MDCT上测量骨骼肌横断面积和皮下脂肪面积可间接反映肝硬化患者骨骼肌质量的变化[10]。且在MDCT上测量腰3椎体水平腹部骨骼肌横断面积的总和,除以身高的平方,计算得出骨骼肌指数[13]。骨骼肌指数值可用于诊断骨骼肌减少症。由于性别、年龄和人种的差异,诊断骨骼肌减少症的骨骼肌指数阈值在不同年龄阶段、不同人种以及男性和女性之间有不同的标准。本研究采用Zeng 等[13]报道基于L3-SMI的中国人群骨骼肌减少症的诊断标准:男性44.77 cm2/m2,女性32.50 cm2/m2定义为骨骼肌减少症阈值。同时,本研究采取倾向性得分匹配方法,均衡两组肝硬化患者的年龄、性别和BMI变量,尽量消除这3个因素对两组肝硬化患者骨骼肌测量结果比较的影响。
肝硬化患者骨骼肌减少症发病率较高,失代偿期肝硬化患者的发病率明显高于代偿期肝硬化患者[19]。文献报道肝硬化患者的骨骼肌减少症发病率差异较大,约20%~70%[6,17]。这可能与纳入研究样本或采用不同的诊断标准有关。Ishizu等[20]研究发现,骨骼肌减少可作为独立危险因素预测合并急性静脉曲张出血的肝硬化患者发生6周死亡的风险。此研究结果说明骨骼肌减少症与肝硬化患者发生上消化道出血存在一定的相关性。Topan 等[21]研究证实,合并骨骼肌减少症的肝硬化患者的食管静脉曲张和上消化道出血发生率高于未合并骨骼肌减少症的肝硬化患者。从上述研究结论可得出骨骼肌减少症与肝硬化患者的食管胃底静脉曲张和发生上消化道出血具有一定的相关性。本研究结果证实失代偿期肝硬化患者出血组的L3-SMA小于非出血组,失代偿期肝硬化患者出血组诊断骨骼肌减少症的比例高于非出血组。相对于未合并骨骼肌减少症的失代偿期肝硬化患者,合并骨骼肌减少症的失代偿期肝硬化患者发生上消化道出血的风险成倍增加。推测原因可能是:骨骼肌质或量的减少在慢性肝病早期阶段即可出现[3],随着疾病进展,相关并发症出现和骨骼肌量进行性丢失。骨骼肌减少症的发生与失代偿性肝硬化出现上消化道出血可以在疾病进展的过程中重叠出现。另外,失代偿期肝硬化患者出血组中腹水、门静脉高压、胃肠道淤血程度较非出血组严重,引起腹腔内压力更高和腹部膨隆,腹部骨骼肌持续对抗腹腔高压和腹部膨隆产生的应力,可能导致肌肉萎缩或肌力受损。腹腔高压和腹部膨隆与肝硬化发生骨骼肌减少的机制尚需要进一步证实。
肌肉及脂肪组织作为人体两种主要的身体组分,近年来有多项研究表明,肌肉和脂肪均是临床上进行营养评估的经典指标,在机体中发挥着不同的作用及功能[22-23]。有研究[24]表明皮下脂肪通过产生游离脂肪酸提供能量并参与调节机体新陈代谢,适量的皮下脂肪组织可能有益于肝硬化患者长期生存,而过度缺乏或积累都会对肝硬化患者的预后产生负面影响。本次研究结果显示失代偿期肝硬化患者出血组的L3-SFA要稍低于非出血组的L3-SFA,两组间差异无统计学意义(P>0.05),可能是由于失代偿期肝硬化患者肝功能明显减退和门静脉高压使得胃肠消化、吸收、分泌功能障碍,营养摄入不足,皮下脂肪减少。本研究出血组与非出血组的L3-SFA差异无统计学意义,可能与纳入病例均为失代偿期肝硬化患者,肝功能较差有关。
反映凝血功能或肝功能的一些实验室检测指标及Child-Pugh分级与失代偿期肝硬化患者发生上消化道出血的风险密切相关,这符合肝硬化病情进展规律。血浆凝血酶原时间反映外源性凝血因子含量及活性,肝硬化失代偿期患者肝脏功能受损、凝血因子生成减少、凝血功能障碍,导致使血浆凝血酶原时间延长,上消化道出血风险上升[25-26]。白蛋白水平是反映肝脏合成能力的常用指标,肝硬化肝细胞的大量坏死和代谢障碍使白蛋白合成减少,导致低蛋白血症和腹腔积液,因此白蛋白水平作为一项无创性指标可以较好地评判患者肝功能受损程度[27]。本研究结果显示Child-Pugh分级B级、C级的肝硬化患者在出血组中显著多于未出血组,失代偿期肝硬化患者出血组白蛋白水平显著低于未出血组,与上述理论一致。
综上,除反映凝血功能或肝功能的一些实验室指标外,在MDCT上腰3椎体水平腹部骨骼肌横断面积以及是否合并骨骼肌减少症可以作为HBV失代偿期肝硬化发生上消化道出血的危险因素。在临床实践中,除了改善肝功能,还可以加强管理肝硬化患者的骨骼肌肉康复训练,可在一定程度上预防和降低肝硬化患者发生上消化道出血的风险,改善预后,具有重要的临床意义。

