车叶草苷通过内质网应激促进胰腺癌细胞凋亡的机制研究
曹龄之,付国旭,陈飞,李素平,杨凡慧
(1.川北医学院附属医院核医学科,四川 南充 637000;2.绵阳市第三人民医院核医学科,四川 绵阳 621000)
胰腺癌(pancreatic cancer,PC)是最常见的消化道恶性肿瘤之一,发病率居全球第14位,5年生存率<10%[1],是全世界亟待解决的健康难题之一。胰腺癌早期临床症状不明显,大部分患者在确诊时已处于癌症晚期,无法进行手术治疗。目前,化疗是治疗晚期胰腺癌的主要方法之一,但长期的化疗药物使用具有耐药性和不良反应,影响患者预后。因此,开发新型药物是临床上治疗PC的主要趋势。
白花蛇舌草是传统的中草药,具有广谱抗癌作用,对PC具有良好的辅助治疗效果,可显著改善PC患者的存活率。同时,可通过激活或抑制炎症信号通路,抑制原癌基因的表达,抑制细胞增殖等机制[2-5],对白血病、肺癌、肝癌、恶性黑色素瘤、卵巢癌、结直肠癌等不同类型的肿瘤细胞具有明显的抑制作用[6]。车叶草苷(asperuloside,ASP)是从白花蛇舌草中分离得到的一种环烯醚萜苷,在抗病毒、抗疟疾、抗肿瘤、抗肥胖、抗炎和免疫调节方面具有良好的药理活性[7-9]。目前研究[10-14]发现,触发ERS是化疗药物诱导癌细胞凋亡的常见途径之一。本研究将ASP作用于人胰腺癌PANC-1细胞,探索ASP对人胰腺癌PANC-1细胞的作用和可能机制。
1 材料与仪器
1.1 细胞与试剂
人胰腺癌PANC-1细胞株购自普诺赛生物(Procell)。ASP(上海源叶生物,质量分数98%, Z30S9B71533),二甲基亚砜(DMSO)(Sigma公司,SHBL0852),PANC-1专用培养基(Procell公司,WHO1112104XP),胰酶(含EDTA)细胞消化液(上海源培生物科技有限公司,H120802),胰酶(EDTA)细胞消化液(安徽博美生物科技有限责任公司,BMB1127),胎牛血清(Gibco公司,1027-106),内质网抑制剂4-苯基丁酸钠盐(4-PBA)(上海麦克林生化科技有限公司,C11876079),CCK-8(Biosharp,70091000),结晶紫(Solarbio,822S044),乙醇(成都市科龙化工试剂厂,20210223),Matrigel基底胶(CORNING,97011),Annexin V-APC/PI双染细胞凋亡检测试剂盒(凯基生物科技有限公司,20210526),PBS缓冲液干粉(上海远慕生物科技有限公司,201224A18)。
活化转录因子6(activating transcription factor 6,ATF6)兔多克隆抗体(24169-1-AP),C/BEP环腺苷酸反应元件结合转录因子同源蛋白(C/EBP Homologus Protein,CHOP)兔多克隆抗体(15204-1-AP),蛋白激酶R样内质网激酶(protein kinase-like ER kinase,PERK)和磷酸化的PERK(p-PERK)兔多克隆抗体(A24390-1-AP,29546-1-AP)均购自proteintech公司; cleaved-caspase-3兔多克隆抗体(AF6311,AF7022)购自AFFinity公司;R1抑制核转录因子-κB抑制蛋白α(p-IRE1α)兔多克隆抗体(PA5-117222)购自赛默飞公司;β-actin兔单克隆抗体(AC026)购自abclonal,生物素化山羊抗兔IgG(H+L)(ab6721)购自abcam公司。
1.2 仪器与设备
DMI1倒置生物显微镜购自LEICA,TDZ4-WS型号台式低速离心机购自长沙湘仪离心机仪器有限公司,MCO-15AC型二氧化碳培养箱购自三洋电机国际贸易有限公司,SW-CJ-2F洁净工作台购自苏净集团苏州安泰空气技术有限公司,SYQ-DSX-280B压力蒸汽灭菌器购自上海宜川仪表厂,HH-1水浴锅购自金坛市荣华仪器制造有限公司,UPH-‖-10T优谱超纯水制造系统购自成都超纯科技有限公司,spectra max PLUS 384酶标仪购自Molecular Devices,cytoflex流式细胞分析仪购自Beckman,化学发光仪购自天能公司。
1.3 方法
1.3.1 细胞培养与分组 PANC-1细胞复苏后培养于含10%胎牛血清的PANC-1专用培养基中,并置于37 ℃、5% CO2和95% O2湿化环境中无菌培养,密度约为80%~90%时,PBS洗涤,使用孵温的胰酶消化,传代。处于对数期的PANC-1细胞作为对照组,PANC-1细胞中加入ASP记为ASP组,PANC-1细胞中加入5 mmol/L 4-PBA记为4-PBA组,PANC-1细胞中加入4-PBA 和ASP记为ASP+4-PBA组。4-PBA组和ASP+4-PBA组在添加ASP前5 mmol/L 4-PBA预处理2 h。
1.3.2 CCK-8 法检测各组细胞活力 取对数生长期的PANC-1细胞,PBS洗涤,胰蛋白酶消化后收集,250 G离心5 min,调节细胞密度为5×104个/mL,100 μL/孔接种于96孔板中(边缘孔用无菌PBS填充),37 ℃、5% CO2恒温培养。待贴壁后按加入含不同终浓度的ASP(1、2、3、4、5 mmol/L)新鲜培养液培养24 h。每组设4个复孔。同时设空白组(加入等量的培养液)和对照组,待药物作用后吸去上清液,每孔加入已稀释的CCK-8工作液110 μL,轻轻晃动培养板数次,37 ℃、5% CO2恒温孵育2 h。采用酶标仪测定450 nm波长处各孔的吸光度,计算细胞增殖抑制率。细胞增殖抑制率=[1-(实验组OD-调零组OD)/(对照组OD-调零组OD)]×100%。并选取抑制率为50%时对应的ASP浓度作为后续处理浓度。
1.3.3 Transwell实验检测各组细胞迁移能力 将各组PANC-1细胞密度调节至5×105个/mL,在24孔板底部加入700 μL含15% FBS的完全培养基后,将Transwell小室放入板中。在Transwell小室中加入200 μL的细胞悬液,于孵箱中培养15 h。用镊子小心取出小室,吸干上室液体,移到预先加入约800 μL预冷乙醇的孔中,室温固定30 min后,吸干上下室固定液,加入适量0.1%结晶紫染液,室温染色30 min。PBS冲洗浸泡数次,取出小室,吸去上室液体,用湿棉棒小心擦去上室底部膜表面上的细胞和染液,适当风干后镜下拍照计数。
1.3.4 Annexin V-APC/PI 检测各组细胞凋亡情况取对数生长期的PANC-1细胞,配制成单细胞悬液,调节细胞密度为2×105个/孔,2 mL/孔接种于6孔板中,37 ℃、5% CO2恒温培养过夜。然后加入不同浓度药物处理细胞后培养48 h。收集细胞,250 g离心5 min,弃上清,PBS重悬后获得悬浮细胞。加入5 μL Annexin V- APC和5 μL PI轻轻混匀,室温避光培养15 min。流式细胞仪进行检测分析。
1.3.5 Western blot检测各组细胞ATF6,CHOP,cleaved-caspase-3,PERK和p-IRE1α蛋白相对表达情况 收集各组细胞,冰PBS洗涤两次后,在RIPA缓冲液中裂解,匀浆30 min,4 ℃下1 500 g离心5 min。采用BCA法检测上清液中蛋白浓度。在12% SDS-PAGE中进行电泳,上样量为30 μg。电泳结束后,将不同的目的片段转至PVDF膜上,在用TBST缓冲液稀释的5%脱脂奶粉中封闭 2 h。在PVDF膜中分别加入ATF6(1∶1 000)、CHOP(1∶1 000)、cleaved-caspase-3(1∶1 000)、PERK(1∶1 000)、p-IRE1α(1∶3 000)和β-actin(1∶100 000)一抗,4 ℃下孵育过夜。用TBST洗膜3次,每次5 min。将PVDF膜放入辣根过氧化物酶标记的二抗(1∶5 000)中,摇床上轻摇,室温孵育2~3 h。TBST冲洗3次,每次10 min。ECL显影液显色,凝胶成像仪上进行目的蛋白条带光密度值计算。目的蛋白相对表达量=目的蛋白积分光密度值/内参积分光密度值。
1.4 统计学分析
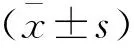
2 结果
2.1 ASP对PANC-1细胞增殖的影响
随着ASP浓度的增加,PANC-1细胞增殖抑制率增加,ASP浓度与细胞的增殖抑制率正相关(P<0.01),说明ASP浓度越高,对PANC-1细胞的增殖抑制作用越强。见图1。

2.2 ASP对PANC-1细胞迁移能力的影响
与对照组相比,ASP组的PANC-1细胞迁移数量明显降低(P<0.05);4-PBA 组与对照组的细胞迁移数量无统计学差异;与ASP组相比,ASP+4-PBA组细胞迁移数量增多(P<0.05)。见图2。
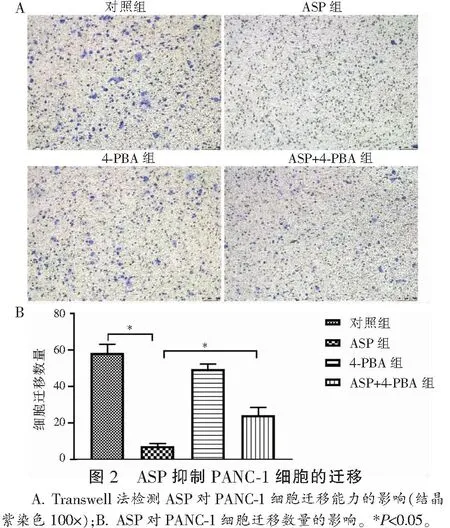
2.3 ASP对PANC-1细胞凋亡率的影响
与对照组相比,ASP组的细胞凋亡率明显增加(P<0.05)。4-PBA组与对照组的细胞凋亡率无明显差异;与ASP组相比,ASP+4-PBA组细胞凋亡率下降(P<0.05)。见图3。
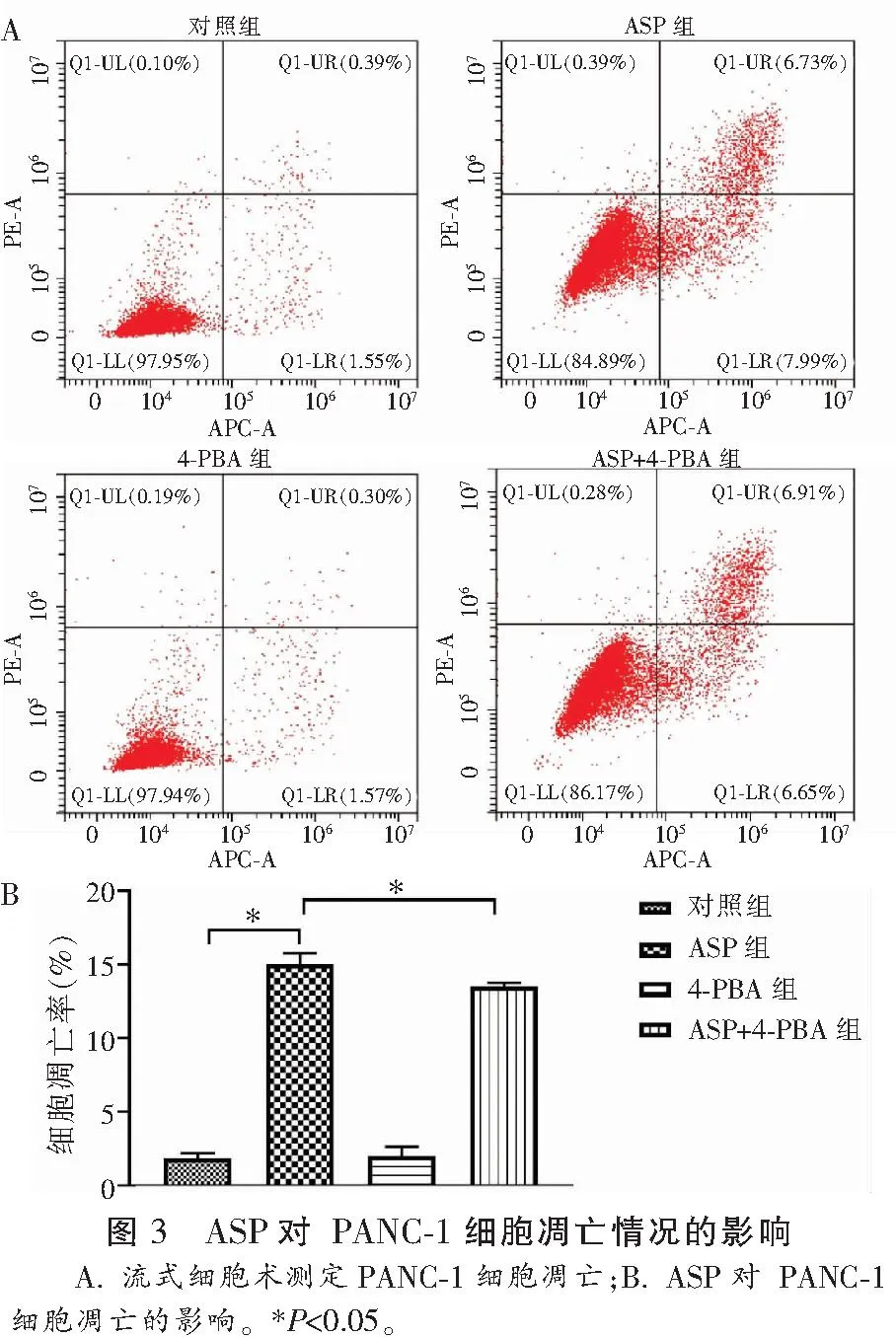
2.4 ASP对PANC-1细胞ERS相关蛋白表达情况的影响
检测各组细胞ATF6,CHOP,cleaved-caspase-3,PERK和p-IRE1α蛋白表达情况。结果发现,与对照组相比,ASP组PANC-1细胞的ATF6,CHOP,cleaved-caspase-3,PERK和p-IRE1α蛋白相对表达量增加,差异具有统计学意义(P<0.05)。与ASP组相比, ASP+4-PBA组PANC-1细胞的ATF6,CHOP,cleaved-caspase-3,PERK和p-IRE1α蛋白相对表达下降,差异有统计学意义(P<0.05)。见图4。
3 讨论
PC是最具侵袭性的癌症之一,由于其早期症状不明显,确诊时已处于晚期,错过最佳手术时间。同时,由于化疗产生的耐药性,导致所有临床分期患者的5年相对生存率仅为6%,预后极差[15]。自2000年以来,其发病率和死亡率分别以每年以1%和0.3%的速度缓慢上升[1]。因此,新型药物的开发,是改善PC患者预后的重要手段。
与传统化疗药物相比,植物化学物质产生的生物活性化合物常表现出强大的疾病治疗特性,且具有较少的不良反应。研究[16]发现,白花蛇舌草是PC患者中药补充治疗时最常用的一种单一草药,可有效降低PC患者死亡率,其机制可能与抑制Sonic hedgehog信号通路从而抑制肿瘤血管生成有关;刘晓卉等[17]发现,白花蛇舌草浓缩液可能通过PKM靶点显著抑制胰腺癌细胞的糖酵解过程和增殖。 而ASP是白花蛇舌草的主要成分,并广泛存在于杜仲科、茜草科如拉拉藤属、巴戟天属等植物中[18],因此本研究将ASP作用于人胰腺癌PANC-1细胞,探讨ASP对于PANC-1细胞的作用。结果发现,与对照组比较,ASP能够抑制PANC-1细胞增殖,且ASP浓度与细胞的增殖抑制率呈正相关,ASP能够降低细胞迁移能力和促使细胞凋亡,即ASP能够从细胞增殖、迁移、凋亡三个方面降低PANC-1细胞活性。实验还发现与对照组比较,ASP组的ERS蛋白ATF6,CHOP,cleaved-caspase-3,PERK和p-IRE1α表达明显增加,说明ASP可能通过激活ERS发挥降低PANC-1细胞活性的作用。为了验证这一结论的科学性,我们使用了ERS抑制剂4-PBA,设置了4-PBA组和4-PBA+ASP组,结果发现,ERS被抑制后,ASP降低PANC-1细胞活性的作用是减弱的,进一步提示ASP可能通过激活ERS发挥抑制PANC-1细胞活性的作用。
内质网是蛋白质合成、折叠和修饰、脂质合成和钙储存的重要细胞器[19]。当内源性或外源性刺激导致内质网合成的蛋白质折叠功能障碍时,大量未折叠或错误折叠的蛋白质聚集在内质网腔内,引起一系列后续反应,称为ERS。如果ERS持续,未折叠蛋白反应(unfolded protein response,UPR)不足以清除积累的未折叠和错误折叠的蛋白时,UPR信号通路将会驱动细胞凋亡[20]。García等[21]发现,从活化的人中性粒细胞或死亡细胞释放的中性粒细胞精氨酸酶-1可通过ERS途径诱导癌细胞凋亡,在PC、乳腺癌、卵巢癌和肺癌细胞可表现出最高的敏感性。Shen等[22]对胰腺癌细胞的研究发现,其分泌的外泌体可被T淋巴细胞吸收后激活p38 MAPK,诱导ERS从而介导T淋巴细胞凋亡,最终导致免疫抑制。本研究发现,ASP能够从细胞增殖、迁移、凋亡三个方面降低PANC-1细胞活性,还发现ASP组的ERS相关蛋白表达明显增加,说明ASP可能通过激活ERS发挥降低PANC-1细胞活性的作用;而ERS被抑制后,ASP降低PANC-1细胞活性的作用是减弱的,进一步说明ASP降低PANC-1细胞活性的作用与ERS具有相关性。
UPR是可传递内质网腔中蛋白折叠状态信息,从而增加蛋白质折叠能力,降低未折叠蛋白负荷的信号途径[23]。ATF6是内质网膜上的关键传感蛋白,可协调UPR,帮助细胞适应ERS[24]。研究[25-26]发现,ATF6可介导UPR信号通路参与非甾体抗炎药诱导的细胞凋亡,并通过促进炎症参与慢性胰腺炎的进展。同时, ATF6上调可能是PC患者预后不良的有效指标[27]。PERK是ERS的主要转导物和中枢调节因子,可通过与自身下游分子相互作用形成通路,参与调节细胞功能[28]。IRE1是一种内质网跨膜蛋白,可通过内质网腔应激敏感结构域监控内质网稳态,并通过细胞质激酶结构域和RNase结构域触发UPR[24]。PERK与IRE1均参与胰腺癌细胞的凋亡[29]。ERS可被ATF6通路,PERK通路和IRE1通路3个信号通路激活[30]。正常状态下,ATF6、PERK和IRE1蛋白处于不活跃状态。但当内质网发生应激时,PERK和IRE1通过自身磷酸化被激活,启动UPR并调控下游转录因子,从而诱导细胞凋亡[31-32]。而CHOP是ERS下游最重要的促凋亡转录因子。当ERS诱导细胞凋亡时,CHOP的累积增加,从而控制其下游蛋白的表达来调节细胞死亡。本研究发现,ASP处理后,PANC-1细胞ATF6,PERK,p-IRE1α和CHOP蛋白表达上调,提示ASP可通过增加ERS相关蛋白ATF6,CHOP,PERK和p-IRE1α的表达,激活ERS,从而发挥降低PANC-1细胞活性的作用。
Caspase是一组以天冬氨酸为底物的半胱氨酸蛋白酶家族,在细胞凋亡过程中起关键作用,其家族高表达可诱发细胞凋亡的发生,caspase-3为其核心成员[33]。Caspase-3通常以无活性的caspase-3前体存在。研究表明,当细胞受到凋亡信号激活或外界有害物质刺激时,caspase-3前体可转变为有活性的caspase-3,即cleaved-caspase-3,从而参与细胞凋亡的发生[34]。本研究发现,ASP组的cleaved-caspase-3表达是明显上调的,说明ASP降低PANC-1细胞活性的作用可能也与cleaved-caspase-3相关,但cleaved-caspase-3与ERS是否具有关联性目前还不明确,需要进一步的实验研究。
综上,ASP能够从细胞增殖、迁移、凋亡三个方面降低PANC-1细胞活性,其机制可能与激活ERS有关。

