脓毒症合并急性肾损伤患者炎症因子、血流动力学变化与肾功能转归的关系
亢志琴,黄静,杨美霞
(山西白求恩医院,1急诊内科,2急诊外科,山西 太原 030000)
脓毒症指宿主对感染的免疫反应失调引起的危及生命的器官功能障碍,是ICU常见的急危重症[1-2]。肾脏是脓毒症最易累及的靶器官,急性肾损伤(Acute kidney injury,AKI)是指机体在短时间内出现肾功能急速下降的临床综合征,是脓毒症最常见、最严重的并发症,发生率高达脓毒症患者的66%,不仅增加患者痛苦、增加治疗难度,还极大程度增加患者死亡风险[3]。目前统计显示,全球范围内每年约1300万人患AKI,约170万人死于AKI及相关并发症严重威胁人民的生命安全,早期分析患者肾功能转归对指导治疗方案、改善患者预后至关重要[4]。目前临床评估肾功能及评价预后指标多为肌酐及尿量,但影响其的因素较多,在评价肾功能转归情况具有一定局限性。近年研究发现,炎症因子及血流动力学改变可影响脓毒症合并AKI患者肾功能变化[5-6],与患者肾功能转归方面存在一定联系。本研究选择脓毒症合并AKI患者为观察对象,旨在分析脓毒症合并AKI患者炎症因子、血流动力学变化与肾功能转归的关系。
1 资料与方法
1.1 一般资料
选择2021年1月至2022年12月于山西白求恩医院收治的脓毒症合并AKI患者120例为观察对象,纳入标准:(1)患者均符合国际关于脓毒症的诊断标准[7];(2)患者符合国际改善全球肾脏病预后组织(KDIGO)所制定的AKI诊断标准[8];(3)临床资料完整无流失。排除标准:(1)为哺乳期或妊娠期妇女;(2)合并恶性血液病;(3)1个月内应用免疫抑制剂;(4)合并重要器官严重功能障碍。根据28 d肾小球滤过率(Glomerular filtration rate,eGFR)水平分为A组(28 d eGFR≥90 mL·min-1·1.73 m-2,n=36)、B组(15 mL·min-1·1.73 m-2≤28 d eGFR<90 mL·min-1·1.73 m-2,n=66)、C组(28 d eGFR<15 mL·min-1·1.73 m-2,n=18)。其中A组男性20例,女性16例,年龄(71.25±5.85)岁;B组男性36例,女性30例,年龄(70.86±4.04)岁;C组男性10例,女性8例,年龄(71.07±5.23)岁。各组年龄、性别等资料比较,差异无统计学意义(P>0.05)。本研究均经医院伦理会批准同意。
1.2 观察指标
实验室指标:采集各组受检者入急诊2 h内的静脉血,3 000 r/min离心10 min,于-40 ℃环境中低温保存,避免反复冻融。采用酶联免疫吸附法检测患者白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)、降钙素原(PCT)]水平。
血流动力学评价:采用心电监护仪检测并记录各组患者平均动脉压(MAP)、心率(HR)、心排出量(CO),计算心脏指数(CI)值,CI=CO(L/min)/体表面积(m2)。
1.3 统计学分析
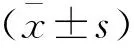
2 结果
2.1 各组患者血清炎症指标比较
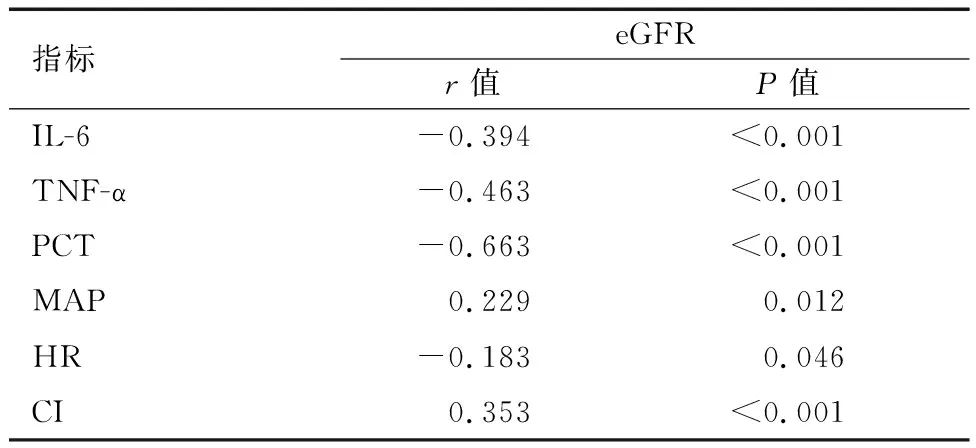
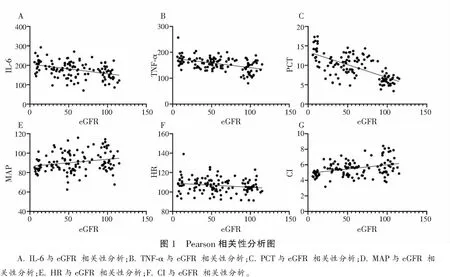
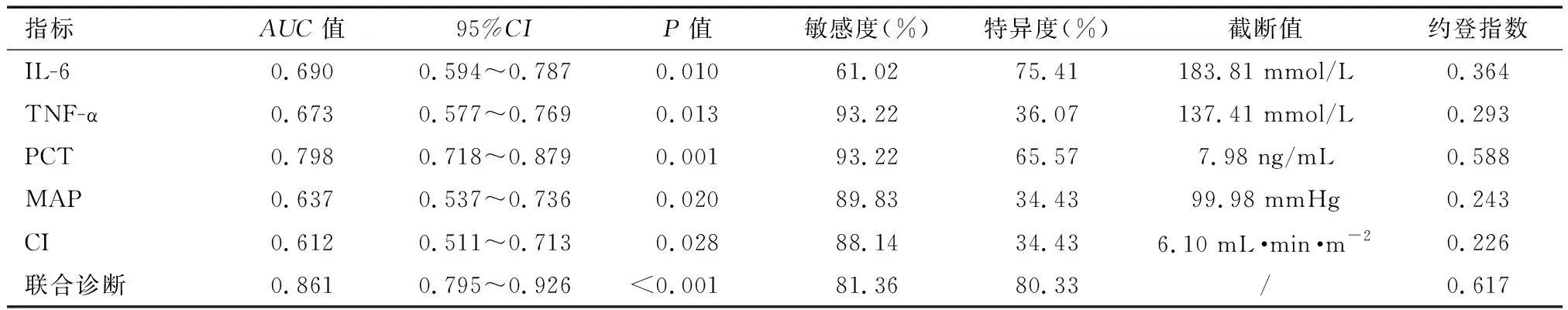
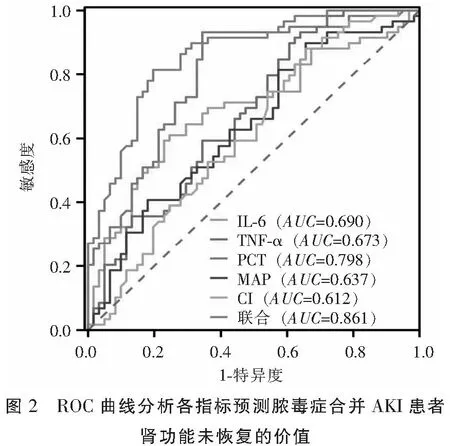
各组患者血清IL-6、TNF-α、PCT水平比较:A组 表1 各组患者血清炎症指标比较 各组患者HR水平无统计学差异(P>0.05)。B组、C组患者CI水平低于A组,C组患者MAP、CI水平低于B组,差异有统计学意义(P<0.05)。见表2。 表2 各组患者血流动力学指标比较 Pearson相关性分析显示,IL-6、TNF-α、PCT、HR与脓毒症合并AKI患者28 d eGFR水平负相关(r=-0.394、-0.463、-0.663、-0.183,P<0.05);MAP、CI与脓毒症合并AKI患者28d eGFR水平正相关(r=0.229、0.353,P<0.05)。见表3及图1。 表3 脓毒症合并AKI患者炎症因子、血流动力学与肾功能转归的相关性分析 ROC曲线显示,IL-6、TNF-α、PCT、MAP 、CI在预测脓毒症合并AKI患者肾功能未恢复的曲线下面积(AUC)分别为0.690、0.673、0.798、0.637、0.612,多项指标联合预测脓毒症合并AKI患者肾功能未恢复的AUC为0.861(P<0.05)。见表4及图2。 表4 ROC曲线分析各指标预测脓毒症合并AKI患者肾功能未恢复的价值 脓毒症是由宿主对感染的反应失调引起的器官功能障碍,感染最常见的器官之一是肾脏,导致AKI的发生,增加了患慢性伴随性疾病的风险,此外脓毒症AKI常见于危重患者,与慢性肾脏病、心血管事件和死亡风险增加等不良结局密切相关。目前,研究[9]发现,脓毒症合并AKI患者死亡率比脓毒症无AKI患者高3~5倍,早期预测脓毒症合并AKI患者肾功能转归情况并给予针对性干预有助于改善患者预后。 目前临床多选择血清肌酐和尿量用于AKI诊断和分期。但血清肌酐和尿量的变化在实际肾损伤后发生相对较晚,因此不能提供AKI的早期或及时检测。此外,血清肌酐和尿量受到多种因素的影响,例如脱水、膳食蛋白质摄入、肌肉质量、利尿剂等,因此在预测肾功能转归情况存在一定滞后性[10-11]。PCT是由116个氨基酸残基组成的糖蛋白质,是由甲状腺C细胞生成的降钙素的前体蛋白,临床多选择PCT作为反应细菌感染的敏感指标,反应全身炎症反应的活跃程度,脓毒症感染后,PCT水平急速升高,且PCT水平越高说明脓毒症病情越严重,对肾功能损伤情况越显著,因此可能影响肾功能转归[12-13]。IL-6作为一种前炎性细胞因子,可参与机体应激反应及免疫调节过程,当脓毒症导致机体全身炎症反应时,IL-6水平升高参与以单核巨噬细胞系统激活为主的早期炎症反应,导致肾功能损伤,影响肾脏疾病的发生、发展及转归[14]。TNF-α是肾脏损伤因素之一,可通过炎症反应诱导动脉粥样硬化,导致肾功能损伤,而肾功能损伤可出现机体液体潴留、机械张力增加情况,加重炎症反应,形成恶性循环,因此TNF-α的高表达对肾功能转归造成不利影响。本研究中,B组、C组患者血清IL-6、TNF-α、PCT水平高于A组,C组患者血清IL-6、TNF-α、PCT水平高于B组。说明脓毒症合并AKI患者血清IL-6、TNF-α、PCT水平变化与肾功能转归情况存在一定联系,与王佳等[15]研究结果类似,该研究发现,血清NGAL、PCT水平的升高与脓毒症合并AKI患者肾功能转归不良有关,早期监测其水平变化有助于预测患者预后情况。 脓毒症发生后,机体可出现不同程度的外周血管收缩舒张功能异常情况,导致机体血流分布异常,从而出现血流动力学改变。CI反应机体心功能变化,CI水平越高说明机体处于高循环状态,不仅增加心脏负担,诱导心力衰竭等心脏病,还可能增加因心源性休克、急性心力衰竭导致的AKI,加重脓毒症病情[16-17]。MAP水平变化可反映机体血液循环及供应状态,是评价人体状态的指标之一,MAP水平较低,机体肾脏的血液供应越低,肾脏组织缺血缺氧情况越严重,对肾功能转归造成不利影响[18-19]。本研究中,B组、C组患者CI水平高于A组,C组患者MAP、CI水平高于B组。说明脓毒症合并AKI患者血流动力学改变与肾功能转归存在一定联系,另外Pearson相关性分析显示,IL-6、TNF-α、PCT与脓毒症合并AKI患者28d eGFR水平负相关;MAP、CI与脓毒症合并AKI患者28d eGFR水平正相关。ROC曲线显示,IL-6、TNF-α、PCT、MAP、CI、多项指标联合诊断在预测脓毒症合并AKI患者肾功能未恢复的AUC分别为0.690、0.673、0.798、0.637、0.612、0.861。说明脓毒症合并AKI患者炎症因子及血流动力学变化与肾功能转归存在密切联系,早期监测其水平变化有助于预测肾功能未恢复风险,多项指标联合诊断效果更佳,有助于医师早期预测脓毒症合并AKI患者预后情况,对指导治疗方案、改善患者预后情况具有重要意义。 综上,IL-6、TNF-α、PCT、MAP、CI与脓毒症合并AKI患者肾功能转归不良相关,早期监测有助于预测脓毒症合并AKI患者预后情况,监测其水平变化可提高临床预测预后的准确性,对临床实践具有一定指导意义,可帮助指导治疗方案帮助提高治疗效果,降低住院费用及病死率。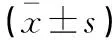
2.2 各组患者血流动力学指标比较
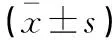
2.3 脓毒症合并AKI患者炎症因子、血流动力学与肾功能转归的相关性分析
2.4 ROC曲线分析各指标预测脓毒症合并AKI患者肾功能未恢复的价值
3 讨论

