响应面法优化结球菊苣多糖的磷酸化修饰工艺
姜振浩,朱建星,张万忠
(沈阳化工大学制药与生物工程学院,辽宁沈阳 110142)
结球菊苣(Cichoricum intybusvar.foliosumHegi),是菊苣属的一种多年宿根性草本植物。作为一种药食两用植物,红菊苣颜色鲜艳,营养价值很高,既可以直接食用也有很高的药用价值[1]。结球菊苣含有多种活性成分,其中结球菊苣多糖含量最多。菊苣多糖具有抗氧化、消炎调节免疫系统、抗肿瘤、抗病毒等生物活性[2-3]。
结构修饰可以改变多糖的分子量、取代基团类型和分子结构,从而影响多糖的生物活性[4]。到目前为止,常见的几种化学改性方法包括羧甲基化[5]、硫酸化[6]、硒化[7]、磷酸化[8-9]、乙酰化[10]等。磷酸化后的多糖与天然多糖比一些基团(例如羟基等)被磷酸根所取代,分子量也同时发生了改变,从而导致其多糖生物活性增强[11-13]。Lin 等[14]对川牛膝多糖磷酸化研究发现磷酸化修饰后提高了其免疫活性;胡晓波等[15]对桑葚多糖磷酸化修饰前后的抗氧化活性研究,实验表明磷酸化修饰后的桑葚多糖的抗氧化活性增强。常用的磷酸化方法有三氯氧磷(POCl3)[16]、磷酸及其酸酐[17]、磷酸盐[18]等。三氯氧磷法反应时间短、操作步骤简单的优点,但是氯化氧磷的使用可能会导致目标分子降解,反应过程中氢离子浓度增加,需要在反应过程中加入碱性试剂,如吡啶和三乙胺来中和,防止多糖降解[19-21];磷酸及其酸酐或二者混合物是最早使用的磷酸化试剂,磷酸基团活性大,但是磷酸及其酸酐主要的缺点是在反应过程中容易导致糖样降解[22],产物收率不高,取代度也不理想[23-24];磷酸盐法是一种温和的多糖磷酸化反应[25],常用于多糖磷酸化修饰的磷酸盐试剂主要有多聚磷酸钠[26]、磷酸氢二钠、三偏磷酸钠[27]、磷酸二氢钠及这些盐的混合物[28],磷酸盐法制备工艺简便、安全、经济效益高[29],产生的副产物和有毒有害物较少,在工业生产中应用最为普及。本文选择三聚磷酸钠作为磷酸化试剂,反应无有机试剂参与,方便后续处理。
多糖本身具有多种生物活性,理论上磷酸化修饰能够提高多糖抗氧化活性,随着结构分析方法的日渐完善,磷酸化修饰多糖有更广泛的应用前景。截至目前,结球菊苣多糖的磷酸化尚未见报道,因此,本文以结球菊苣为原料,用复合酶法水解浸提结球菊苣多糖,通过单因素实验确定反应时间、反应温度、多糖与磷酸化试剂摩尔比、反应pH,从而设计响应面试验优化磷酸化修饰工艺条件,并且通过测定其对DPPH 自由基清除能力,来确定磷酸化结球菊苣多糖的抗氧化活性,为结球菊苣多糖及其磷酸化衍生物的开发与利用提供参考。
1 材料及方法
1.1 材料与仪器
结球菊苣 上海金山区银龙蔬菜配送有限公司;果胶酶、纤维素酶(酶活大于15000 U/g) 国药集团化学试剂有限公司;AB-8 大孔树脂、DEAE-52 纤维素、葡聚糖G-200/G-15 北京索莱宝公司;半水酒石酸锑钾、钼酸铵、浓盐酸、氢氧化钠、硫酸、抗坏血酸、硫酸钠、三聚磷酸钠等 均为分析纯,天津大茂公司;DPPH 色谱纯,国药集团化学试剂有限公司。
UV1100 型紫外分光光度计 上海天美公司;Synergy2 多功能酶标仪 美国伯腾公司;恒温培养振荡器 上海智城公司;MRS 微波消解仪 美国CEM 公司;RE-6000 型旋转蒸发器 上海亚荣公司;GT2 型冻干机 德国SRK 公司;Vector22 型傅立叶变换红外光谱 美国尼高力公司。
1.2 实验方法
1.2.1 结球菊苣多糖的制备 采用复合酶法对结球菊苣多糖进行水解浸提。取50 g 干燥后的结球菊苣粉末,加入复合酶(纤维素酶0.1 g,果胶酶0.025 g),按料液比1:30 于55 ℃条件下,摇床振荡2 h,85 ℃灭酶10 min,将灭酶后反应液抽滤除去沉淀,收集上清液。Sevage 法脱蛋白、AB-8 大孔树脂脱色后,以蒸馏水为洗脱溶剂用纤维素DEAE-52、葡聚糖G-200 除杂,经冷冻干燥后得结球菊苣多糖。
1.2.2 磷含量测定 有关磷含量测定参考《水质总磷的测定钼酸铵分光光度法》(GB 11893-1989)中的方法来进行,并按照该实验略微修改。
磷标准曲线的制作:分别取25 mL 的去离子水以及等梯度浓度的磷标准液(0.24、0.48、0.72、0.96、1.2 mg/L)在150 ℃下微波消解15 min,待冷却后用50 mL 容量瓶加水定容,将全部的定容液放入50 mL锥形瓶中依次加入10%的抗坏血酸溶液1 mL,半分钟后加入钼酸盐溶液2 mL 混匀之后室温放置15 min后,测定在700 nm 的吸光值。以吸光度为纵坐标,磷酸根浓度为横坐标,得到磷含量标准曲线。y=0.0035+0.07112x,R2=0.9981。
0.2 g 的结球菊苣多糖跟13 mL 的去离子水,加入50 mg 硫酸钠混匀,再加入2 mL 的0.1 g/mL 的三聚磷酸钠,用1 mol/L 的HCl 或者1 mol/L 的NaOH 调节pH 到7,80 ℃反应3 h 之后,用预处理后的SepHadex G-15 凝胶柱以蒸馏水为洗脱溶剂除盐,冷冻干燥。
总磷含量的测定:取冷冻干燥的磷酸化多糖样品1 mg 加去离子水定容至10 mL,从中取出1 mL的稀释液,用去离子水定容到25 mL,在150 ℃下微波消解15 min,冷却后加水定容到50 mL,加入10%的抗坏血酸溶液1 mL,30 s 后加入钼酸盐溶液2 mL混匀室温放置15 min,测定在700 nm 处的吸光值。
游离磷含量的测定:取冷冻干燥的磷酸化多糖样品1 mg 加水定容至50 mL,依次加入10%的抗坏血酸溶液1 mL,30 s 后加入钼酸盐溶液2 mL 混匀之后室温放置15 min 后,测定在700 nm 处的吸光值。
采用上述测定方法,对冷冻干燥的磷酸化多糖样品磷含量进行测量和计算,以样品中的磷含量作为反应结果的衡量标准,计算公式如下:
1.2.3 结球菊苣多糖磷酸化单因素实验
1.2.3.1 反应时间对磷酸化修饰效果的影响 取5 个锥形瓶分别加0.2 g 的结球菊苣多糖跟13 mL的去离子水,加入50 mg 硫酸钠混匀,再加入2 mL 0.1 g/mL 的三聚磷酸钠水溶液(结球菊苣多糖与三聚磷酸钠的摩尔比为1:10),调pH 到7,在80 ℃反应2、3、4、5、6 h 后取出冷却,用预处理后的Sep-Hadex G-15 凝胶柱以蒸馏水为洗脱溶剂除盐,冷冻干燥,测定样品总磷和游离磷含量。
1.2.3.2 反应温度对磷酸化的影响 取5 个锥形瓶分别加0.2 g 的结球菊苣多糖跟13 mL 的去离子水,加入50 mg 硫酸钠混匀,再加入2 mL 0.1 g/mL 的三聚磷酸钠水溶液,调pH 到7,分别在60、70、80、90、95 ℃条件下反应3 h 后取出冷却,用预处理后的SepHadex G-15 凝胶柱以蒸馏水为洗脱溶剂除盐,冷冻干燥,测定样品总磷和游离磷含量。
1.2.3.3 pH 对磷酸化的影响 取5 个锥形瓶分别加0.2 g 的结球菊苣多糖跟13 mL 的去离子水,加入50 mg 硫酸钠混匀,再加入2 mL 0.1 g/mL 的三聚磷酸钠水溶液,分别调pH 到4、6、7、8、9,在80 ℃条件下反应3 h 后取出冷却,用预处理后的Sep-Hadex G-15 凝胶柱以蒸馏水为洗脱溶剂除盐,冷冻干燥,测定样品总磷和游离磷含量。
1.2.3.4 多糖与磷酸化试剂摩尔比对磷酸化的影响
取5 个锥形瓶分别加0.2 g 的结球菊苣多糖及13 mL 的去离子水,加入50 mg 硫酸钠混匀,分别加入1.2、1.6、2、2.4、2.8 mL 的0.1 g/mL 三聚磷酸钠水溶液(获得多糖与磷酸化试剂摩尔比1:6、1:8、1:10、1:12、1:14),调pH 到7,在80 ℃条件下反应3 h 后取出冷却,用预处理后的SepHadex G-15 凝胶柱以蒸馏水为洗脱溶剂除盐,冷冻干燥,测量样品总磷和游离磷含量。
1.2.4 结球菊苣多糖磷酸化响应面法优化工艺条件
在单因素实验基础上,以磷酸化结球菊苣多糖磷含量为考察指标,对反应时间(A)、反应温度(B)、反应pH(C)、多糖与磷酸化试剂摩尔比(D)进行响应面优化。采用Design-Expert 8.0 软件设计响应面试验(见表1),选用Box-Behnken design(BBD)模型,以磷酸化产物中磷含量为响应值,做4 因素3 水平二次回归正交组合试验。
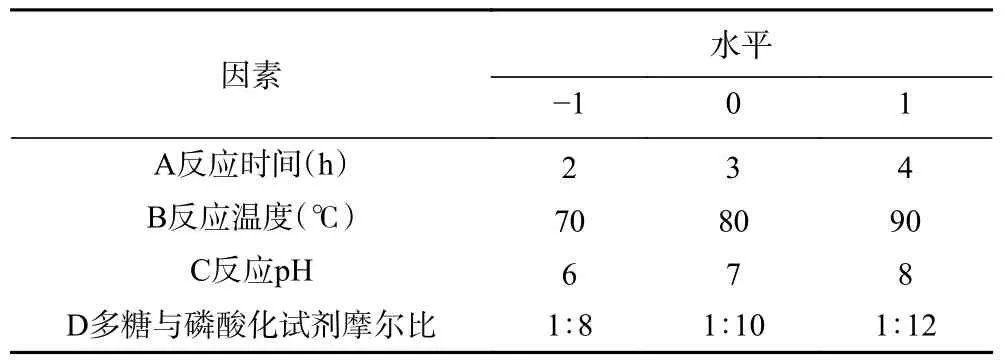
表1 响应面因素与水平表Table 1 Response Surface Factors and Levels
1.2.5 磷酸化结球菊苣多糖的傅里叶红外光谱的测定 将冷冻干燥的磷酸化结球菊苣多糖与KBr 混合均匀、压片,在波数400~4000 cm-1进行红外光谱扫描,将磷酸化反应前后的红外光谱变化进行比较。
1.2.6 DPPH 自由基清除能力试验 用无水乙醇在100 mL 容量瓶中配制浓度为0.5 mmol/l 的DPPH-乙醇溶液,放冰箱保存备用。将抗坏血酸与纯化后的磷酸化前后结球菊苣多糖溶液用水分别稀释到0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 mg/mL,取1 ml 的DPPH 乙醇溶液,分别向其中加入1 mL 不同质量浓度的抗坏血酸与磷酸化前后结球菊苣多糖溶液,在室温下避光静置30 min,在波长517 nm 处测定吸光度(A样品)。再用乙醇代替DPPH-乙醇溶液作为对照组测定吸光度(A对照);用蒸馏水代替待测样品做空白组,测定吸光度(A空白)。DPPH 自由基清除率计算公式如下:
1.3 数据处理
本实验所有实验数据均重复测定三次,结果取平均值。采用SPSS Statistics 26 和Origin 2021 软件进行数据分析及作图及显著性分析(P<0.05),采用Design-Expert 8.0 软件设计响应面实验并对数据进行回归分析。
2 结果与分析
2.1 单因素实验结果
2.1.1 反应时间对磷酸化的影响 以结球菊苣多糖磷含量作为指标,来确定磷酸化修饰程度,磷含量越高表示磷酸根基团的接枝率越高,即磷酸化修饰程度越高[29]。反应时间对磷含量的影响见图1,由图1 可以看出,随着反应时间的进行磷含量呈先增大后减少的变化趋势,在2~3 h 范围内时,多糖修饰样品中的磷含量随着时间的延长而逐渐增加,当反应3 h 时,磷含量达到最大值(4.57%),在3~6 h 范围内,随着时间的增加磷含量呈下降趋势。在对多糖进行磷酸化反应时,时间太短磷酸化反应不完全,磷的取代度较低,但是长时间的高温反应又会使多糖结构破坏,降低磷酸化多糖的取代度,所以多糖修饰样品中的磷含量会一开始随着时间的增加而增加,在到达一定时间后又会随着时间的增加而降低[30]。
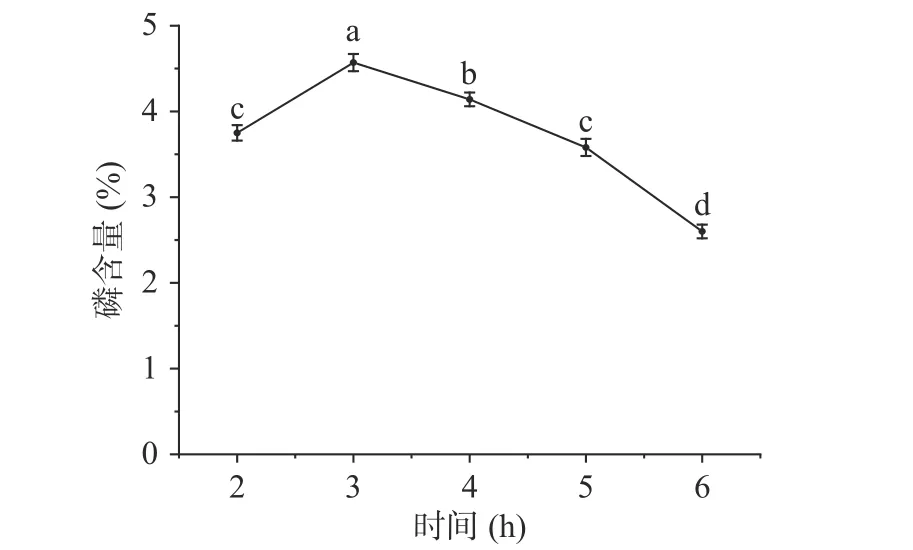
图1 反应时间对磷含量的影响Fig.1 Effect of reaction time on phosphorus content
2.1.2 反应温度对磷酸化的影响 反应温度对磷含量的影响见图2,由图2 可以看出在60~80 ℃时,随着温度的提高多糖修饰样品中的磷含量呈现不断增加的趋势,当温度为80 ℃到达最大值(4.58%),在80~95 ℃时,磷含量随温度的提高呈减少的趋势。在对多糖磷酸化修饰时,温度较低磷酸化的反应缓慢,磷的取代度较低,随着温度的升高,接枝量提高。可能是因为温度升高,使多糖分子的反应活性增强,磷酸酯化的程度也随之增加,当温度进一步升高时,由于过高的温度导致多糖结构的破坏,从而磷含量降低[30]。

图2 反应温度对磷含量的影响Fig.2 Effect of reaction temperature on phosphorus content
2.1.3 pH 对磷酸化的影响 pH 对磷含量的影响见图3,由图3 可以看出在pH 为4~7 时,随pH 的增加多糖修饰样品中的磷含量呈上升的趋势,当pH为7 时到达最大值(4.56%),在pH 为7~9 时,随pH的增加多糖修饰样品中的磷含量呈下降的趋势。在磷酸化多糖时过酸或者过碱都会造成接枝率降低,原因可能是三聚磷酸钠在较低的pH 下不稳定,会分解成活性较低的焦磷酸钠和正磷酸钠,而pH 过高会导致磷酸酯化的逆反应增强,使磷酸根水解降低接枝率。只有在合适的pH 下,才有比较高的磷酸根取代度[30]。
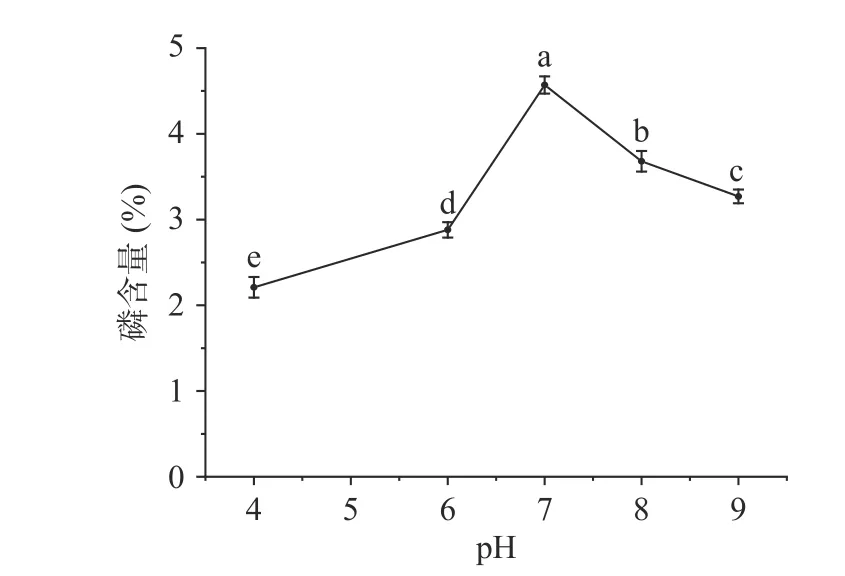
图3 pH 对磷含量的影响Fig.3 Effect of pH on phosphorus content
2.1.4 多糖与磷酸化试剂摩尔比对磷酸化的影响多糖与磷酸化试剂摩尔比对磷含量的影响见图4,由图4 可以看出在摩尔比1:6~1:10 时,随着磷酸盐的增加样品中的磷含量呈上升趋势,当多糖与磷酸化试剂摩尔比为1:10 时到达最大值(4.48%),进一步增加摩尔比磷含量趋于稳定不再增加。在一定范围内,反应所需磷酸根未达到饱和,菊苣多糖结合磷的含量随磷酸盐的量增加而增加,而当摩尔比达到1:10 时,磷酸根维持平衡,这可能是因为磷酸盐多于反应所需,多糖结合的磷酸根已达到饱和[30]。
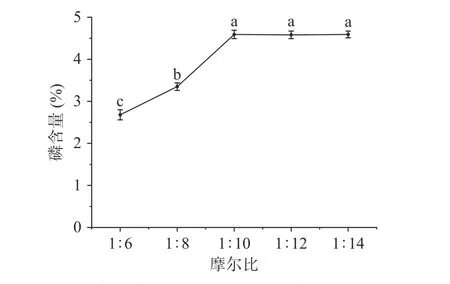
图4 多糖与磷酸化试剂摩尔比对磷含量的影响Fig.4 Effect of polysaccharides and phosphorylation reagents molar ratio on phosphorus content
2.2 结球菊苣多糖磷酸化工艺优化结果
2.2.1 响应面试验设计及结果 在单因素实验结果的基础上,对结球菊苣多糖磷酸化工艺条件进行优化,用Design Expert 8.0 软件设计4 因素3 水平的二次回归响应面,得到试验数据,磷酸化结球菊苣多糖响应面试验设计及响应值见表2,并作回归模型方差和显著性分析,结果见表3。
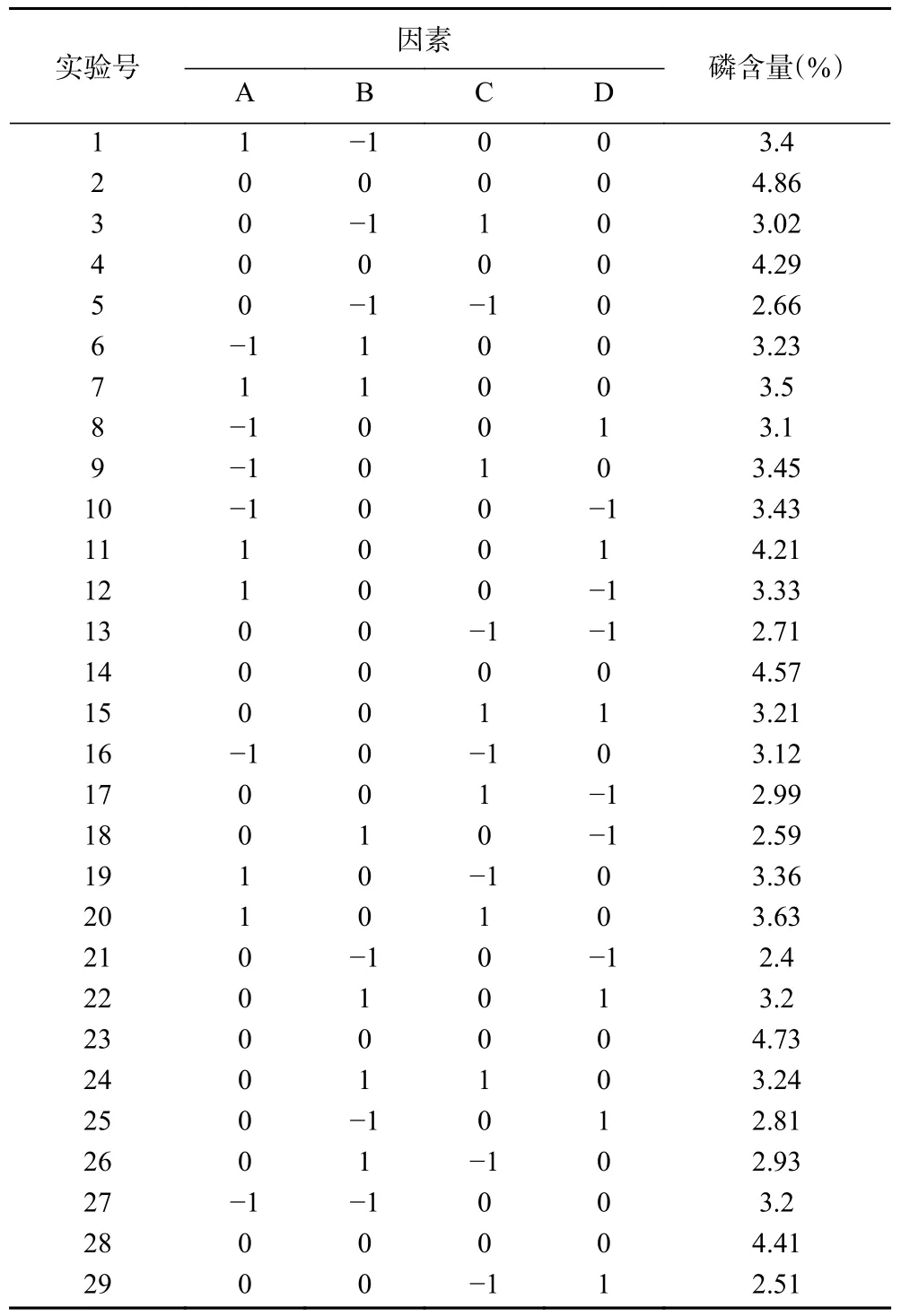
表2 响应面试验设计及结果Table 2 Response surface test design and results

表3 回归模型的方差分析Table 3 Analysis of variance of regression model
对试验结果进行二次回归分析,计算得到回归方程:Y=4.57+0.16A+0.1B+0.19C+0.13D+0.018AB-0.015AC+0.3AD-0.012BC+0.05BD+0.1CD-0.3A2-0.9B2-0.82C2-0.86D2。由表3 可以得出,总决定系数R2=0.9538,表明此模型拟合良好,实验值与预测值之间的差异很小,校正系数R2Adj=0.9077,表明此模型可以解释90.77%的响应值;此模型的P<0.0001,失拟项P=0.7180,说明回归方程理想,模型显著。综上所述,该模型可用于分析和预测磷酸化修饰结球菊苣多糖的工艺优化。
2.2.2 响应面试验的交互作用分析 根据表3 的数据可以得到,分别将模型中的两个因素固定在中间水平,得到另外两个因素交互作用对磷含量的子模型并根据模型绘制三维曲面图,见图5。

图5 时间与摩尔比的交互作用对磷含量的影响Fig.5 Effect of time and molar ratio interaction on phosphate content
由图5 可知,响应面交互图呈降落伞状,响应面交互图坡度越大表明磷含量的变化越快,即更为显著。这说明多糖与磷酸化试剂的摩尔比、反应时间之间的交互性对磷含量有明显的影响。
2.2.3 模型的优化及验证实验 通过Design Expert软件对试验进行优化,按照回归模型预测可得到结球菊苣多糖磷酸化的最佳工艺条件为:反应时间3.34 h,反应温度80.62 ℃,多糖与磷酸化试剂的摩尔比1:10.29 和反应pH7.12,在此反应条件下结球菊苣多糖磷含量为4.62%。为验证此结果的可靠性,进行三次平行试验,根据实际情况修正工艺条件为:反应时间3.3 h,反应温度81 ℃,多糖与磷酸化试剂摩尔比1:10,调整反应pH 为7.1,测得多糖磷含量平均值为4.75%,该值与模型预测值接近,验证了该模型的可靠性。
2.3 磷酸化前后结球菊苣多糖的红外光谱分析
由图6 可以看出该吸收峰为典型的多糖吸收峰,并且磷酸化前后峰型未发生较大变化,说明多糖的主体结构没有变化。磷酸化结球菊苣多糖和结球菊苣多糖在3409 cm-1附近处的吸收峰为-OH 的伸缩振动吸收峰,表明磷酸化结球菊苣多糖和结球菊苣多糖中含有分子内氢键;2925、1435 cm-1附近处为C-H 的伸缩振动吸收峰,为糖类的特征吸收峰;其中1651 cm-1附近处的吸收峰是羰基C=O 键的吸收峰。除此之外,磷酸化结球菊苣多糖在1235 cm-1处的吸收峰为P=O 键的伸缩振动吸收峰,973 cm-1处的吸收峰为P-O-C 键的吸收峰,这两个峰的出现表明有磷酸基团接入[15]。综上,磷酸化修饰结球菊苣多糖成功,所得产物为磷酸化结球菊苣多糖。

图6 结球菊苣多糖与磷酸化结球菊苣多糖的红外光谱图Fig.6 Infrared spectrum absorption diagram of chicory polysaccharides and phosphorylated red chicory polysaccharides
2.4 磷酸化结球菊苣多糖DPPH 自由基清除能力分析
由图7 可知,磷酸化结球菊苣多糖在一定浓度范围内,浓度与清除率呈现量效关系,并且浓度越高,多糖对DPPH 自由基的清除率越高。在浓度为4 mg/mL 时,磷酸化结球菊苣多糖和结球菊苣多糖的清除率分别为56.36%、45.08%,磷酸化结球菊苣多糖较结球菊苣多糖的清除率提高了11.28%,说明磷酸化修饰提高了结球菊苣多糖清除DPPH 自由基的能力[26]。多糖的抗氧化活性是因其含有羟基等还原性基团,结球菊苣多糖经过磷酸化修饰后其分子结构发生了改变,从而影响了结球菊苣多糖的抗氧化活性。但目前磷酸化结球菊苣多糖的抗氧化作用机理还不明确,仍需进一步探讨研究。
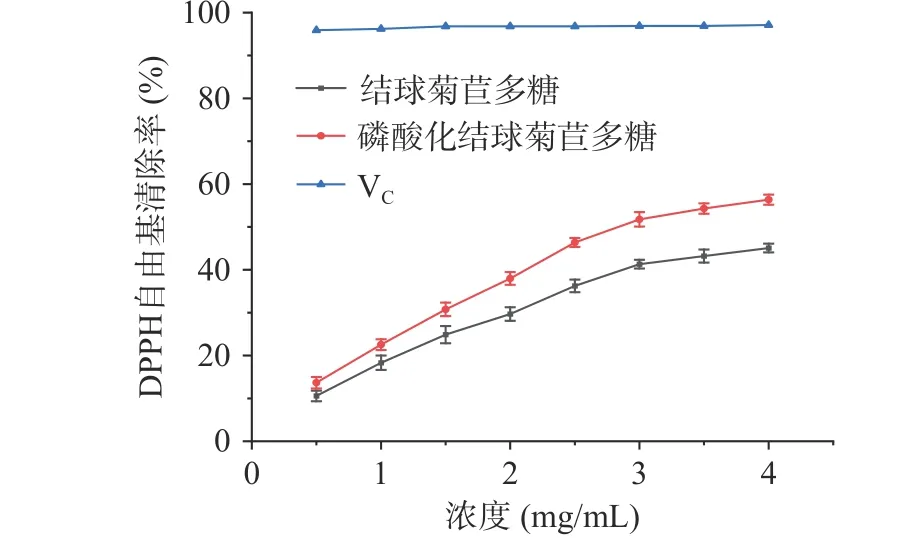
图7 磷酸化结球菊苣多糖的DPPH 自由基清除率Fig.7 DPPH radical scavenging rate of phosphorylated chicory polysaccharide
3 结论
通过单因素与响应面试验优化后,得到磷酸化修饰结球菊苣多糖的最优工艺参数,在最优工艺参数下制备的磷酸化结球菊苣多糖中磷含量为4.75%±0.04%,与模型预期值4.62%接近。红外光谱显示结球菊苣多糖成功引入了磷酸根基团,说明磷酸化修饰成功。抗氧化活性试验结果表明,磷酸化结球菊苣多糖较结球菊苣多糖具有更强的抗氧化活性,在磷酸化结球菊苣多糖浓度为4 mg/mL 时,对DPPH 自由基的清除率为56.36%,说明通过磷酸化修饰的方法能够提高结球菊苣多糖的抗氧化活性,磷酸化结球菊苣多糖在食品工业中具有作为新型食品添加剂和抗氧化剂的潜力。后续可进一步考察磷酸化结球菊苣多糖的抗肿瘤活性、抗病毒活性和免疫调节活性等更多生物活性,扩展磷酸化结球菊苣多糖在食品药品领域的开发与利用。

