副干酪乳杆菌ALAC 产抗真菌肽发酵工艺的优化
岳子尧,董力源,李 恋,2,满都拉,孙子羽,陈忠军,*
(1.内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特 010018;2.内蒙古医科大学基础医学院,内蒙古呼和浩特 010107)
乳酸菌是日常生活中人们较为熟悉的菌种,不论是酸奶、泡菜还是各类饮品都有其参与发酵,并且在自然界中分布广泛。乳酸菌在帮助肠道蠕动、促进消化的同时,可以降低胆固醇吸收,调节免疫系统,使乳糖不耐受的症状得到缓解[1-3]。目前已被证实某些乳酸菌能够产生抗菌肽,除抑制细菌、真菌外,还能对癌细胞产生灭杀作用[4-5]。乳酸菌抗菌肽因其生物安全性及抑菌活性在食品加工保藏、饲料生产、及医药领域已有较成功应用[6]。自乳链球菌素Nisin 和片球菌素Pediocins PA1 被批准作为食品防腐剂以来[4],新型乳酸菌抗菌肽已成为最主要研究热点和重要资源。因此,新型乳酸菌抗菌肽资源的开发挖掘势在必行。
真菌污染是食品、饲料、医疗及环境领域最广泛的污染类别,不仅给生产带来明显经济损失,而且真菌毒素直接危害人类健康[7]。现有化学防霉剂的大量使用导致致腐霉菌和酵母耐药性增加,采用天然生物防霉剂代替化学防腐剂势在必行[8-9]。由于抗真菌肽提取成本过高,目前商业化乳酸菌防霉产品几乎全部采用了活菌剂型或无细胞提取物。
乳酸菌抗菌肽的生物合成发生在对数生长期,一般分泌到细胞外,但在特殊条件下会留在细胞内,导致抑菌活性降低。有研究表明,乳酸菌的培养基内主要营养物质改变后,其产生抗菌肽抑菌活性就会发生改变[10-12]。影响乳酸菌抑菌活性的主要因素除了培养基外还有菌株生长的环境与营养条件。封成玲等[13]采用单因素与正交试验对产酶溶杆菌L-43 的发酵条件进行了优化,使抗菌肽产量进一步得到了提高。江晨等[14]采用单因素实验和响应面试验对花生抗菌肽复合物的工艺进行了优化,研究发现制备的花生抗菌肽复合物可以提高对枯草芽孢杆菌、大肠杆菌和米曲霉的抑菌效果。秦楠等[15]采用单因素实验和响应面法优化解淀粉芽孢杆菌HRH317 菌株产抗菌肽的发酵条件。Amiri 等[16]对嗜酸乳杆菌LA-5、乳酸芽孢杆菌BB-12 生物生产抗菌肽及其混合培养物的发酵温度、发酵时间等进行优化,从而增强了对单核细胞增生李斯特菌的抑制活性。目前虽对于乳酸菌产抗菌肽的发酵条件做了大量研究,但是大多针对具有抑制细菌作用的抗菌肽,而对于抑真菌肽研究很少。
本课题组前期从内蒙古传统发酵食品中分离出副干酪乳杆菌ALAC,发现其分泌的抗真菌肽对常见食品致腐霉菌和酵母具有强烈抑制活性,且安全无毒[17-18]。本研究将菌株ALAC 在前期优化的乳清培养基中发酵,通过单因素实验与响应面分析探究接种量、培养基初始pH、发酵时间及发酵温度对其产抗真菌肽的影响,并确定最佳发酵工艺,为后期制备无细胞提取物生产抗真菌肽粉奠定基础。
1 材料与方法
1.1 材料与仪器
副干酪乳杆菌ALAC 本实验室保存;指示菌白假丝酵母(Candida albicans) 编号为32819,来自中国工业微生物菌种保藏管理中心;乳清粉 浙江一诺生物科技有限公司;牛肉膏、酵母膏、细菌学蛋白胨、大豆蛋白胨、胰蛋白胨、酵母提取粉 广东环凯维生物科技有限公司;氯化钠、柠檬酸氢二胺、磷酸氢二钾、硫酸锰、琼脂粉、硫酸铵、TWEEN80、硫酸镁、蔗糖、磷酸氢二钾 国药集团化学试剂有限公司;无水乙酸钠、葡萄糖 天津市大茂化学试剂厂;酶水解酪蛋白 北京酷来博科技有限公司;所用试剂均为分析纯。
HZQ-F100 型全温震荡培养箱 苏州培英实验设备有限公司;H3018DR 型高速冷冻离心机 上海知信实验仪器技术有限公司;DHG-9053A 型电热鼓风干燥箱、HZQ-311C 型落地振荡器 上海一恒科学仪器有限公司;JM-A6002 型电子天平 诸暨市超泽衡器设备有限公司;SW-CJ-2FD 型双人单面垂直净化工作台 哈尔滨市东联公司;XH-C 型漩涡混匀器 常州未来仪器制造有限公司;IKARV10digital型旋转蒸发仪 广州仪科实验室技术有限公司;SHB-Ⅲ型循环水式多用真空泵 郑州长城科工贸有限公司;P0-1000 型单道移液器 梅特勒-托利多仪器有限公司;LDZX-75KBS 型立式压力蒸汽灭菌锅上海申安医疗器械厂;SYNERGY H1 型酶标仪雷康恒泰商贸有限公司;MCCWS 乳成分分析仪Milkotronic 有限公司。
1.2 实验方法
1.2.1 培养基的配制 MRS 培养基:葡萄糖20 g/L、Tween 80 1 mL/L、酵母提取粉5 g/L、柠檬酸氢二铵2 g/L、硫酸锰0.25 g/L、柠檬酸氢二铵2 g/L、硫酸镁0.58 g/L、无水乙酸钠5 g/L、磷酸氢二氨2 g/L、柠檬酸氢二铵2 g/L、牛肉浸膏10 g /L、细菌学蛋白胨10 g/L,调节pH 至6.5,121 °C 灭菌20 min。
YEPD 液体培养基:葡萄糖20 g/L、大豆蛋白胨20 g/L、酵母提取粉10 g/L,调节pH 至6.0,121 ℃灭菌20 min。
YEPD 固体培养基:葡萄糖20 g/L、大豆蛋白胨20 g/L、酵母提取粉10 g/L,琼脂粉15 g/L,调节pH 至6.0,121 ℃灭菌20 min。
水琼脂固体培养基:琼脂粉15 g/L,121 °C 灭菌20 min。
乳清培养基:乳清液100 g/L、酶水解酪素5 g/L、葡萄糖1 g/L、酵母提取粉2 g/L。
1.2.2 乳杆菌ALAC 的活化 将斜面保存的乳杆菌ALAC 按4%接种量接种于MRS 液体培养基中,180 r/min,37 ℃条件下培养24 h,活化至三代后备用。
1.2.3 指示菌(白假丝酵母)的活化 将斜面保存的白假丝酵母菌按4%接种量接种于YEPD 液体培养基中,180 r/min,30 ℃条件下48 h,活化至三代后备用。
1.2.4 指示菌菌悬液制备 将活化三代的白假丝酵母稀释,将0.1 mL 菌液吸入0.9 mL 生理盐水的无菌EP 管中,混合均匀,重复操作,稀释至10-6倍备用。
1.2.5 乳清培养基中乳清液的制备 将100 g 乳清粉加入1 L、90 ℃蒸馏水中(先加热水,再加乳清粉以防糊状)。用0.1 mol/L 盐酸溶液把以上溶液pH调成4.5,90 ℃恒温水浴30 min,使酪蛋白凝结沉淀成块。用脱脂棉、纱布过滤,然后用1 mol/L 氢氧化钠溶液将滤后乳清液的pH 调成6.5,煮沸后进行抽滤,115 ℃灭菌20 min 后4 ℃冷藏备用。
1.2.6 乳杆菌抗真菌肽发酵液的处理 将活化至三代的乳酸菌ALAC 按4%接种量分别接种到乳清培养基中,在180 r/min 条件下培养24 h,发酵液离心分离去除菌体及沉淀(8000 r/min,20 min,4 ℃),取上清液在50 ℃、0.075 MPa 条件下浓缩至10%。
1.2.7 单因素实验
1.2.7.1 菌株接种量对乳酸菌产抑菌活性物质的影响 将乳杆菌ALAC 分别按1%、2%、3%、4%、5%的接种量接入乳清培养基,37 ℃下培养24 h,发酵液离心分离浓缩后进行抑菌试验。
1.2.7.2 发酵时间对乳酸菌产抑菌活性物质的影响
将乳杆菌ALAC 按4%的接种量接入培养基,37 ℃下分别培养18、24、30、32、36、42 h,同上处理后进行抑菌试验。
1.2.7.3 发酵温度对乳酸菌产抑菌活性物质的影响
将乳杆菌ALAC 按4%接种量接入乳清培养基,分别在27、32、37、42、47 ℃下培养24 h,发酵液同上处理后进行抑菌试验。
1.2.7.4 培养基初始pH 对乳酸菌产抑菌活性物质的影响 将乳杆菌ALAC 按4%接种量接入乳清培养基,分别调节pH 到6.0、6.5、7.0、7.5、8.0,37 ℃下培养24 h,发酵液同上处理后进行抑菌试验。
1.2.8 响应面试验 由单因素实验得出最佳发酵条件后,结合试验结果,选取对抑菌圈影响较大的3 个因素,培养基初始pH、培养时间、培养温度,利用响应面分析法进行优化设计。以各因最优取值为中心,上下区域各取1 个水平值作为响应面试验设计水平见表1。通过发酵浓缩液的抑菌圈大小作为评价指标,设计三因素三水平17 个试验点的响应面试验,其中零点实验重复5 次,采用Design-Expert 8.0.6 统计软件对实验结果进行响应面回归分析。
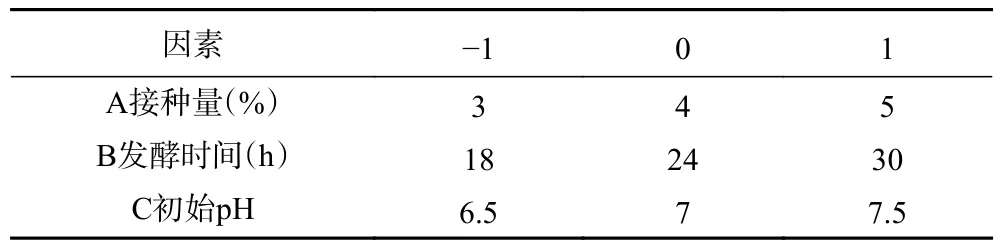
表1 Box-Behnken 试验因素与水平设计Table 1 Factors and levels of Box-Behnken
1.2.9 牛津杯法检测抑菌性 配制水琼脂及YEPD培养基,灭菌备用。将水琼脂加热融化,取15 mL 倒入培养皿中,凝固后在固体琼脂上放置三只牛津杯(呈正三角形形状)。将稀释后的白假丝酵母按4%比例接入35 ℃左右25 ml YEPD 培养基中,将其倒入已凝固的琼脂培养基待凝固。凝固后培养皿呈明显两层状态,遂取出牛津杯,在孔洞中加入200 μL 发酵浓缩液,37 ℃培养24 h 观察结果。每组试验进行三次,计算平均值。可以通过比较抑菌圈大小(包含牛津杯的直径7 mm)来反应其抑菌性强弱。
1.2.10 抗菌肽粗提粉的品质分析 抗菌肽发酵液粗提粉制备,将浓缩至10%的发酵粗提液进行冷冻干燥,36 h 后取出研磨成均匀粉末4 ℃保存备用。
理化指标测定:将抗菌肽粗提粉添加10 倍的蒸馏水溶解均匀,通过乳成分分析仪进行蛋白质、乳糖、脂肪理化指标测定。水分含量测定根据GB 5009.3-2016 中的直接干燥法测定。抗菌肽粗提粉微生物指标检测,菌落总数测定方法参考GB 4789.2-2016。大肠菌群数测定方法参考GB 4789.3-2016。致病菌(志贺氏菌、沙门氏菌、金黄色葡萄球菌)测定方法参考GB 4789.10-2016。
1.3 数据处理
所有实验进行3 次重复,采用SPSS 19.0 软件统计处理数据,采用Design-Expert 8.0.6 统计软件进行响应面分析,采用Originpro 2019,excle 2016 软件作图。
2 结果与分析
2.1 乳杆菌ALAC 发酵条件单因素实验
2.1.1 接种量对菌株产抗菌肽的影响 通过前期研究结果发现试验菌株对大多数霉菌和酵母具有抑菌性,尤其对白假丝酵母具有极强抑菌性,且白假丝酵母为食品中常见的致病致腐酵母,故将其作为指示菌来测定乳杆菌产抑菌活性物质的抑菌效果。通过研究不同接种量对乳杆菌产抑菌活性物质的影响(图1),发现接种量对菌株抑菌效果有显著影响(P<0.05),随着接种量的增加,抑菌圈直径迅速增大,在接种量为4%条件下发酵液的抑菌圈直径达到峰值16.47 mm,再继续增大接种量抑菌圈直径减小。据研究表明,细菌素合成在对数期,一定程度加大接种量会加速菌种生长,快速到达对数期,从而加速合成细菌素,使抑菌活性增强[19]。从图1 中可以看出当接种量高于4%时抑菌圈直径有明显的下降趋势,可能是由于乳酸菌发酵过程中,一定的空间内微生物数量增加会引起生存空间和营养物质的争夺,因而造成菌株生长情况下降,抗菌物质合成受阻,抑菌圈直径变小。也可能是接种量过大,缩短合成时间,产量有很大程度的下降,抗菌肽的活性也会降低,这可能也与细菌素吸附到产生菌菌体表面有关[20]。
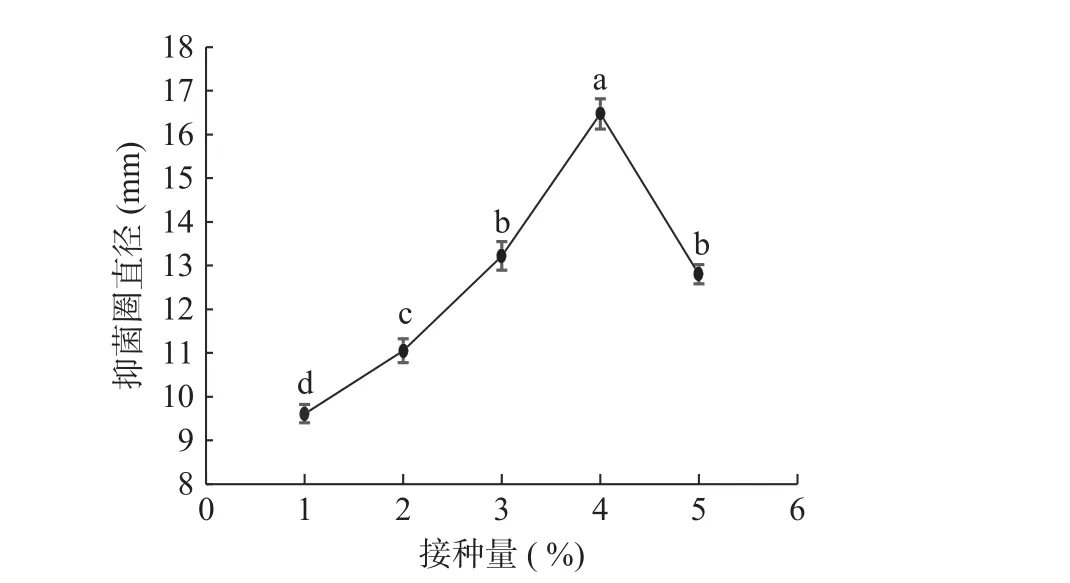
图1 接种量对抑菌效果的影响Fig.1 Effect of inoculum on antibacterial efficacy
2.1.2 发酵时间对菌株产抗菌肽的影响 由图2 所示,发酵时间对抑菌效果有显著影响(P<0.05),抑菌圈直径随发酵时间的延长先迅速增高,在24 h 达到峰值16.78 mm,后随着发酵时间增长发酵液抑菌活性呈逐渐下降趋势。通常来说,抗菌肽在对数生长前期开始合成,在指数生长末期或稳定前期达到最大量[21]。副干酪乳杆菌ALAC 的对数生长期为18~30 h[22],生长24 h 时乳杆菌正处于对数生长期中期,产生的抑菌物质活性最强,菌株抑菌活性与生长曲线变化基本一致,这与王瑶等[23]研究发现相符,即植物乳杆菌LPL-1 菌株的细菌素产量与生长曲线有一致性。随着发酵时间延长但抑菌活性逐渐降低,这可能是菌体进入衰亡期,合成抗菌肽能力减弱导致抗菌活性下降。
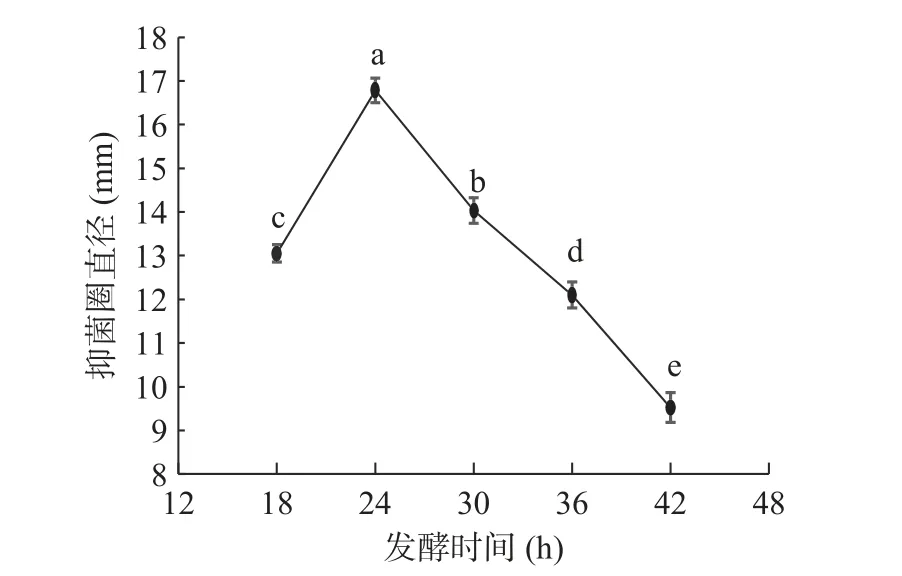
图2 发酵时间对抑菌效果的影响Fig.2 Effect of fermentation time on antibacterial efficacy
2.1.3 发酵温度对菌株产抗菌肽的影响 研究不同的发酵温度对菌株合成抗菌肽的影响,结果发现(图3)随着发酵温度的增长,抑菌圈直径呈现先增大后减小的趋势,在37 ℃达到峰值16.93 mm,超过37 ℃后抑菌圈直径大幅降低。Ogunbanwo 等[24]研究发现30 ℃时最有利于植物乳杆菌产细菌素,这与本研究结果不同,说明不同菌株产抗菌肽的最适发酵温度不同,这与抗菌肽的合成机制有关[25],也有可能该菌株抗菌物质代谢途径受到阻碍导致抑菌活性下降。
图3 发酵温度对抑菌效果的影响Fig.3 Effect of fermentation temperature on antibacterial efficacy
2.1.4 初始pH 对菌株产抗菌肽的影响 培养基初始pH 在5.5~7.0 范围内时(图4),抑菌圈直径不断增加,在pH 为7 时抑菌圈直径达到峰值17.1 mm,随后抑菌圈直径下降。研究表明乳酸菌的最适生长pH 与细菌素合成的最适pH 可能不相同[26]。乳杆菌最适生长pH 在5.5~6.0 左右,但在酸性条件下抗菌肽的转录翻译过程受阻,导致抑菌活性低;也可能是菌体细胞在不同pH 条件下对抗菌肽的吸附能力不同[27],不利于代谢生成抑菌物质。在培养基初始pH为7.0 时尽管菌体生长未处于最佳状态,但此时生成的抑菌物质活性最强。

图4 初始pH 对抑菌效果的影响Fig.4 Effect of initial pH on antibacterial efficacy
2.2 响应面试验优化发酵工艺
2.2.1 响应面试验设计及结果 在单因素实验的基础上,选取A 接种量、B 发酵时间、C 初始pH 3 个因素,采用三因素三水平的响应面分析试验对乳杆菌ALAC 培养基发酵条件优化。利用Design-Expert8.0.6 软件进行试验设计、数据处理及模型的建立。试验结果与分析见表2。
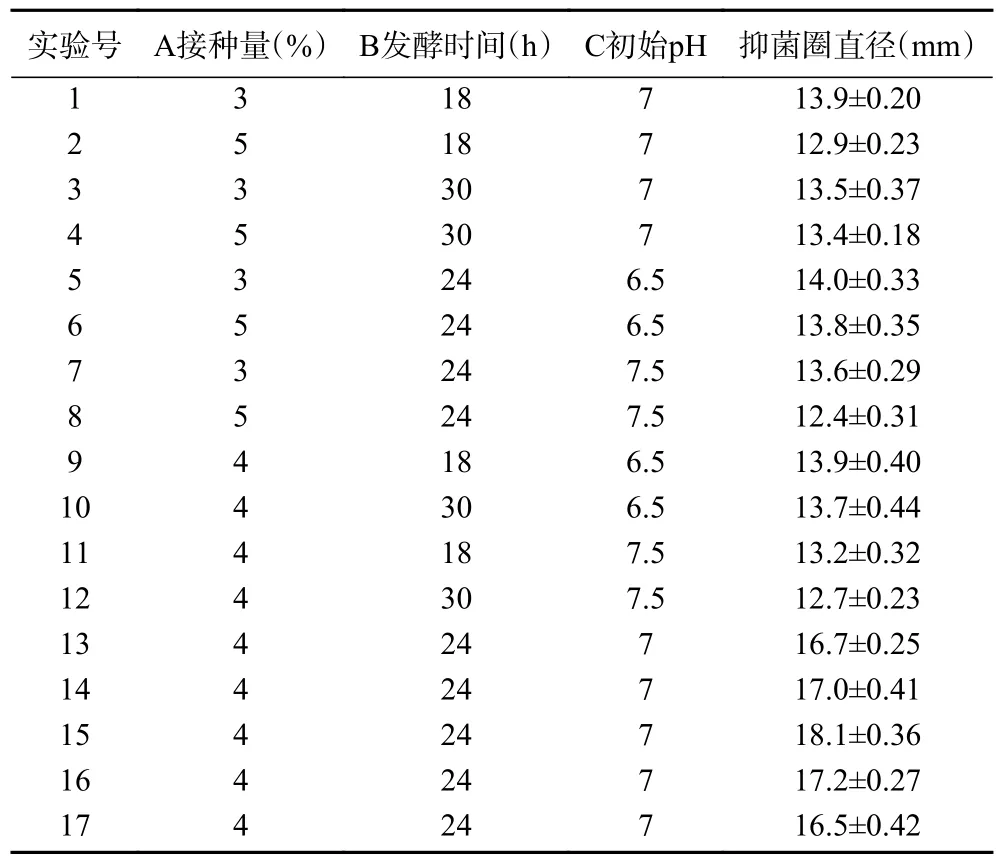
表2 Box-Behnken 试验设计及结果Table 2 Experimental design and results of Box-Behnken
将得到的实验结果用Design-Expert10.0.7 软件对所得试验数据进行二次多项式回归拟合,得到抑菌圈直径与各因素变量的二次回归方程如下:Y=17.10-0.31A-0.075B-0.44C+0.22AB-0.25AC+0.075BC-1.80A2-1.88B2-1.85C2,此方程试验方差分析见表3。
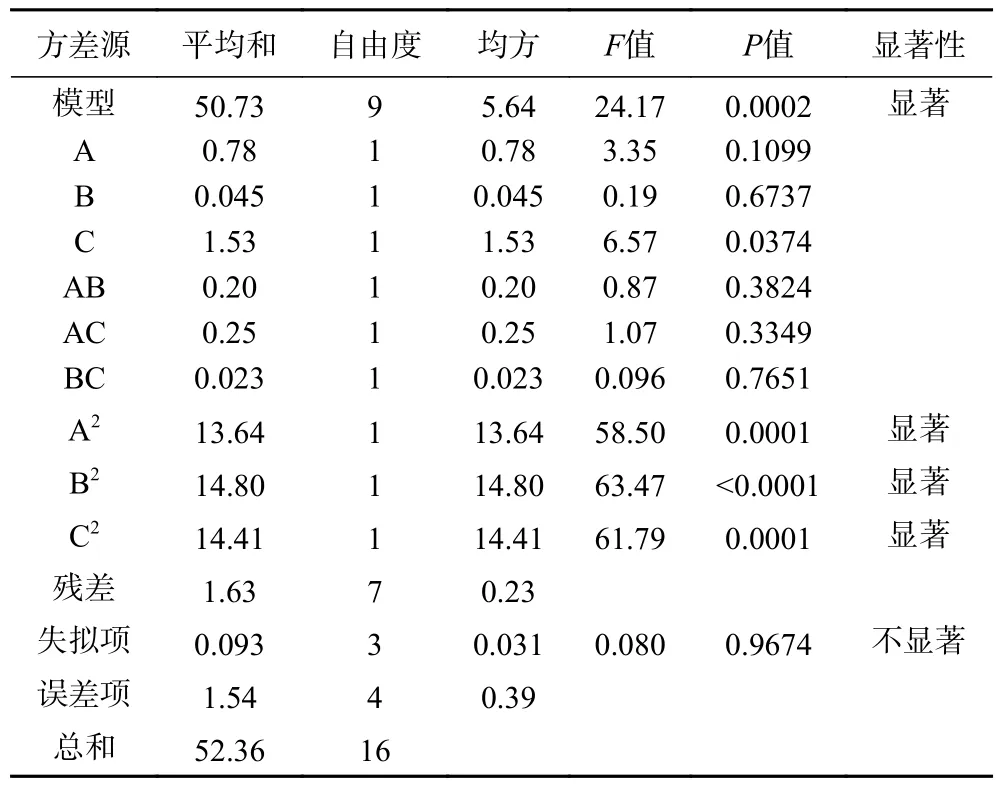
表3 Box-Behnken 回归模型方差分析Table 3 ANOVA for Box-Behnken regression model
由表3 可知,模型决定系数R2为0.9688,说明抑菌圈直径的实际值与预测值拟合较好,96.88%的抑菌圈直径大小变化可用此回归方程模型来解释,可以较好的反映出抑菌圈直径与接种量、发酵时间和初始pH 之间的关系。调整决定系数R2Adj为0.9287,说明92.87%实验数据的变异性可用该方程解释且抑菌圈大小由92.87%受实验因素影响。该模型的P值<0.01,具有显著性,失拟项P值0.9674>0.05,表明失拟项不显著,模型拟合度好,能较好的反映响应面的变化,描述本实验结果。综上所述,以抑菌圈直径为响应值建立的乳酸菌最佳发酵工艺模型,可对不同发酵条件下乳酸菌抑菌能力进行分析和预测。对回归模型进行显著性检验可知,A2、B2、C2抑菌圈直径大小的影响极显著(P<0.01),C 对抑菌圈直径大小的影响显著(P<0.05)。根据表中F值可知,各因素对抑菌圈大小影响程度为C>A>B,即:初始pH>接种量>发酵时间。
2.2.2 响应面交互效应分析 图5 是接种量和发酵时间影响抑菌活性的响应面图。从图中可以看出当初始pH 不变,发酵时间处于最值时,随着接种量的增加,抑菌圈直径呈先增加后下降趋势;接种量处于最值时,随着发酵时间增加,抑菌圈大小呈现出相同趋势。发酵时间与接种量的曲面较陡,对抑菌活性影响显著。
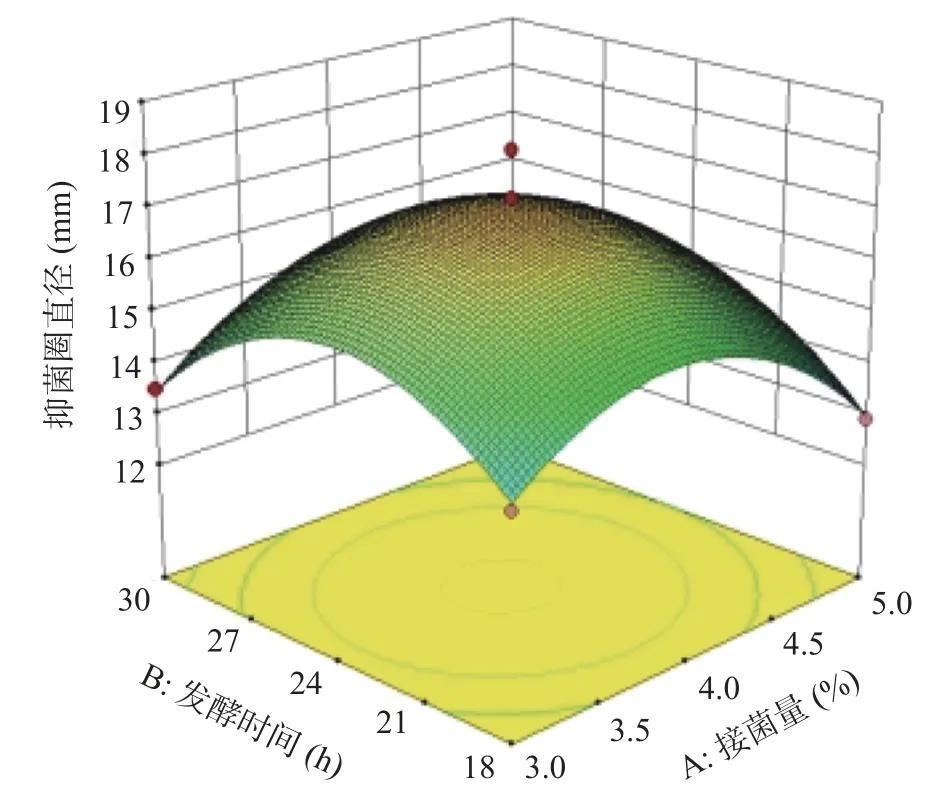
图5 接种量和发酵时间对抑菌活性影响的响应面图Fig.5 Response surface diagram of the effect of inoculation amount and fermentation time on antibacterial activity
从图6 可以看出,当发酵时间不变,接种量处于最值时,随着初始pH 的增加,抑菌圈直径呈先增加后下降趋势;初始pH 处于最值,随着接种量的增加,抑菌圈大小呈相同趋势。接种量与初始pH 的曲面较陡,对抑菌活性影响显著。
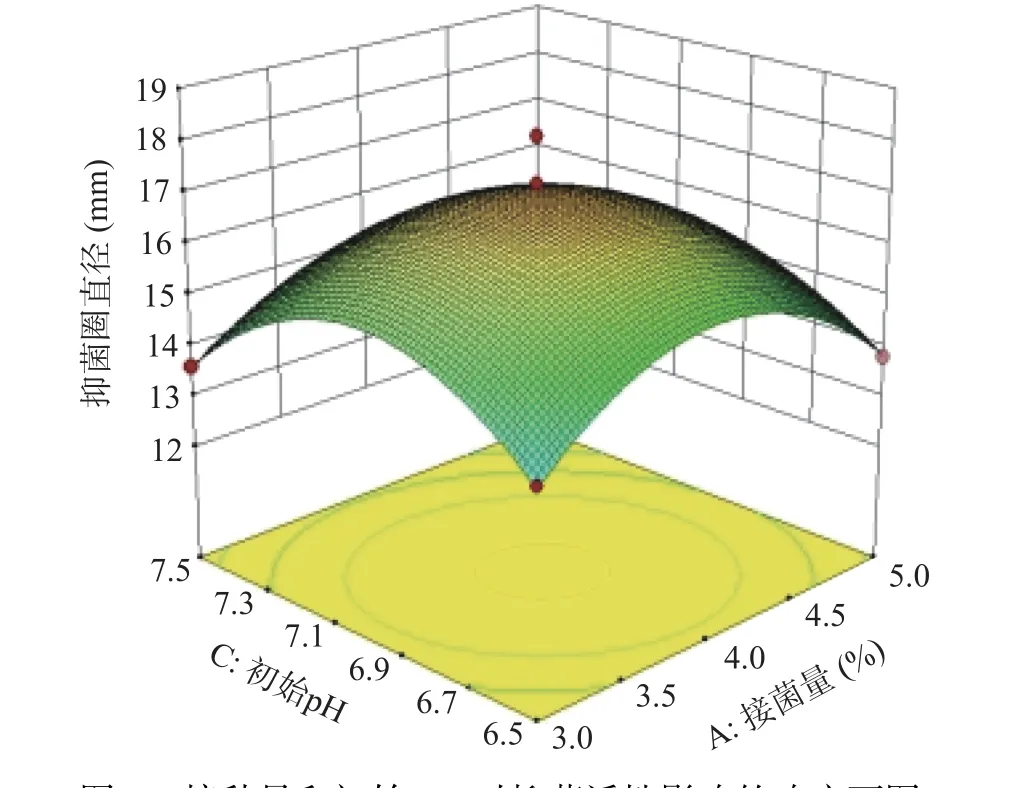
图6 接种量和初始pH 对抑菌活性影响的响应面图Fig.6 Response surface diagram of the effect of inoculation amount and initial pH on antibacterial activity
图7 是发酵时间和初始pH 影响抑菌活性的响应面图。当接种量固定,发酵时间处于最值时,随着初始pH 的增加,抑菌圈直径呈先增加后下降趋势;初始pH 处于最值时,随着发酵时间增加,抑菌圈大小呈相同趋势。代表初始pH 的响应曲面坡度较陡,说明初始pH 的变化对抑菌活性的影响比发酵时间对其影响大。
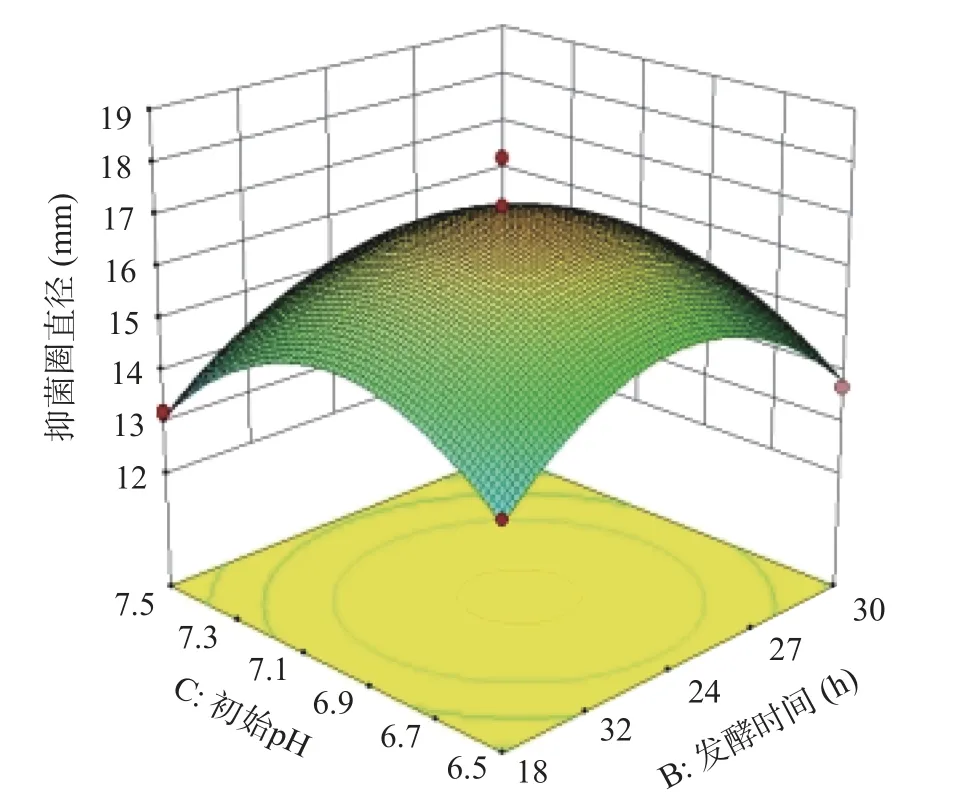
图7 发酵时间和初始pH 对抑菌活性影响的响应面图Fig.7 Response surface diagram of the effect of fermentation time and initial pH on antibacterial activity
2.2.3 工艺条件验证实验 根据抑菌圈直径大小模型的二次回归方程,利用 Design-Expert 8.0.6 软件对乳酸菌发酵条件工艺参数进行优化,得到最优参数为接种量3.907%、发酵时间23.706 h、初始pH 为6.946,在此条件下抑菌圈直径为17.143 mm。为验证响应面优化的可行性,在此最佳条件下进行乳酸菌最优发酵条件的验证试验,同时考虑实际操作可行性,调整参数为接种量4%、发酵时间24 h、初始pH 为7.0,进行3 次平行试验,得到抑菌圈直径平均值为17.33±0.17 mm,与理论值较为接近。说明采用响应面法对乳酸菌发酵工艺参数优化得出的结果可靠,具有实用价值。
2.3 抗菌肽粗提粉的品质分析
采用本实验优化的最佳发酵工艺制得发酵粗提液,经过浓缩蒸发,冷冻干燥制得抗菌肽粗提粉。抗菌肽粗提粉有较好的组织状态,滋味气味正常,色泽均一。组织状态整体均匀、松散,粉质干燥且无结块,具有良好的流动性;滋气味有较浓的乳香味及乳酸菌发酵后特有的淡香味;色泽呈均匀一致的乳黄色、有光泽。
抗菌肽粗提粉的理化指标如表4 所示,由表4可知,抗菌粗提粉的脂肪含量为0.53 g/100 g,蛋白质含量为34 g/100 g,含水量为3.4%(w/w),乳糖含量77 g/100 g,溶水后溶液pH 为4.5。

表4 抗菌肽粗提粉理化指标Table 4 Physical and chemical indexes of crude powder of antimicrobial peptides
抗菌肽粗提粉的根据微生物检测结果见表5,抗菌肽粗提粉中菌落总数<3000 cfu/g,大肠菌群数<90 MPN/100 g。沙门氏菌、志贺氏菌及金黄色葡萄球菌这三种食品中常见致病菌没有被检测出。考虑后期可以安全应用于食品中延长食品保质期。

表5 抗菌肽粗提粉微生物指标Table 5 Test results of microbial indexes of crude powder of antimicrobial peptides
3 结论
安全高效的天然抑菌产品有望代替化学防腐剂用于食品、饲料等行业[28-29]。当下发酵乳酸菌抗菌肽的培养基以MRS、M17 培养基居多,采用农业、工业副产物为培养基主要成分发酵乳酸菌抗菌肽成为研究热点[30]。本研究选用乳清发酵培养基,以自主分离的具有抑真菌特性的副干酪乳杆菌ALAC 生产抗菌肽粉。采用响应面分析对副干酪乳杆菌的发酵条件进行了优化,确定了最佳发酵工艺条件为培养基初始pH 为7.0、接种量4%、发酵时间24 h,此条件下乳杆菌产抗菌肽的抑菌圈达到17.33±0.17 mm。最佳发酵条件制得的抗菌肽粗提粉感官状态良好,理化指标和微生物指标符合要求。研究结果表明副干酪乳杆菌ALAC 发酵生产的抗菌肽具有较强的抑菌特性,为后期进一步优化后处理工艺,从而生产抗菌肽粉奠定了基础。

