耐硒海洋菌株的筛选、鉴定及其产纳米硒的抗菌活性
徐孝楠,马浩迪,2,续 炎,李 璇,覃 智,权春善,2,*,张丽影,2,*
(1.大连民族大学生命科学学院,辽宁大连 116600;2.生物技术与资源利用教育部重点实验室,辽宁大连 116600)
纳米硒是一种具有纳米级尺寸的红色单质硒[1],具有抗氧化、抗菌、抗病毒以及抗癌等作用[2]。纳米硒合成方法主要有化学合成、生物合成以及物理合成。化学合成法是以无机硒如:SeO2、Na2SeO3、H2SeO3等为硒源,利用还原剂将其还原成单质硒[3];物理法常利用机械作用,包括摩擦、挤压、剪切、冲击、超声等处理固体原料制备纳米硒,或通过升华冷凝法改变硒分子间作用力制备纳米硒[4];生物法制备纳米硒,是利用微生物生长发育过程产生的有效物质还原硒盐(Na2SeO3、H2SeO3等),或利用植物提取物中的有效物质将Na2SeO3还原成红色纳米硒。
由于化学合成法在制备过程中会使用到对人体和环境造成危害的有毒化学物质,物理法存在能量消耗大,易污染样品等问题,而生物合成法是在绿色环保理念下发展起来的一种简单、安全、更为环保的合成方法[5],因此备受人们关注,利用生物法合成纳米硒已成为国内外制备纳米硒的新趋势[6]。此外,生物合成的纳米硒生物相容性好,细胞活性高,尺寸小,粒径均匀,稳定性强[7],在食品包装[8]、功能性保健品[9]、抗肿瘤[10]、抗癌[11-12]、药物开发[13]等领域有着广泛的应用。
迄今为止,研究发现多种细菌、真菌等能够将硒酸盐或亚硒酸盐还原为单质硒,如枯草芽孢杆菌亚种Bacillus subtilissubspeciesstercorisXP、枯草芽孢杆菌Bacillus amyloliquefaciensLxz41、链霉菌Streptomycessp.ES2-5 等[14-16],但来自海洋的菌株目前仅有少量报道[17-20]。海洋环境的特殊性和海洋物种复杂的生态功能赋予了海洋微生物不同于陆地微生物的代谢途径和适应机制[21]。海洋已成为具有特殊功能细菌的重要来源[22]。为了寻找具有高耐硒能力和还原能力的新菌株,本研究以41 株来自北冰洋沉积物的菌株为研究对象,通过初筛和复筛,筛选出一株对Na2SeO3具有高耐受力和还原还原能力的菌株,并对其进行了鉴定。此外,对利用该菌株还原制备的纳米硒进行了表征,并进一步考察了其对两种食源性病原菌的抑菌活性。
1 材料与方法
1.1 材料与仪器
41 株来自北冰洋深海沉积物的海洋菌株-80 ℃冻存于本实验;酵母粉 英国OXOID;蛋白胨 北京奥博星生物技术有限公司;NaCl(>99%)、琼脂 上海生工有限公司;无水乙醇(AR)、丙酮(AR)、溴化钾(SP)、蔗糖、盐酸、三羟甲基氨基甲烷盐酸溶液 天津市科密欧试剂有限公司;亚硒酸钠(Na2SeO3) 阿法埃莎(中国)化学有限公司。
AvantiJ-30 高速低温冷冻离心机 美国Beckman 公司;JY92-ⅡN 超声波细胞破碎仪 宁波新芝生物科技股份有限公司;D2F-2060 真空干燥箱 上海精宏实验设备有限公司;FTIR 傅里叶红外光谱仪北京北分瑞利分析仪器公司;XRD-6000 型X-射线衍射仪 日本岛津公司;ZHWY-2102C 恒温摇床上海智城分析仪器公司;HORIBASZ-100 激光粒度分析仪 日本HORIBA 公司;ZWYD-2403 恒温培养振荡器 上海智城分析仪器制造有限公司;ZXRD-A7080 全自动新型鼓风干燥箱 上海精宏实验设备有限公司;BXM-30R 高温灭菌锅 上海博讯实业有限公司;920-Ⅱ洁净工作台 上海智城分析仪器公司;Milli-Qacademic 超纯水制备系统 美国Millipore 公司;JA50003N 型电子天平 上海静科仪器公司。
1.2 实验方法
1.2.1 菌株的筛选 将冻存于-80 ℃的41 株海洋菌株进行活化,随后用接种环挑取菌液于LB 固体培养基(10 g/L NaCl、10 g/L 蛋白胨、5 g/L 酵母粉、1 L过膜海水、15 g/L 琼脂粉)上划线,33 ℃倒置培养48 h 得到单菌落。随后从LB 固体培养基平板上挑取单菌落,转移到装有10 mL LB 液体培养基的试管中,置于恒温摇床上180 r/min 培养24 h。按照3%(v/v)的接种量将各菌液分别加入到含有150 mmol/L亚硒酸钠的LB 液体培养基中,33 ℃,180 r/min 条件下振荡培养24 h,观察体系颜色变化,筛选出能够还原Na2SeO3产纳米硒的菌株。随后,再次将能够还原Na2SeO3的菌株按照3%(v/v)的接种量加入到含有150 mmol/L Na2SeO3的LB 液体培养基中,33 ℃,180 r/min 条件下振荡培养48 h,测其OD 值,每个菌株平行测定三次。根据OD 值判断菌株在Na2SeO3存在条件下的生长情况,挑选出耐硒能力强的菌株。将初筛出的各菌株菌液,按照3%(v/v)的接种量加入到含有10、20、40、60、80、100、200、300、400和500 mmol/L Na2SeO3的LB 液体培养基中,33 ℃,180 r/min 条件下振荡培养24 h,根据各菌株对不同溶度Na2SeO3的还原情况,复筛出还原能力最强的菌株。
1.2.2 菌株对亚硒酸钠还原能力的测定 将复筛得到的菌株进行活化,按照3%(v/v)的接种量加入到LB 液体培养基中,再加入Na2SeO3溶液使体系中Na2SeO3的终浓度为5 mmol/L。将接好菌的LB 培养基置于恒温摇床中33 ℃,180 r/min 振荡培养,每隔2 h 取1 mL 上层清液于试管中,加入1 mL 浓度为1 mol/L 的抗坏血酸溶液,再加入1 mL 浓度为4 mol/L 的HCl 溶液,在室温条件下静置10 min,在500 nm 条件下,利用紫外分光光度计测量吸光度,将其带入标准曲线,得到体系中剩余Na2SeO3的量。
1.2.3 菌株鉴定 将冻存于-80 ℃的72 号菌株进行活化,随后用接种环挑取菌液于固体培养基划线,最后倒置于33 ℃恒温培养箱中培养24~48 h,观察并记录菌落形态特征。选择长势较好的单菌落,置于内含10 μL 无菌水的离心管中,100 ℃煮沸10 min,12000 r/min 离心2 min,得到细菌DNA。以提取的DNA 为模板,采用细菌通用引物[23]正向引物8F(5’-AGAGTTTGATCCTGGCTCAG-3’)、反向引物1492R(5’-TACGGCTACCTTGTTAGGACT-3’),对菌株进行16S rDNA 扩增。PCR 扩增反应体系总体积为50 μL,包括:10 μmol/L 8F,10 μmol/L 1492R,10 ng/μL Template DNA,200 μmol/L dNTP Mixture,5 U/μL rTaq,4.0 μL 1×10 Loading Buffer,39.75 μL dd H2O。
PCR 反应条件为:95 ℃预变性5 min,94 ℃变性30 s,退火50 ℃ 30 s,72 ℃延伸1 min,循环以上条件32 次;72 ℃延伸10 min,于4 ℃保存。扩增产物经1%琼脂糖凝胶电泳检测后,送至生工生物工程(上海)有限公司进行测序。
1.2.4 纳米硒的制备与分离 将72 号菌株以3%(v/v)的接种量加入到装有LB 液体培养基的1000 mL锥形瓶中,33 ℃,180 r/min 培养24 h,10000 r/min离心10 min,然后倒出上清液,以同样的条件对上清液再次离心。合并两次离心的沉淀转移至离心管,用生理盐水清洗3 次,每次洗完均以12000 r/min 离心10 min 去上清,沉淀用3 mL 无菌水重悬,在冰浴条件下超声破壁30 min。破壁完成后用Tris-HCl 和SDS(pH=8.3)溶液洗涤两次,12000 r/min 条件离心10 min,再用无菌水洗涤一次,然后用无菌水重悬,按V(重悬液):V(正辛醇)为2:1 的比例加入正辛醇,混匀后12000 r/min 离心10 min,沉淀即为纳米硒颗粒,分别用氯仿、乙醇和无菌水各洗涤一次,12000 r/min 离心10 min,沉淀用冷冻干燥仪干燥。
1.2.5 纳米硒的表征 采用傅里叶红外光谱仪测定样品的结构,将SeNPs 粉末与溴化钾混合压片,室温下在400~4000 cm-1范围内测量其吸收光谱,扫描速度为5 kHz。采用X-射线衍射仪对制得的样品结晶状态进行分析,将SeNPs 粉末置于载玻片的样品槽中,进行表面压片,随后将其置于X 射线衍射仪中进行测试,扫描角度为10~80°,扫描速度为5°/min。采用扫描电子显微镜观察SeNPs 的形态及组成,用乙醇分散制样。利用SZ-100 纳米粒度仪测定SeNPs的粒径大小、分布以及Zeta 电位。
1.2.6 纳米硒的抑菌活性 称取菌株还原得到的纳米硒0.2 g 溶解于100 mL 超纯无菌水,得到2 mg/mL的纳米硒母液,超声振荡混匀,过膜除菌。随后将纳米硒母液分别稀释至20、50、100、150、200 µg/mL的浓度梯度。将OD600=0.5 的大肠杆菌和李斯特菌各100 µL 分别加入96 孔板中,再将不同浓度的纳米硒溶液接至各孔,37 ℃恒温培养4 h(三组平行实验及一组空白对照实验)。将实验组和空白组中的细菌悬浊液用无菌水稀释至原液的10-1、10-2、10-3和10-4,随后分别取2.5 μL 稀释后的菌悬液滴至LB 固体培养基平板,37 ℃过夜培养,观察并计数菌落形成单位(Colony Forming Unit,CFU)。根据空白组和不同浓度实验组的菌落数,依据式(1)计算SeNPs 对两种细菌的抑制率:
1.3 数据处理
采用SPSS 27.0 统计学软件进行数据统计分析,采用单样本T检验进行显著性分析。P<0.01 表示差异极显著。
2 结果与分析
2.1 耐硒海洋菌株的筛选
将实验室保存的41 株分离自北冰洋沉积物的菌株加入到含有150 mmol/L Na2SeO3的LB 液体培养基中进行培养,24 h 后发现有30 株能够还原Na2SeO3产生砖红色的纳米硒。随后检测了这30株菌在150 mmol/L Na2SeO3存在条件下48 h 后的生长情况,结果如表1 所示。27 号和58 号菌株的生长明显受到抑制,培养48 h 后其OD 值明显小于其它菌株,亦小于这两株菌株正常生长48 h 后的OD 值。6 株菌株的OD 值较高,分别为8 号、37号、45 号、53 号、72 号、76 号,因此选择这6 株菌株进行复筛。
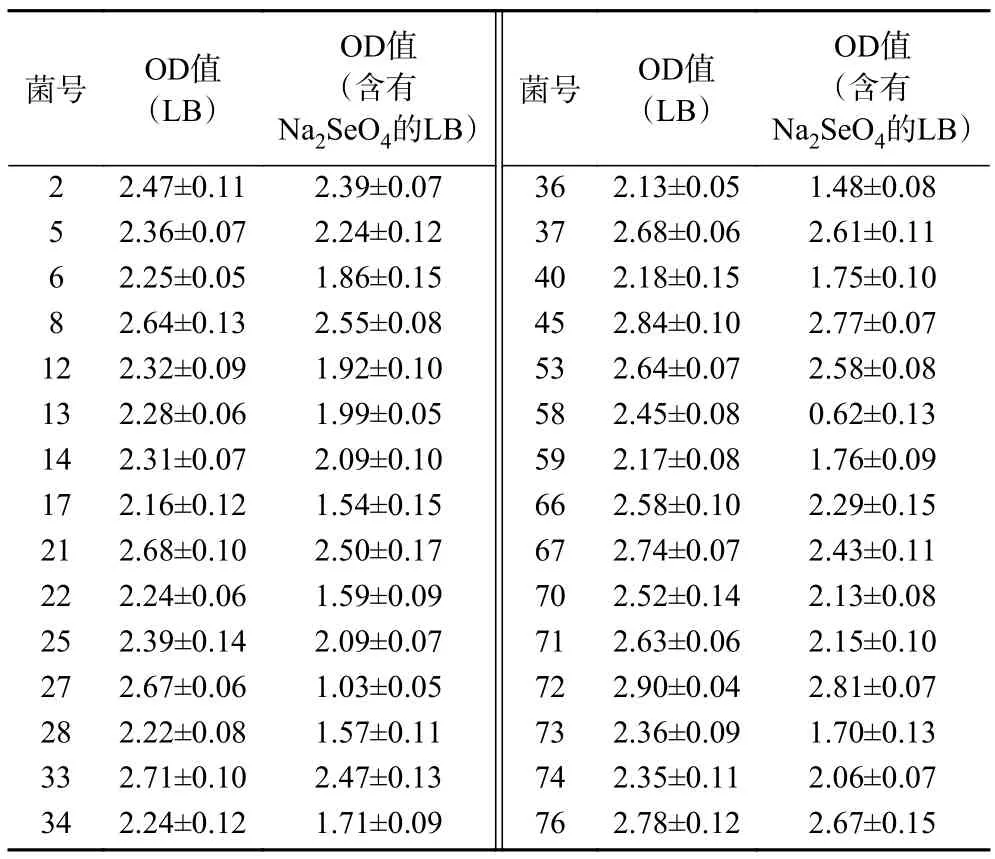
表1 初筛出的30 株菌株在LB 培养基和含有Na2SeO3 LB 培养基中生长48 h 后的OD 值Table 1 OD values of 30 strains initially screened after 48 hours of growth in LB medium and LB medium containing Na2SeO3
图1 为8 号、53 号、72 号、45 号、76 号、37 号菌株分别在含有10、20、40、60、80、100、200、300、400 和500 mmol/LNa2SeO3的LB 液体培养基中的生长情况,由图可见,72 号菌株对Na2SeO3的还原能力最强。当Na2SeO3浓度为300 mmol/L 时,体系颜色依然较红,说明该菌株能够在较高浓度的Na2SeO3存在下生长且将其还原为砖红色纳米硒。因此,本实验选择了72 号菌株作为生物合成纳米硒的菌株。

图1 耐硒海洋菌株的复筛Fig.1 Re screening of Selenium-tolerant strains
2.2 72 号菌株还原 Na2SeO3 的能力
通过监测还原过程中体系Na2SeO3浓度的变化,定量研究了72 号菌株对的Na2SeO3的还原能力,结果如图2 所示。由图2 可知,培养2 h 后,体系已开始显示出红色,表明有纳米硒的生成,4 h 后,体系中Na2SeO3的浓度已低于原始浓度的50%。72号菌对Na2SeO3的还原主要在其对数生长期进行。
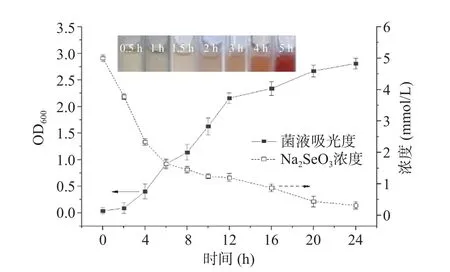
图2 72 号菌株在Na2SeO3 存在下的生长曲线对及其还原Na2SeO3 情况Fig.2 Growth curve of strain 72 in the presence of Na2SeO3 and its reduction of Na2SeO3
2.3 菌株的鉴定
图3 为72 号菌株的聚落形态图和系统发育树。由图3(a)可知菌落呈乳白色、不透明,菌落边缘出现褶皱和收缩并向中间膨胀,采摘细菌时存在粘液分泌物。将72 号菌株的16S rDNA 序列与GenBank数据库中的16S rDNA 序列做相似性比对,随后利用MEGA(5.0)中的邻接法构建系统发育树[24],结果如图3(b)所示。72 号菌株的16SrDNA 序列与芽孢杆菌属(Bacillus)相关菌株的16SrDNA 序列相似性较高,聚集为一簇,由此确定72 号菌株为芽孢杆菌,将其命名为Bacillussp.Q72。
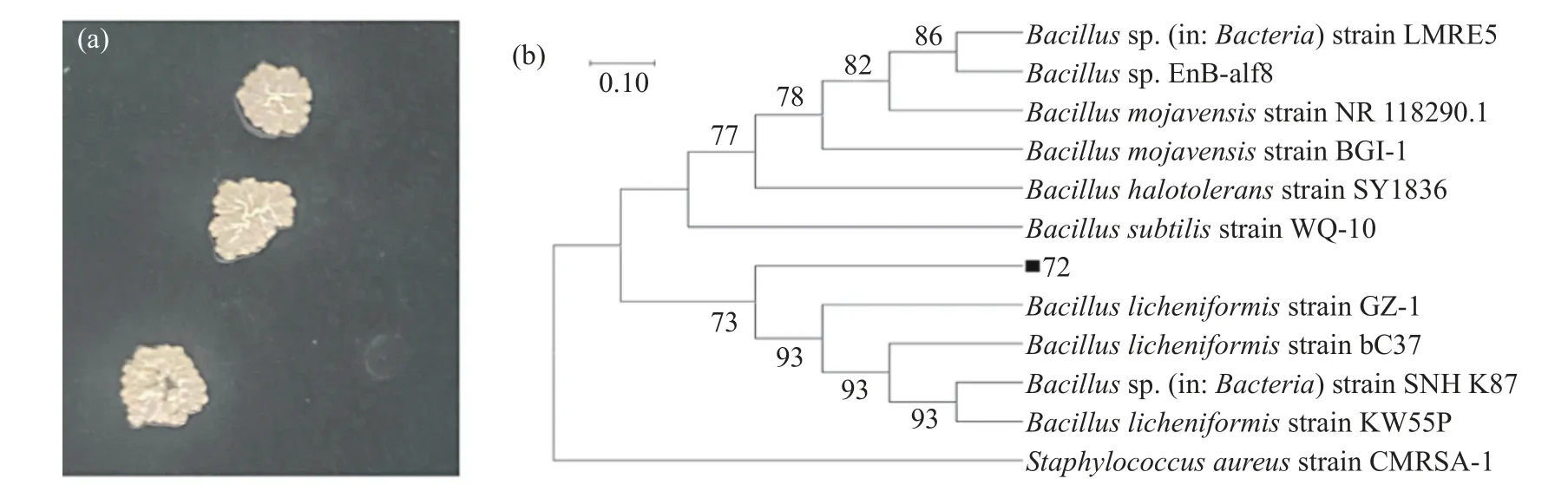
图3 72 号菌株的菌落形态(a)和系统发育树(b)Fig.3 Colony morphology (a) and phylogenetic tree (b) of strain 72
2.4 纳米硒表征
2.4.1 红外光谱分析 利用傅里叶红外光谱检测纳米硒的表面官能团种类,结果如图4 所示。在2940,1654,1538,1429,1077,748 cm-1,位置出现明显的特征吸收峰,其中在2940 cm-1的特征峰是由脂肪族中C-H 伸缩振动产生;1654 cm-1处的峰由酰胺基中的C=O(酰胺Ⅰ带)伸缩振动产生;在1538 cm-1处的吸收峰是由苯环骨架的双键伸缩振动产生;1429 cm-1处的吸收峰是C-H 变形振动造成的;1077 cm-1吸收峰可能是由胺中的C-N 伸缩振动造成的;748 cm-1处具有特征吸收峰,属于取代苯环的弯曲振动吸收[25-27]。傅里叶红外光谱结果表明,由72 号菌株还原Na2SeO3所得到的纳米硒表面存在着氨基和羟基等基团,说明在纳米硒合成过程中,含有这些官能团的生物分子,如脂类、蛋白质、碳水化合物等发挥着重要作用。
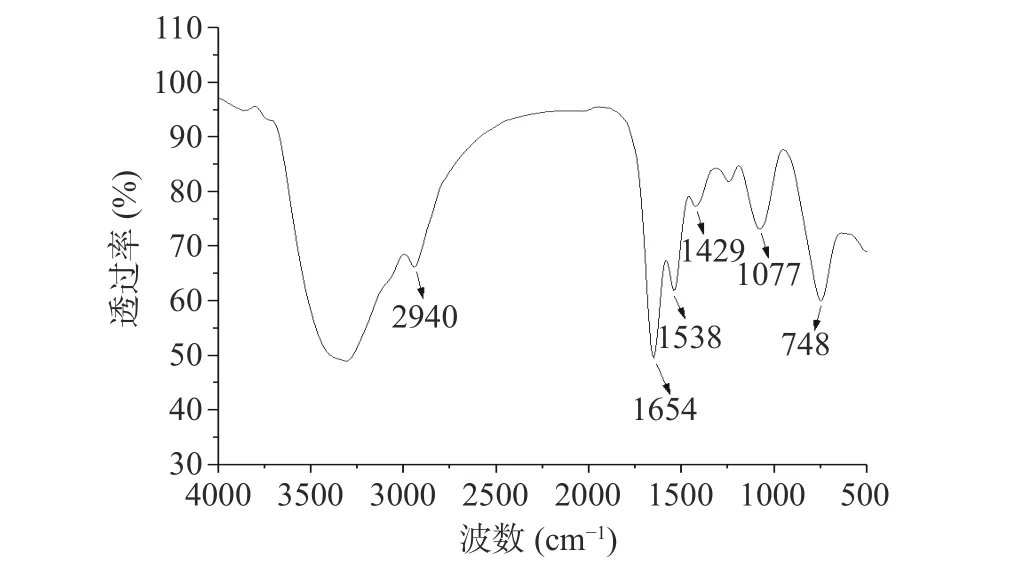
图4 Bacillus sp.Q72 生物合成纳米硒的红外光谱图Fig.4 Infrared spectrogram of SeNPs biosynthetized by Bacillus sp.Q72
2.4.2 扫描电镜分析 图5 为Bacillussp.Q72 及其产纳米硒的扫描电镜结果。由图5 可见,72 号菌株呈短棒状,长度约为1.0 μm 左右(图5a),其产生的纳米硒为规则的球形颗粒(图5b)。图5c 能谱分析结果显示,图5b 黄色圆圈处的元素组成中包含35.13%的Se 元素,证明菌体附近白色球状颗粒为纳米硒颗粒。

图5 Bacillus sp.Q72 及其生物合成纳米硒的形态与组成Fig.5 Morphology and composition of Bacillus sp.Q72 and SeNPs biosynthesized by it
2.4.3 XRD 分析 纳米硒的XRD 光谱如图6 所示,由图6 可知由Bacillussp.Q72 还原的纳米硒在20~30°之间具有较强的射峰,2θ值处显示出23.4°(100)和29.6°(101)处的尖峰,显示纳米颗粒结构中存在结晶硒[28]。此外,与纳米硒的六方形标准卡(JCPDS No.06-0362)对比可知,在41.2°、43.6°、45.4°、51.7°、55.9°、61.5°和65.4°处都有明显的衍射峰,这与六方晶形结构的(110)、(102)、(111)、(201)和(202)晶面一一对应[29]。由XRD 图可以看出与(101)面对应的29.6°处的衍射峰强度最大,72 号菌株合成的纳米硒晶体颗粒是以(101)面为主导。之间;Lampis 等[35]利用Bacillus mycoidesSeITE01 菌株合成的SeNPs 粒径分布在50~400 nm。Bacillussp.Q72 菌株生物合成的纳米硒的平均粒径为169.3 nm,电位为-48.1±0.5 mV,其粒径分布较窄,具有良好的稳定性,可作为生物材料进行进一步的应用。
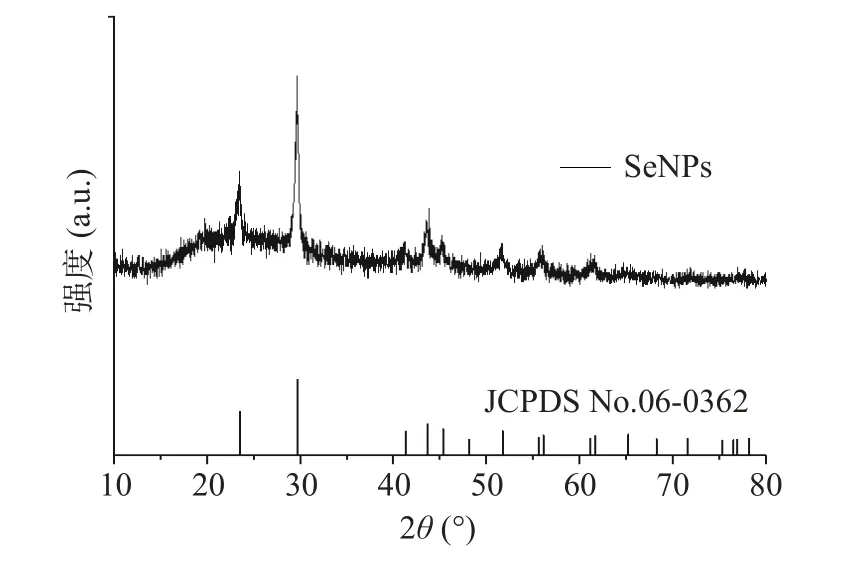
图6 Bacillus sp.Q72 生物合成纳米硒的XRD 图Fig.6 XRD spectrogramof SeNPs biosynthetized by Bacillus sp.Q72
2.4.4 粒度和电位分析 纳米硒的粒径、粒径分布及Zeta 电位如图7 所示。研究表明5~200 nm 的纳米硒具有更加明显的生物效应[30-32],Zeta 电位越小,其生物活性越好[33]。到目前为止,已报道多种芽孢杆菌在有氧或厌氧条件下能够将亚硒酸盐还原成SeNPs,如Ullah 等[26]利用Bacillus subtilisBSN313生物合成的SeNPs 平均粒径为590 nm,电位为-26.9 mV;Bao 等[34]报道Bacillus oryziterraeZYKT菌株生物合成SeNPs 的粒径主要分布在100~500 nm

图7 Bacillus sp.Q72 生物合成纳米硒的粒径、粒径分布和电位Fig.7 Particle size, distribution, and potential of SeNPs biosynthetized by Bacillus sp.Q72
2.5 抑菌活性
图8 为Bacillussp.Q72 生物合成的纳米硒对大肠杆菌和李斯特菌的抑菌活性图。大肠杆菌是一种重要的人畜共患致病菌,属于兼性厌氧型的革兰氏阴性杆菌[36-37],李斯特菌是我国主要的食源性致病菌之一,是一种兼性厌氧型的革兰氏阳性菌[38-39]。图8a~图8b 用20~200 μg/mL 不同浓度的纳米硒处理后,大肠杆菌和李斯特菌的菌落形成情况。从中可见,随着纳米硒浓度的增加,相同稀释倍数下,各菌液中的菌落数明显减小,纳米硒对两种致病菌的生长均表现出明显的抑制。图8c 是纳米硒对大肠杆菌和李斯特菌的抑制率随浓度变化图,与对照组相比(0 μg/mL),Bacillussp.Q72 还原产生的纳米硒对两种致病菌的抑制率随浓度的增加而提高。纳米硒对大肠杆菌表现出更加明显的抑制活性,在20~150 μg/mL 的浓度范围中对大肠杆菌的抑制率表现出极显著差异(P<0.01),在50~100 μg/mL 浓度范围内对李斯特菌的抑制率表现出极显著差异(P<0.01)。纳米硒浓度为200 μg/mL 时,其对大肠杆菌的抑制率可达到92.1%。
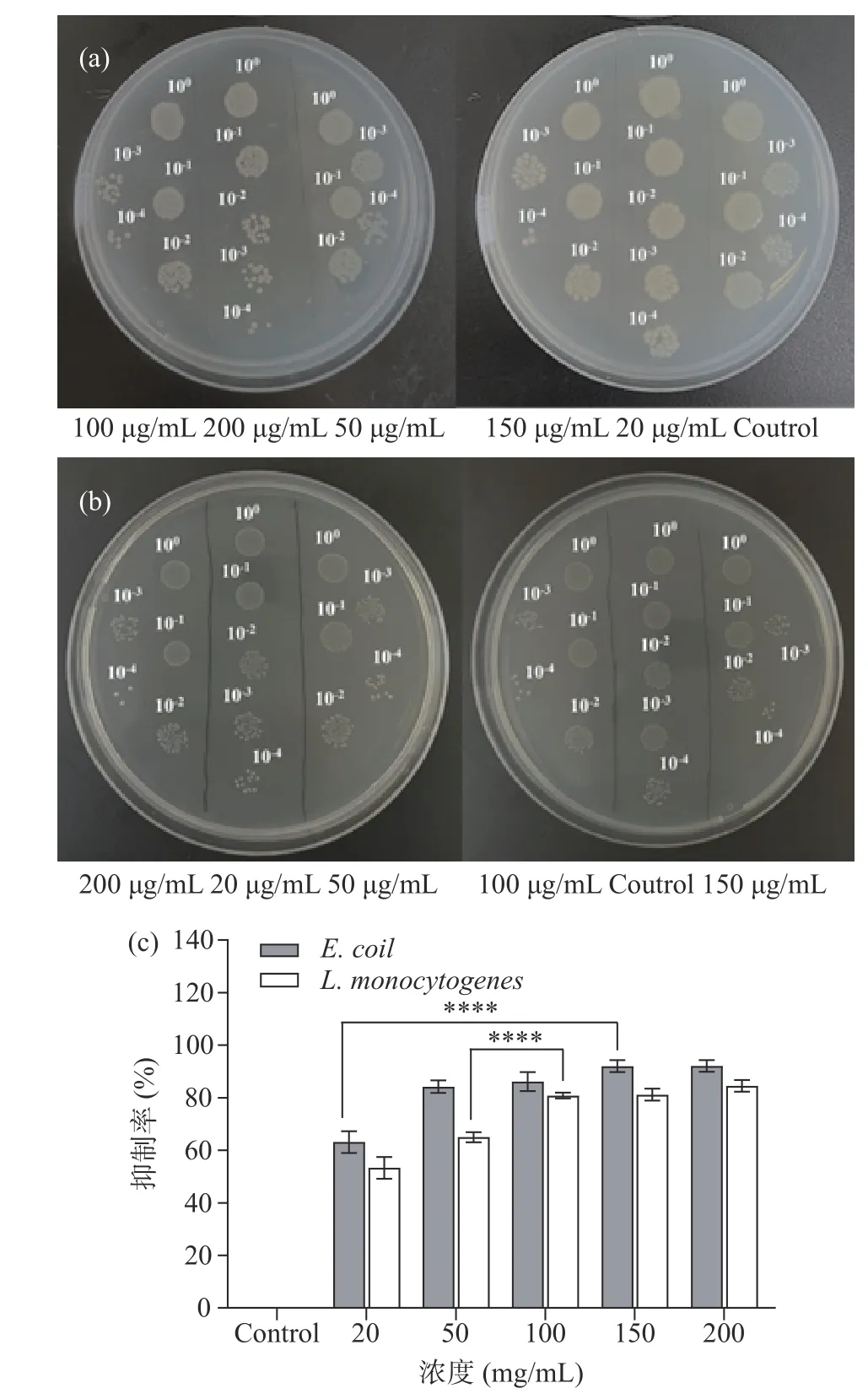
图8 Bacillus sp.Q72 生物合成纳米硒的抑菌活性Fig.8 Antibacterial activity of SeNPs biosynthesisd by Bacillus sp.Q72
3 结论
本研究通过初筛和复筛,从41 株来自北冰洋深海沉积物的海洋菌株中,筛选出了一株对Na2SeO3还原能力较强的菌株。经鉴定,该菌株为芽孢杆菌,将其命名为Bacillussp.Q72,其还原Na2SeO3产生的纳米硒为球形颗粒,平均粒径为169.3 nm,电位为-48.1±0.5Mv,具有较好的稳定性。Bacillussp.Q72菌株合成的纳米硒对大肠杆菌和李斯特菌的生长均有明显抑制作用,对革兰氏阴性菌大肠杆菌的抑制效果更为明显。傅里叶红外光谱测定表明,纳米硒颗粒表面存在着氨基和羟基等基团,说明在纳米硒合成过程中,含有这些官能团的生物分子,如脂类、蛋白质、碳水化合物等发挥着重要作用。有关介导Bacillussp.Q72 合成纳米硒的的生物活性分子及其对亚硒酸盐的合成机制,将在后续实验中进一步深入探究。

