大学化学中竞争平衡知识梳理*
——以沉淀反应为例
唐斯甫,梁爱琴,张 钒,宋祖伟
(青岛农业大学化学与药学院,山东 青岛 266109)
化学是一门独特的基础学科,应用广泛,在农学、环境、地质、医学、生命等专业学习中都有着举足轻重的作用,化学基础知识包括元素、热力学、动力学、平衡和物质结构,体系庞杂,难度较大。化学平衡是教学占比很重的知识点,包括平衡基本知识和水溶液中的平衡[1],涵盖酸碱、沉淀、配位单一体系的平衡,交叉混合体系的竞争平衡,计算和应用广泛,因为多变和涉及到多种物质,难度较大,学生往往抓不住根本,对多重竞争平衡等综合知识无从下手,思维混乱,产生畏惧心理,难以掌握[2]。梳理复杂的竞争平衡知识,以沉淀反应为例,找规律,讲方法,抓本质,以一变应万变,引导学生归纳和总结,将繁杂的知识体系梳理清晰,进行深度学习,树立学习信心,提高终身学习的能力。
水溶液中的平衡主要包含酸碱、沉淀和配位三种平衡,竞争平衡主要存在于:(1)各类平衡体系内部,如酸碱转化,沉淀转化,配合物转化;(2)不同平衡体系之间,如酸碱与沉淀,酸碱与配合物,沉淀与配合物。这两大类、六种竞争平衡关系的学习方法一致,都要从多重平衡入手,写出总反应,求出竞争平衡常数,再结合题目进行解释或计算未知量。水溶液中还有一类重要的平衡——氧化还原反应,这种作用也参与竞争平衡,比如沉淀的溶解可以通过酸碱、配合物、氧化还原三种作用中的一种、两种或者三种。氧化还原参与的竞争平衡侧重点讨论生成沉淀和配合物对电极电势的影响[3-4],也是化学中的难点,另有专题详细讨论[5]。本文以沉淀反应为例介绍竞争平衡知识,包括沉淀转化,沉淀与酸碱,沉淀与配合物三种类型,后两种竞争平衡也是沉淀溶解的相关知识,是很多化学现象的理论解释。
1 沉淀的转化
难溶电解质借助某一试剂的作用转化为另一种难溶电解质的过程为沉淀的转化,沉淀转化在生活生产和大自然中很常见,比如锅炉除垢,钟乳石形成,磷灰石向氟磷灰石转变等。
1.1 沉淀转化反应的竞争平衡常数计算
沉淀转化问题包括转化难易的判断,转化能否实现的相关计算等,要解决这些问题,首先要计算沉淀转化反应的竞争平衡常数。
沉淀转化反应的竞争平衡常数计算有两种方法:一是通过多重平衡规则计算,体现竞争平衡的含义,二是通过书写平衡常数、上下凑因子的数学方法计算[2,6]。比如在含有PbSO4白色固体粉末的溶液中加入Na2S溶液,生成黑色PbS沉淀。要计算PbSO4转化为PbS反应的平衡常数,利用多重平衡规则时首先写出沉淀转化的总反应:
再分析总反应中包含两个沉淀溶解平衡:


二者形成竞争关系,即SO2-和S2-对Pb2+竞争,分别生成PbSO4和PbS沉淀,SO2-和S2-究竟哪种离子竞争能力强,就要看竞争平衡常数的大小。
沉淀转化总反应=(1)+(2),则转化反应的竞争平衡常数为:
两种方法,殊途同归,计算出的结果是一样的。
1.2 定性判断沉淀转化反应的难易程度
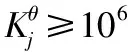
1.3 沉淀转化问题的计算
关于沉淀转化问题的计算,一般分为三个步骤:写出沉淀转化的总反应;计算转化反应的竞争平衡常数,求解未知数,具体过程由例题说明。
【例1】1.0 L浓度为0.1 mol·L-1的碳酸钠水溶液可使多少克CaSO4转化为CaCO3?
解题思路:这是一道沉淀转化的题目,先写出沉淀转化反应:
解:设可使xmol CaSO4转化为CaCO3

c0x0.1 0 0
ceq0 0.1-xxx
x(1+1.47×104)=1.47×103
化简:1+1.47×104≈1.47×104
所以x=0.10 mol·L-1
故可使CaSO4转化的质量为:
136.14 g ·mol-1×1 L×0.1 mol·L-1=13.6 g
【例2】0.20 mol BaSO4固体粉末,用1.0 L饱和碳酸钠溶液(浓度为1.6 mol·L-1)处理,可使多少BaSO4转化为BaCO3?把0.20 mol BaSO4固体粉末全部转化,需要处理几次?
解:设可使xmol BaSO4转化为BaCO3
c0x1.6 0 0
ceq0 1.6-xxx
解得x=0.064
所以1.0 L饱和碳酸钠溶液可使0.064 mol BaSO4转化为BaCO3,0.20 mol BaSO4固体粉末全部转化,需用1.0 L饱和碳酸钠溶液处理3~4次。
2 沉淀与酸碱的竞争平衡
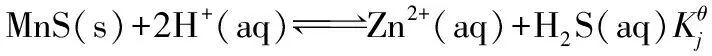
溶解过程包含三步:



这个体系中,Mn2+和H+对S2-形成竞争,分别生成MnS沉淀和弱酸H2S,利用多重平衡规则,沉淀溶解反应=(1)+(2)+(3),所以溶解反应的竞争平衡常数:
沉淀与酸碱的竞争平衡与沉淀转化反应的竞争平衡计算方法相同,一是利用多重平衡规则,二是采用上下凑因子的数学方法。两种方法比较而言,第二种方法要求学生对知识掌握熟练,应用自如。从沉淀与酸碱的竞争平衡常数大小,就可以初步判断沉淀溶解的难易程度。
2.1 沉淀在酸碱体系中溶解难易的判断
【例3】用竞争平衡的知识判断HgS沉淀溶于盐酸的情况。
HgS溶于盐酸的反应为:

2.2 沉淀在酸碱体系中溶解的计算
【例4】0.05 mol Mg(OH)2沉淀,溶于1.0 L氯化铵溶液,氯化铵浓度至少为多少?
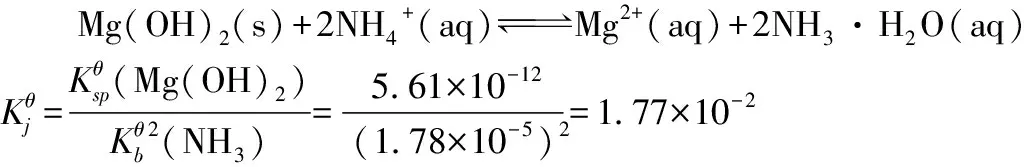
设氯化铵浓度至少为xmol·L-1

c00.05x0 0
ceq0x-0.10 0.05 0.10
解得 x=0.268
所以0.05 mol Mg(OH)2沉淀溶于1.0 L氯化铵溶液,氯化铵浓度至少0.268 mol·L-1。
3 沉淀与配合物的竞争平衡
沉淀与配合物的竞争平衡包含两个方向:一是沉淀在配位剂溶液中形成配合物溶解,二是配合物溶液由于沉淀剂的加入而产生沉淀,其解题思路与沉淀转化、沉淀与酸碱的竞争平衡一脉相承,沉淀和配合物的竞争平衡题型多样,变化灵活,是各类考试的重点和难点,值得关注。
【例5】0.1 mol的AgCl完全溶于1.0 L的氨水溶液,所需氨水的最低浓度是多少?
解:AgCl 溶于氨水的总反应
它由沉淀溶解平衡(1)和配位平衡(2)相加得到。
所以总反应的平衡常数:
欲使0.1 molAgCl溶解于1.0 L氨水中,可设氨水的初始浓度为xmol·L-1
c00.1x0 0
ceq0x-0.2 0.1 0.1

所以氨水的最低浓度是2.44 mol·L-1。
【例6】0.1 mol·L-1的KCN溶液1.0 L ,最多可以溶解多少克AgCl?
这道题请学生自行解答。
【例7】用竞争平衡的观点解释AgCl可溶于过量氨水,继续向体系滴加KBr溶液,产生AgBr沉淀,继续加入Na2S2O3溶液,沉淀消失,继续加入KI溶液,产生黄色AgI沉淀的现象。
解:这一系列过程对应的竞争平衡分别为:
对应的竞争平衡常数分别为:
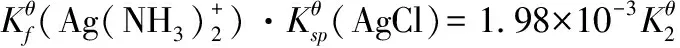
=3.67×102
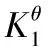
4 竞争平衡知识的扩展
化学竞争平衡包含沉淀转化、酸碱转化、配合物转化的内部竞争以及不同平衡体系,如沉淀与酸碱、沉淀与配合物、配合物和酸碱的竞争,更复杂的还有三重体系竞争平衡,解题思路都一致,我们以沉淀反应为例具体分析了竞争平衡的解题思路和过程,在复杂的体系中去除干扰、抓住问题核心,迎刃而解。最后我们举一个复杂的三重竞争体系,包含沉淀、酸碱和配位三种作用,虽然体系更复杂,但本质不变,只要掌握方法和原理,就抓住了解决这类问题的钥匙。
【例8】硫化汞HgS(s)是一种极难溶的电解质,既不溶于酸,也不能采用配位作用溶解,用竞争平衡知识解释说明HgS(s)在碘化钾的酸性溶液中的溶解性。
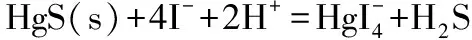
平衡常数为:
HgS(s)在碘化钾的酸性溶液中受到酸碱和配位的共同作用,反应的竞争平衡常数比较大,所以可以溶解;单纯的酸碱和配位作用竞争不过沉淀作用,表现为竞争平衡常数小(如【例3】),不能使硫化汞HgS(s)溶解。
5 结 语
化学反应的竞争平衡问题是灵活多样的,是酸碱、沉淀、配位作用的两两竞争或三者竞争,而解决方法都遵循三个步骤:写出竞争平衡总反应;计算竞争平衡常数(根据个人习惯和对知识的掌握情况选择多重平衡规则或书写平衡常数、上下凑因子两种方法来计算);然后根据题目要求进行解释或计算未知数。看似复杂的、物质较多的竞争平衡体系,只要抓住问题的关键进行分析研究,万变不离其宗,本质都是一脉相承的知识体系,有相同的解题思路,学生再加以练习,开阔眼界,就能完全掌握竞争平衡这个知识点。

