羊源铜绿假单胞菌的分离鉴定与生物学特征分析
丁敬茹,苗永强,单鸿鹄,白新栋,吴滨滨,张域琪,杨增岐
(西北农林科技大学动物医学院,陕西杨凌 712100)
铜绿假单胞菌(P.aeruginosa)又名绿脓杆菌,革兰氏阴性菌,也是一种常见的条件致病菌。广泛存在于动物机体和潮湿的环境中,如动物皮肤、呼吸道、空气、水、土壤等。铜绿假单胞菌通常引起呼吸道和泌尿系统感染,是导致人呼吸道疾病的主要致病菌之一[1]。此外,铜绿假单胞菌还可感染畜禽和野生动物,可引起狐狸子宫内膜炎[2]、水貂出血性肺炎[3]、羊慢性化脓性肺炎[4]、奶牛乳房炎和肺炎[5]等疾病,对畜禽具有不同程度的危害,由于其具有天然耐药性,治疗起来相对困难[6]。2022年4月陕西省榆林市某绵羊场约3%的绵羊出现咳嗽、气喘、低热等症状,经青霉素、链霉素治疗无效。6~7 d后部分羊行走困难、卧地不起、腹式呼吸,最终衰竭死亡。剖检病死绵羊可见肝、肺等脏器肿大、出血,其中肺出血尤为严重,且有大小不等、散在分布的化脓灶。最后对病死绵羊肺脏进行取样检测,支原体、小反刍兽疫病毒、口蹄疫病毒和副流感病毒均为阴性,从肺脏组织分离到5株铜绿假单胞菌,并对该菌株进行了致病性试验、药敏试验和生物被膜试验,为该菌引起呼吸道疾病的防治提供科学依据。
1 材料与方法
1.1 材料
1.1.1 病料来源及实验动物 试验涉及的样品均来自2022年4月陕西省榆林市某存栏量3 000只的羊场,约3%的羊被毛粗乱、精神沉郁、双眼红肿、咳嗽、气喘、低热、流脓性鼻液且部分羊出现腹泻的症状。病羊经青霉素、链霉素联合用药治疗,但仍死亡8只,病理剖检主要表现肝、肺、脾等脏器肿大、肺脏水肿出血严重并伴有局部化脓灶、肝脏轻微出血、胆囊肿大、胆汁稀薄、胸腔积液等病理变化,无菌采集病死羊的肺脏组织以及发病羊的鼻拭子低温保存送至实验室诊断;18只SPF级昆明小鼠购自成都达硕实验动物有限公司。
1.1.2 主要试剂与仪器 营养琼脂和MH琼脂,青岛海博生物技术有限公司产品;绵羊血采自西北农林科技大学实验动物中心健康绵羊;细菌微量生化反应管,杭州滨和微生物试剂有限公司产品;药敏纸片,杭州滨和微生物试剂有限公司产品;细菌DNA提取试剂盒(离心柱型),天根生化科技有限公司产品;引物合成和产物测序由西安擎科生物公司完成;病毒RNA提取试剂盒(离心柱型),天根生化科技有限公司产品;PCR Mycoplasma Detection Kit,北京全式金生物技术有限公司产品;细菌浊度仪,杭州齐威仪器有限公司产品。
1.2 方法
1.2.1 支原体和病毒的鉴定 提取病羊肺组织基因组,参考已经研究合成的引物分别检测支原体、小反刍兽疫病(PPRV)、口蹄疫病毒(FMDV)、副流感病毒3型(PIV3)[7-9](表1)。

表1 引物信息
1.2.2 细菌分离鉴定
无菌剪取一小块肺脏病变组织,用无菌接种环蘸取新鲜切面在50 g/L绵羊血琼脂培养基上划线,分别置于37 ℃需氧和厌氧培养箱培养24 h后择优势菌再连续纯化培养3代,纯化后挑取单菌落抹片进行革兰氏染色,镜检观察其形态。
挑取纯化培养后的单菌落,分别接种于葡萄糖、木糖、果糖、L-精氨酸、氧化酶、尿素、枸橼酸盐、明胶、硫化氢、V-P、乳糖、吲哚等细菌微量生化反应管中,用封口膜封口,然后放入37℃恒温培养箱中培养24 ~ 36 h,观察其生化反应并记录。
16SrRNA基因扩增的通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')由西安擎科生物公司合成。用DNA提取试剂盒提取该分离菌的DNA,然后进行16SrRNA基因扩增,PCR扩增体系(25 μL)为:2×TaqPCR Mix 12.5 μL,上、下游引物各1 μL,模板2 μL,ddH2O 8.5 μL。反应条件为:94 ℃ 5 min;94 ℃ 30 s,62 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。将PCR产物进行核酸凝胶电泳试验,核对目的条带大小后将PCR产物送往西安擎科生物公司进行测序,并将测序结果于NCBI官网上进行Blast序列比对,根据比对结果,选取同源性较高的部分菌株序列用MEGA11软件构建系统进化树。
1.2.3 小鼠致病性试验 挑取纯化培养后的单菌落于无菌生理盐水中制备浓度约为1.5×108CFU/mL的菌悬液。将18只20 g左右的小鼠随机分成2组,试验组每只腹腔注射0.2 mL菌液,对照组每只腹腔注射相同剂量无菌生理盐水,同等条件下饲养,观察小鼠状态及死亡情况,对死亡小鼠进行病理剖检,对肺脏和肝脏再进行细菌分离鉴定。
1.2.4 药敏试验 用药敏纸片琼脂扩散法对分离菌株进行药敏试验,用常用的阿莫西林、庆大霉素等20种抗菌药物药敏片检测该菌的敏感性。药物敏感性判断参考欧盟药敏试验标准委员会(EMCAST)公布的兽用抗菌药的耐药判定标准。
1.2.5 生物被膜试验 采用改良结晶紫染色法对生物被膜进行半定量测量,将待检菌株接种于LB肉汤培养基中,空气摇床37 ℃、180 r/min过夜培养。每株菌设6个平行孔,将细菌按照1∶100稀释于LB肉汤培养基中,用移液枪吸取200 μL加于96微孔板,37 ℃静置培养36 h。培养完成,弃去上清,甲醇固定15 min,随后PBS清洗3次,每孔加200 μL 10 g/L结晶紫染色5 min,PBS清洗3次,晾干。用330 mL/L冰乙酸溶解吸附在孔内的结晶紫,时间为30 min。最后用酶标仪测OD 600 nm吸光度值。
2 结果
2.1 支原体和病毒鉴定结果
参考已研究合成引物,分别对8只病死羊进行支原体(PPLO)、小反刍兽疫病毒(PPRV)、口蹄疫病毒(FMDV)、副流感病毒3型(PIV3)检测,检测结果均为阴性(图1~图4)。

M.DNA标准DL 2 000;1~8.8只羊支原体;+.阳性对照
M.DNA标准DL 2 000;1~8.8只羊反刍兽疫病毒;+.阳性对照

M.DNA标准DL 2 000;1~8.8只口蹄疫病毒;+.阳性对照

M.DNA标准DL 2 000;1~8.8只羊副流感病毒3型;+.阳性对照
2.2 细菌分离鉴定结果
2.2.1 菌落特征与细菌形态 该分离菌在绵羊血琼脂培养基中出现具有溶血环且有特殊气味的菌落,菌落拉丝黏稠(图5A);染色镜检为革兰氏阴性杆菌(图5B)。其菌落特征与细菌形态均符合铜绿假单胞菌特点。

图5 分离菌株血平板上菌落形态(A)和细菌革兰氏染色形态(B,1 000×)
2.2.2 生化鉴定结果 严格按照细菌微量生化反应管试剂盒操作规范对以上5株菌进行生化鉴定,结果均符合铜绿假单胞菌的生化特性(表2)。
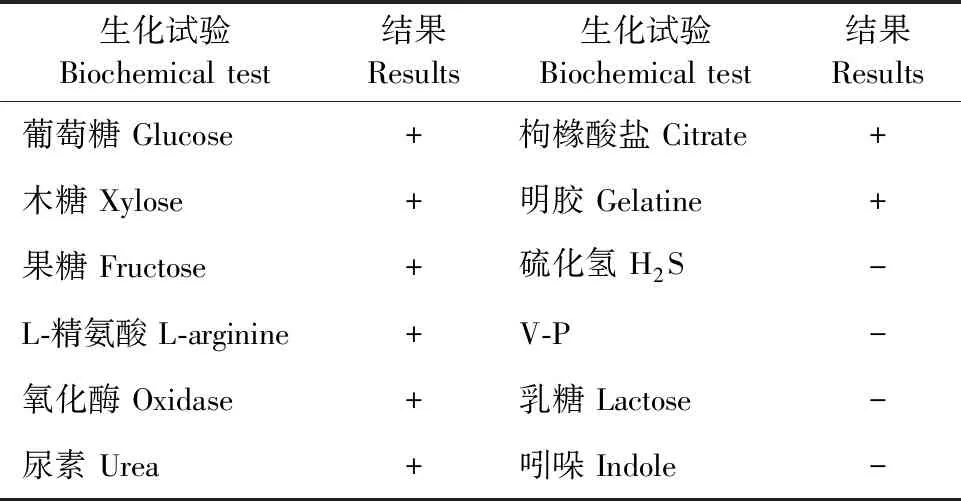
表2 分离菌株的生化特性
2.2.3 16SrRNA基因测序及系统进化树 将分离菌株进行16SrRNA基因扩增后,扩增目的基因长度为1 450 bp,与预期大小相符(图6)。16SrRNA基因进化树分析表明本试验分离的5个菌株与铜绿假单胞菌亲缘关系最近并聚为一支(图7),再次证明该分离菌株为铜绿假单胞菌,将菌株分别命名为PA1~5。
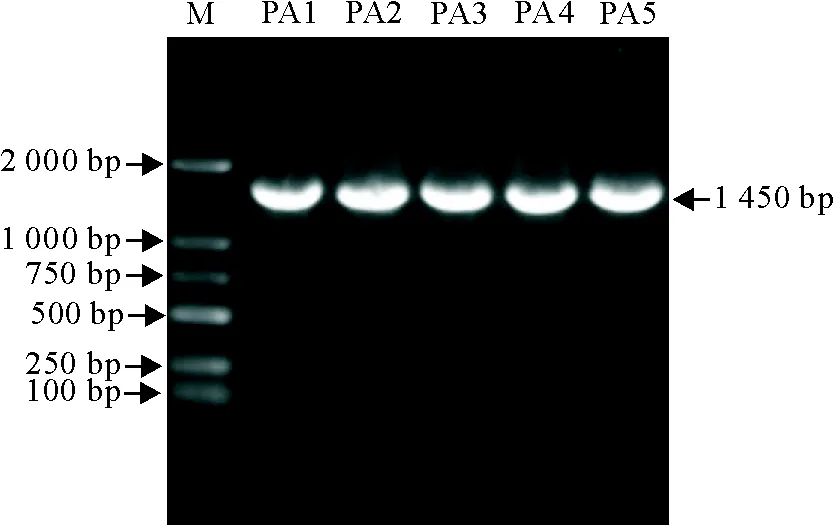
M.DNA标准DL 2 000;PA1~5.本试验菌株

图7 16S rRNA基因进化树(方框中为分离菌株)
2.3 小鼠致病性试验结果
试验组小鼠注射菌液4 h后,开始出现精神不振、畏寒扎堆、被毛粗乱、体温上升等症状,并于24 h内全部死亡,而对照组小鼠精神状态良好。试验组死亡小鼠剖检可见皮下有胶冻样绿色渗出物、肺脏充血肿大、严重出血,呈现红色肝变,肝脏肿大且有出血点,脾脏肿大、暗红。对照组小鼠肺、肝、脾剖检未见异常病理变化。试验组小鼠肺脏和肝脏进行细菌分离培养后,可再次获得铜绿假单胞菌,而对照组小鼠组织培养未能获得铜绿假单胞菌。
2.4 药敏试验结果
该试验分离5株铜绿假单胞菌对恩诺沙星、庆大霉素均敏感,部分菌株对庆大霉素、链霉素敏感;对硫酸新霉素、大观霉素、金霉素、安普霉素、泰妙菌素、多黏菌素B、四环素、卡那霉素、土霉素、链霉素、头孢噻呋钠介于敏感与耐药之间;对氨苄西林、阿莫西林、替米考星、氟苯尼考、泰乐菌素、泰万菌素、多西环素均表现耐药性(表3)。
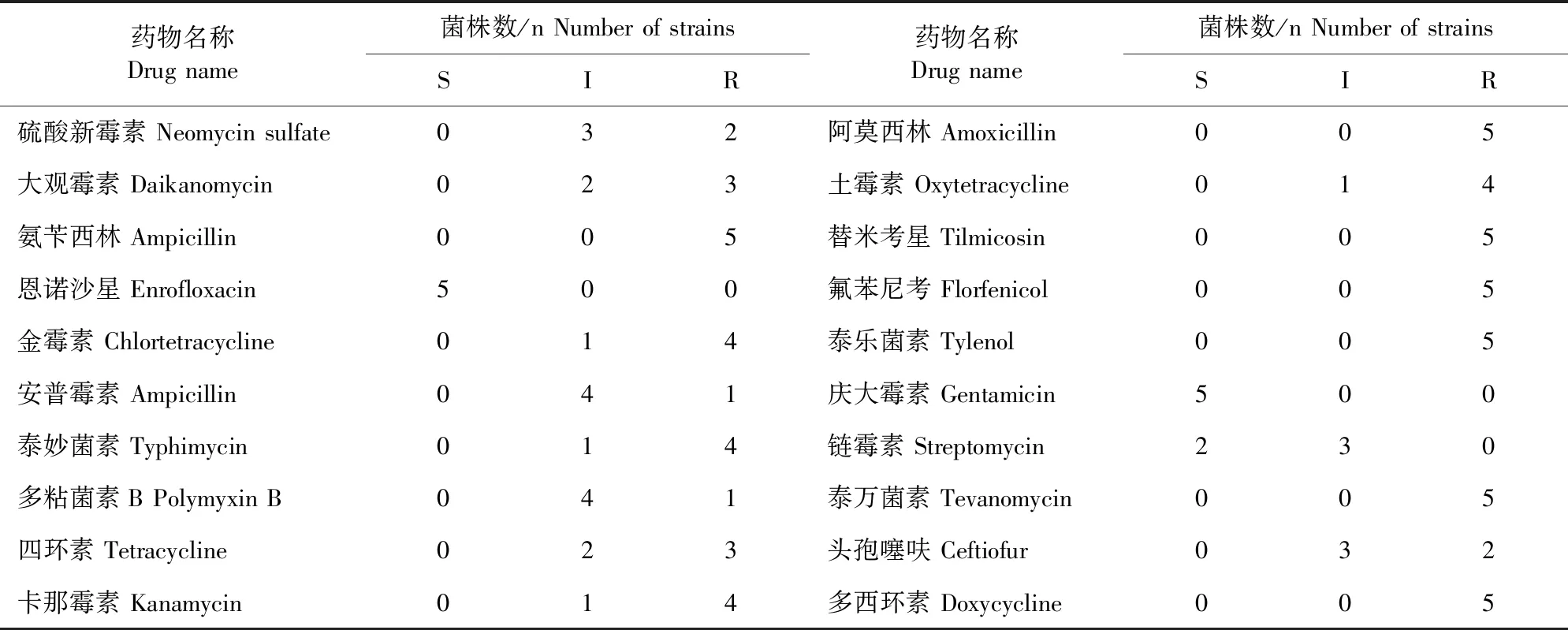
表3 分离菌株药敏试验结果
2.5 生物被膜试验结果
据参考文献[10],ODs的值可根据生物被膜形成的能力分为4种不同的表型,分别为无成膜能力、弱成膜能力、中等成膜能力和强成膜能力,ODC、OD 600 nm值分别取所设6个平行组的平均值(表4)。
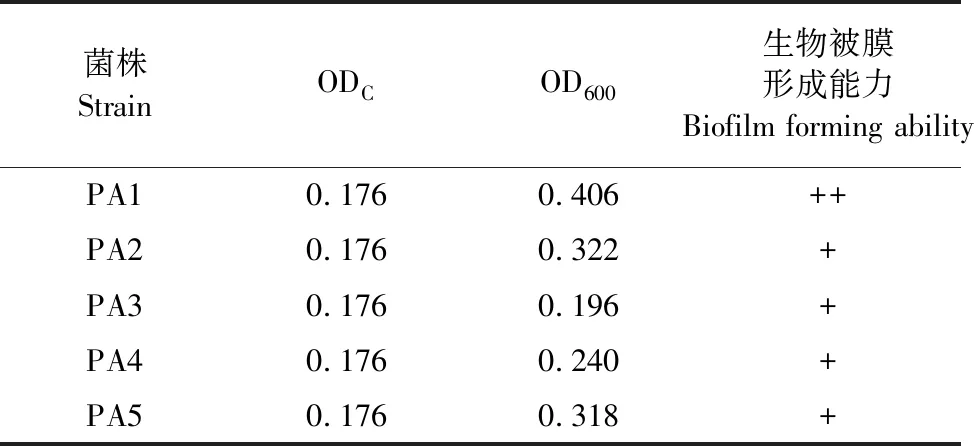
表4 5株铜绿假单胞菌生物被膜形成能力
3 讨论
呼吸道疾病已成为危害牛、羊等反刍动物健康养殖最重要的疾病之一[11],其中细菌、支原体、病毒以及寄生虫均可引起羊呼吸道疾病,混合感染现象屡见不鲜[12],本研究中,我们对8只因呼吸道疾病死亡羊分别检测了支原体、小反刍兽疫病毒、口蹄疫病毒和副流感病毒,检测结果均为阴性,并对肺组织中细菌进行分离。最终在肺脏组织中分离鉴定得到5株铜绿假单胞菌,推测铜绿假单胞菌是引起该羊场呼吸道疾病的病原菌之一,并对其生物学特性进行进一步分析。
小鼠致病试验表明该菌具有一定的致病性,药敏试验表明5株铜绿假单胞菌对恩诺沙星、庆大霉素均敏感;对氨苄西林、阿莫西林、替米考星、氟苯尼考、泰乐菌素、泰万菌素、多西环素均表现耐药性。本研究结果与王小园[13]、姜晓东等[14]略有不同,这可能是由于不同地区铜绿假单胞菌株的血清型对药物的敏感性有所差异,临床上抗菌药物滥用加剧耐药菌株的产生[15]。因此,在治疗过程中要根据临床实际情况合理用药,该结果有助于指导该场铜绿假单胞菌感染的临床用药。生物被膜试验结果表明,PA1具有中等生物被膜形成能力,菌株PA2~5具有弱生物被膜形成能力。与王小园[13]的研究相比,该场具有中等生物被膜形成能力的菌株较多,无强生物被膜形成能力的菌株,但该场所检菌株均可形成不同程度的生物被膜。差异原因可能是检测菌株较少,只反映部分菌株情况,未能体现全场感染菌株情况,也可能与之相比该场菌株生物被膜形成能力总体偏弱。生物被膜是一种膜状聚集体,由蛋白质和胞外多糖等物质形成,黏附于黏膜及各种物体表面,是细菌适应生存环境的一种形式[16],生物被膜一旦形成,会提高细菌的存活率、致病性和耐药性[17],还可以阻挡吞噬细胞的吞噬,使得细菌在体内迅速增殖[18],因此我们要加强管理,预防铜绿假单胞菌的感染。
近年来,有关铜绿假单胞菌感染的病例不断增多,由于其具有天然耐药性[19],常见药物治疗起来相对困难。该菌可感染毛皮动物(貂、狐)、家养动物(牛、羊) 、宠物(犬、猫)、国家保护动物(林麝),给畜牧业造成巨大的经济损失[20-21]。铜绿假单胞菌广泛存在于环境中,当动物机体应激、其他疾病感染、抵抗力下降、营养不良、环境恶劣时,便可引起感染[22],因此在日常饲养时,可以添加适量益生菌,益生菌不仅可以合成多种维生素还可以刺激机体免疫系统,是良好的免疫激活剂,可有效提高干扰素和巨噬细胞的活性,提高机体的免疫力[23]。同时要改善环境卫生、加强环境消毒、保证圈舍干净、科学饲养管理,减少铜绿假单胞菌的感染。
综上所述,我们确定了本次羊场呼吸道疾病的主要病原是铜绿假单胞菌,试验数据表明,铜绿假单胞菌具有一定的致病性和耐药性,且该菌可形成不同强弱程度的生物被膜,该试验结果有助于指导铜绿假单胞菌引起的羊呼吸道疾病的临床治疗。更提醒在日常饲养过程中,要加强消毒,增加羊群的免疫力,贯彻防大于治的理念,减少铜绿假单胞菌的感染。

