自愈水凝胶的构建及生物医学应用
肖福兵,李 红,刘 洁,蒙丽君,杜文芳,杨胜园
(1.南华大学衡阳医学院公共卫生学院 湖南省典型环境污染与健康危害重点实验室,湖南 衡阳 421001)(2.滨州学院生物与环境工程学院,山东 滨州 256600)
1 前 言
水凝胶(hydrogels)是一类含水量高但不溶于水的软性高分子聚合物材料,一般通过物理或化学交联反应制备而成[1-2]。在微观上,水凝胶聚合物中存在大量的亲水基团(羧基,羟基,氨基等),可以通过吸收水分来保持其三维网络结构,使水凝胶具有一定形状;在宏观上,水凝胶受到特定的外界刺激时可发生体积变化或凝胶-溶胶转变,使之同时兼具液体和固体性质[3-4]。水凝胶的独特结构使之与生物组织存在极大的相似性,因而是一种新型生物智能软材料,在组织工程、药物输送、细胞培养等生物医学领域具有广泛的应用前景[5-8]。
在20世纪50年代,关于水凝胶的理论研究就已经开始,而直到1960年之后其应用研究才相继出现。Wichterle等[9]首次以聚羟乙基甲基丙烯酸酯为原料制备了水凝胶,并应用于隐形眼镜的制造,为水凝胶的应用开辟了方向。随着对水凝胶研究的深入,研究者们在传统水凝胶的基础上制备出了各种功能性水凝胶,在医学诊断、光敏检测、生物化学传感等领域具有巨大的应用潜能[10-15]。然而,传统水凝胶的应用通常受到其自身力学性能的限制,例如机械强度低、易被破坏等。因此,仿照生物组织自我修复损伤的能力,开发具有自愈性质的水凝胶材料成为了研究热点[16]。
自愈水凝胶是指能够在受到外部损伤后,经自身修复而使形态、性能接近或达到损伤前状态的一类新型水凝胶材料[17]。与传统水凝胶相比,自愈水凝胶的结构和功能得到明显改善,使用寿命得到有效延长[18]。同时由于水凝胶具备高含水量、可流动性、生物相容性及生物可降解性等优点,在生物医学方面的应用中比其他高分子材料更具优势[19]。
本文将系统地综述自愈水凝胶的最新研究进展,介绍自愈水凝胶的制备机理以及其在组织工程、药物输送、细胞培养等生物医学领域中的应用,总结自愈水凝胶发展中的挑战和前景,旨在为自愈水凝胶材料的合成及其生物医学应用提供参考。
2 自愈水凝胶的制备机理
近年来,自愈水凝胶因其独特的性能,受到研究者们越来越多的关注。水凝胶的自愈能力通常是基于可逆反应交联,即凝胶网络上的官能团在凝胶受损区域能产生可逆的物理或化学相互作用而实现的。根据自愈方式的不同,可将自愈水凝胶分为物理自愈和化学自愈2类。如图1所示,物理自愈水凝胶通过非共价键相互作用来重建网络,这种作用主要包括氢键作用、疏水缔合作用、主客体相互作用、离子相互作用等;化学自愈水凝胶则通过动态的共价键来重建网络,其中包括硼酸酯键、亚胺键、酰腙键、二硫键等。由于水凝胶的稳定性、自愈能力及其力学性能都受到水凝胶合成机制的影响,因此,了解自愈水凝胶的合成机制对制备特定用途的水凝胶至关重要。
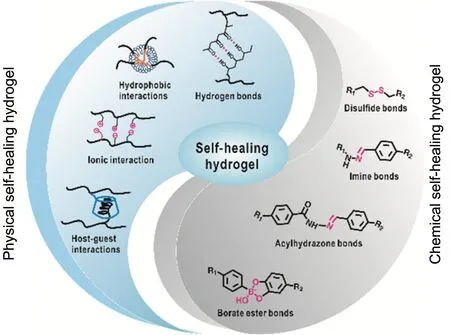
图1 自愈水凝胶合成原理
2.1 可逆非共价键作用
本节重点介绍由氢键作用[20-22]、疏水缔合作用[23,24]、主客体相互作用[25,26]和离子相互作用[27-29]交联的自愈水凝胶。尽管这种物理相互作用可快速形成自愈水凝胶,但由于非共价键间的作用力较弱,因而仅由单一作用力交联构建的水凝胶力学性能通常较差。在实际应用中,常采用多种可逆非共价键协同作用增强水凝胶的力学性能。
2.1.1 氢键作用
氢键是最常见的非共价键相互作用之一,通过氢原子与氧、氮、氟等高电负性原子之间产生相互作用形成[30]。利用氢键作用对不同聚合物进行动态交联,可赋予水凝胶一定的自愈能力[17]。
聚乙烯醇(polyvinyl alcohol,PVA)含有大量羟基,可形成多重氢键,并且利用PVA制备出的水凝胶具有低毒性、可自愈等优点,近年来受到研究者的大量关注。PVA的力学性能较差,胡欠欠等[20]在PVA水凝胶的基础上,引入聚丙烯酰胺(PAM)骨架,制备出了一种具有更高强度的聚乙烯醇/聚丙烯酰胺(PVA/PAM)自愈水凝胶。由于2个断面间的PVA和PAM分子链之间存在氢键,以及分子链之间的运动,水凝胶自愈,愈合后水凝胶的拉伸强度为40 kPa,约恢复到初始水凝胶强度(428 kPa)的10%。
除此之外,在PVA水凝胶基质中加入纳米材料,利用纳米材料表面丰富的官能团与PVA分子链上的羟基(—OH)交联形成氢键来增加水凝胶的交联度,从而提高其机械强度[31]。如图2所示,Liao等[21]以导电的功能化单壁碳纳米管(FSWCNT)为载体,采用动态氢键交联制备了一种具有良好导电性能的PVA纳米复合自愈水凝胶。在硼酸盐的存在下,碳纳米管、聚乙烯醇和聚多巴胺(PDA)之间形成超分子交联(氢键、π-π堆积),以及PVA上羟基与四官能团硼酸根离子之间的动态络合,使得水凝胶可以在2 s内快速自愈,愈合效率达99%。用水凝胶对导电的功能化单壁碳纳米管网络进行固定,实现了对电阻变化的可重复、超灵敏和稳定的电阻变化响应,能够监测人体活动,在可穿戴电子传感器领域具有较大的应用潜力。
除了羟基(—OH)之外,酰胺基(—CONH2)和羧基(—COOH)也可以相互作用形成氢键。Wang等[22]采用甲基丙烯酰胺(MAAm)与甲基丙酸烯酸(MAAc)为原材料,通过自由基共聚的方法合成了一种具有良好形状记忆性能的自愈水凝胶。在拉伸实验中,施加100%的拉力后,由于链内和链间的氢键作用,水凝胶能够在3 min内恢复至最初的状态。将非共价键的动态性质引入到水凝胶中以制备超分子水凝胶的这种策略,可以增强水凝胶的力学性能、形状记忆性能和可回收性,使其作为结构元件在生物医学和工程领域发挥作用。
由此可见,氢键的动态可逆特性使之可以在水凝胶变形过程中不断地断裂和生成,赋予了水凝胶优异的自愈性能。然而氢键在水溶液中通常不够稳定,并且一种氢键作用力较弱,因此,常采用多重氢键协同作用或与其他强共价键结合来提高键合作用力。
2.1.2 疏水相互作用
疏水相互作用是指疏水表面或疏水物在水性介质中发生聚集[17]。与氢键相比,疏水相互作用的力更强、更易控制,可以通过改变疏水分子的形状和数量来调节疏水作用力的大小。疏水相互作用主要发生在胶束中,通常在水凝胶中加入两亲性聚合物和表面活性剂,通过疏水缔合作用形成胶束,从而得到胶束水凝胶[17]。基于胶束和两亲性聚合物之间的循环解离和结合,赋予该类水凝胶良好的自愈性。
在过去几年中,通过疏水缔合作用形成的自愈水凝胶常含有表面活性剂,合成过程十分复杂。随着对疏水作用自愈水凝胶研究的深入,进一步开发了无需添加表面活性剂的自愈水凝胶制备方法[32]。例如,冯俊峰[24]受水蛭启发,采用自由基聚合法制备了一种水凝胶-弹性体材料。该方法首先将两亲性三嵌段共聚物(PEOm-PPOn-PEOm)普朗尼克引入双键并以其为交联剂,在过硫酸钾(KPS)的作用下,与弹性体单体丙烯酸-2-甲氧基乙酯(MEA)进行自由基聚合形成普朗尼克双丙烯酸酯的胶束水凝胶(Pluronic/PMEA)。由于亲水嵌段聚环氧乙烷(PEO)分子链和疏水嵌段聚环氧丙烷(PPO)分子链之间的疏水作用,以及聚丙烯酸-2-甲氧基乙酯(PMEA)分子链的运动,使得Pluronic/PMEA干凝胶在经过拉伸后,在5 ℃接触24 h后愈合40%,在45 ℃下接触24 h后愈合68%。Meng等[32]将疏水单体甲基丙烯酸硬脂酸酯(C18M)溶解在两亲性再生丝素(RSF)溶液中,形成单分散球体系,然后通过引入海藻酸钠(sodium alginate,SA)与Ca2+之间的离子相互作用,制备了疏水缔合(hydrophobic-association,HA)水凝胶(SA-RSF-C18M-30 HA gels)。如图3所示,由于疏水单体C18M和两亲性RSF存在疏水相互作用,使得水凝胶能够在不同的应变作用下恢复如初,在12 h内裂纹接近消失。
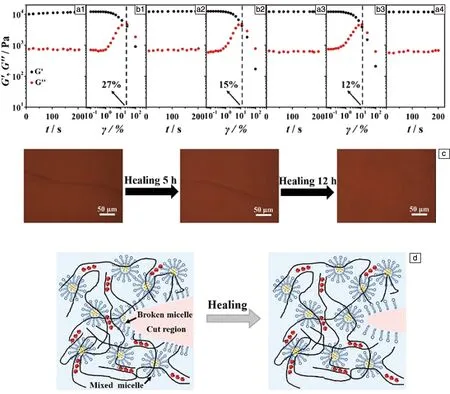
图3 SA-RSF-C18M-30 HA水凝胶自愈机理[32]:(a1,a2,a3,a4)SA-RSF-C18M-30 HA凝胶在37 ℃下的应变扫描循环在应变为0.1%和频率为1 Hz下储能模量(G′)和损耗模量(G″)的时间依赖性;(b1,b2,b3)在频率为1 Hz下G′和G″的应变依赖性;(c)水凝胶自愈过程的金相照片;(d)水凝胶愈合前后的结构示意图
Chen等[33]以疏水单体丙烯酸丁酯(BA)、甲基丙烯酸-2-二甲氨基乙酯(DMAEMA)和甲基丙烯酸(MAA)为原料,通过聚合和浸泡,制备了一系列物理交联水凝胶。如图4所示,切开的水凝胶可在5 min后自愈,愈合后的应变曲线与原始应变曲线几乎重叠,表明其愈合效率接近100%。这种良好的自愈性能归因于丁基侧链的疏水链段倾向于聚集形成物理交联点,从而形成较大的动态区,在疏水缔合作用下,单个动态区又可通过物理交联点重新交联。
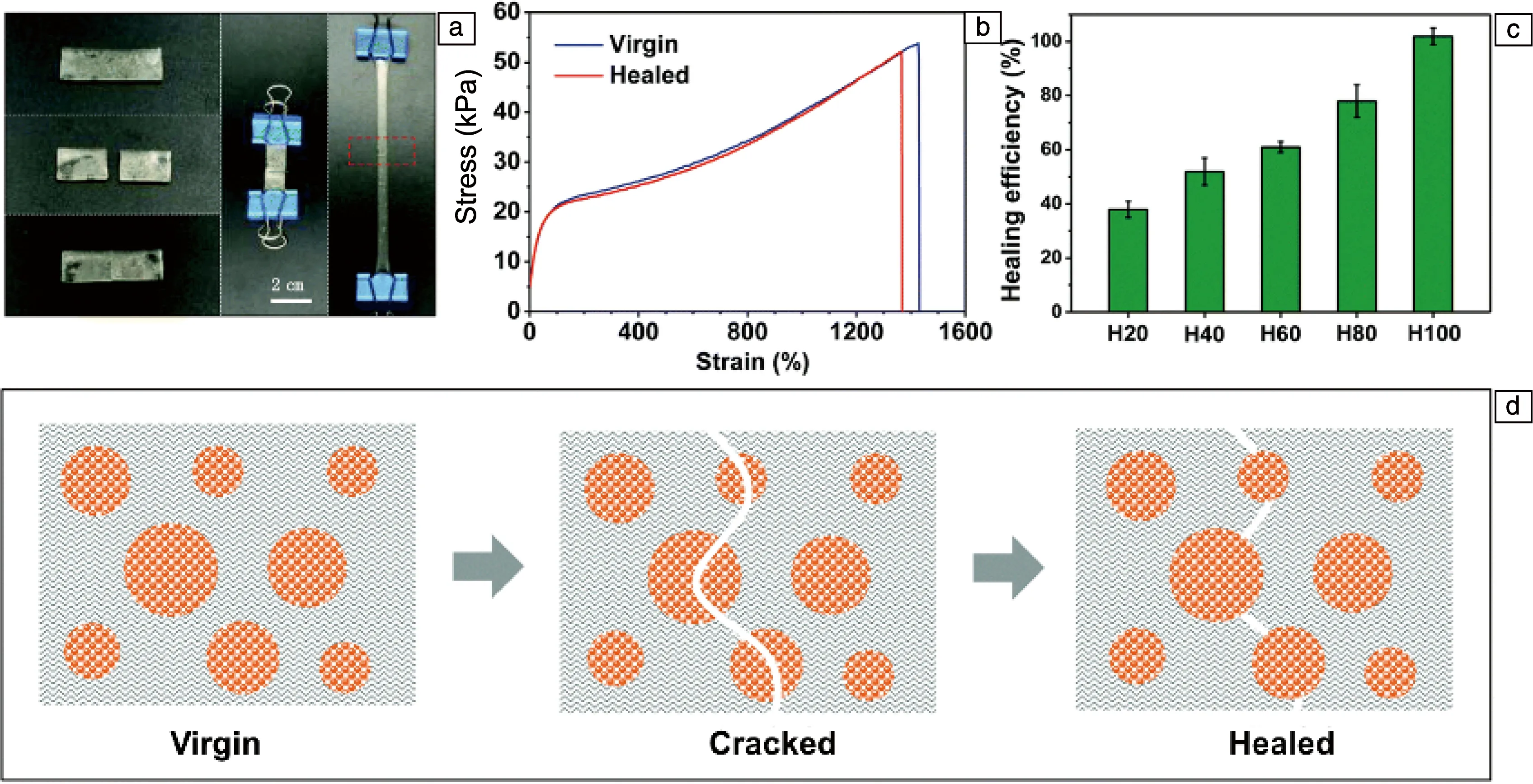
图4 基于疏水相互作用的水凝胶的自愈结果及机理[33]:(a)水凝胶的自愈表现,(b)未受损和愈合后水凝胶的应力-应变曲线,(c)水凝胶的自愈效率,(d)水凝胶的自愈机制示意图
虽然通过疏水缔合作用制备出的自愈水凝胶在力学性能上有一定的改善,但制备过程复杂,且自愈性能会随着时间延长而逐渐减退。因此,不断开发新的疏水性共聚物,结合多种缔合机制来提高水凝胶稳定性是开发满足需求的自愈水凝胶的关键。
2.1.3 主客体相互作用
主客体相互作用是指大环分子中的空腔利用疏水相互作用、氢键、π-π堆积等非共价键方式选择性地容纳小分子物质以形成包合物。由于主客体相互作用具有较好的选择性和可逆性,在构建高强度自愈水凝胶中展现出独特优势[17,34]。
环糊精(CD)和葫芦脲(CB)可以与多种客体物质形成包合物,常用于制备基于主客体相互作用的水凝胶。Yang等[25]报道了一种以β-环糊精(β-CD)改性的丙烯酸为主体、金刚烷功能化的透明质酸为客体来制备水凝胶的方法。这2种改性后的物质通过预组装有效地形成主客体复合物,经直接交联可以得到自愈水凝胶,这种水凝胶具备稳定的物理性质、优异的生物相容性和良好的自愈能力。如图5所示,以N,N′-亚甲基双丙烯酰胺(MBA)为不可逆交联网络,以β-CD和金刚烷功能化的透明质酸(ADxHA)之间的主客体大分子(HGM)反应为可逆交联网络,制备出具有可逆性的MBA-HGM水凝胶。Park等[26]将寡聚葫芦脲(NS-CB)和金刚胺封端的4-臂聚乙二醇(AdA-4-arm-PEG)溶液简单混合,在主客体作用下可自发形成水凝胶。自愈性能测试结果表明,水凝胶的裂纹可在1 min内快速修复完成,在此过程中少量水的加入还可促进水凝胶的自愈。
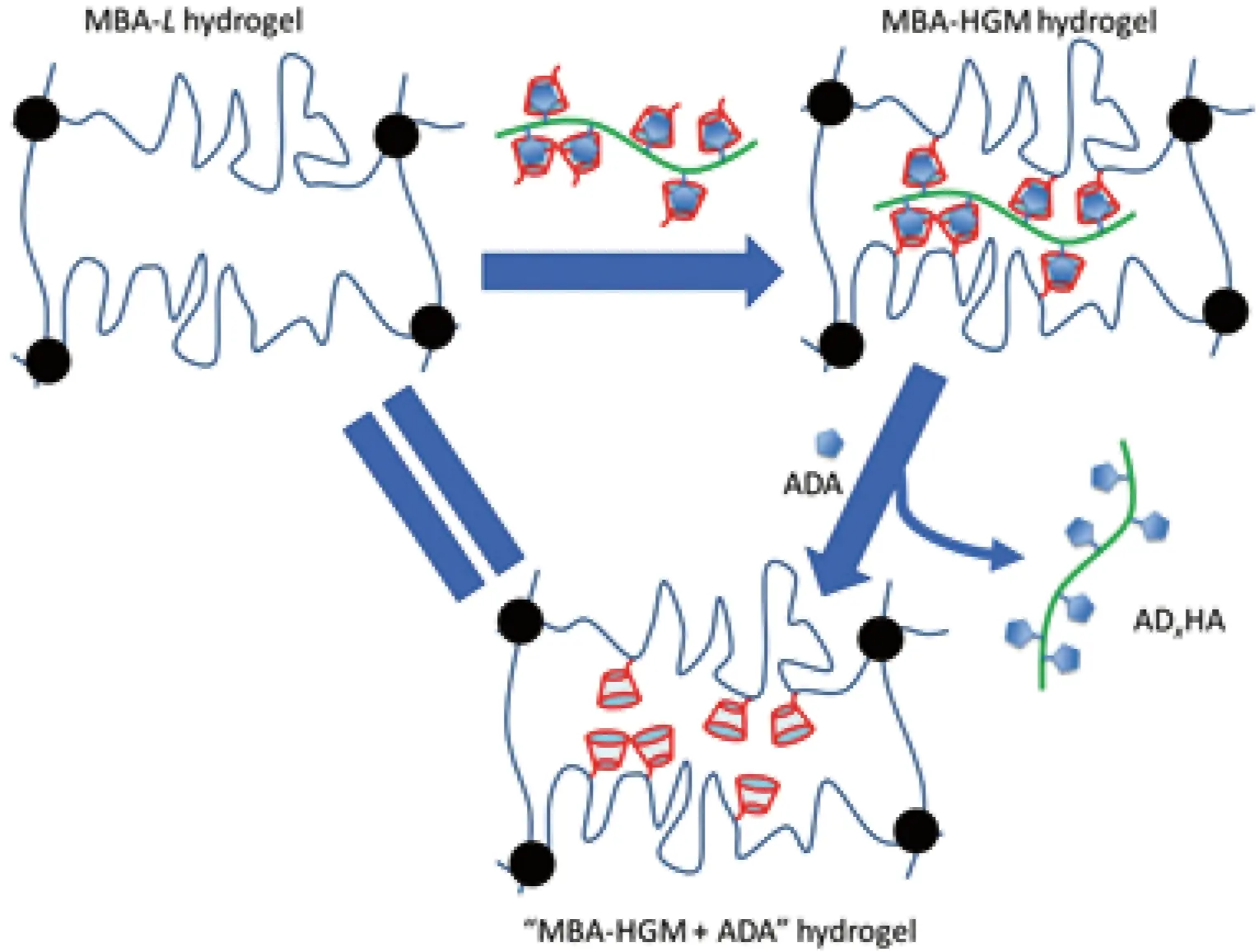
图5 MBA-HGM水凝胶的可逆控制过程示意图[25]
由于主客体相互作用具备较高的选择性和较好的可逆性,在自愈水凝胶制备方面受到了广泛的关注。其缺点是通常需要对物质进行改性,进而增强水凝胶的机械强度,制备工艺较复杂。
2.1.4 离子相互作用
水溶液中带相反电荷的离子聚合物在离子相互作用下可形成水凝胶网络结构,由于动态离子键的可逆性,使水凝胶具有自愈性能[35]。
Zheng等[28]基于离子相互作用,通过将改性的聚甲基丙烯酸二甲氨基乙酯修饰到纳米材料表面,利用聚合物产生的铵阳离子与聚甲基丙烯酸阴离子之间的相互作用,形成具有较高愈合效率的水凝胶聚合物网络。将2个切开的圆柱体水凝胶置于30 ℃环境下接触12 h,该水凝胶可以拉伸至原始水凝胶的拉伸长度,愈合效率接近100%。此外,Darabi等[29]通过两步法合成了具有物理和化学交联网络的导电水凝胶。将聚吡咯(PPy)接枝到双键修饰的壳聚糖(DCH)上,形成聚吡咯接枝壳聚糖(DCH-PPy)聚合物。接着,在DCH-PPy和铁离子(Fe3+)存在下,丙烯酸(AA)单体进行化学聚合形成聚丙烯酸(PAA)双网络水凝胶。基于PAA的—COOH、PPy的—NH—基团与Fe3+之间的动态离子相互作用,受损的水凝胶能够在2 min内恢复100%机械强度,30 s内恢复90%的导电性能。
离子键合方式制备水凝胶的过程虽然简单,但仅依靠单一离子键的交联获得的水凝胶通常机械强度低,结构脆弱。为了克服这一缺点,可将离子交联与共价交联相结合,得到力学性能更稳定的双交联自愈水凝胶网络结构。
2.2 动态共价键作用
除了非共价作用外,还可利用动态共价键制备自愈水凝胶,其自愈机理是基于化学键的动态平衡。由于共价键的稳定性较高,制备出的水凝胶通常表现出良好的机械强度和自愈性能。本节中,将重点讨论基于硼酸酯键[36-38]、亚胺键[39-42]、酰腙键[43-46]和二硫键[47,48]制备自愈水凝胶的原理。
2.2.1 硼酸酯键
硼酸可以与二元醇反应形成动态的硼酸酯键,由于该反应的可逆性,采用硼酸酯键交联得到的水凝胶在一定条件下可实现快速自愈[49]。
陈益鸣[36]以硼酸酯键交联的水凝胶作为第一重交联网络,再采用冷冻-解冻方法使PVA进行物理交联形成第二网络,构建了一种共价键与非共价键混合交联的自愈水凝胶。结果表明,该水凝胶在室温且无外界刺激的条件下,经过10 min,即可实现接近100%的快速修复,而且还具备水下自修复的性能。此外,该课题组还采用一锅法以N,N-二甲基丙烯酰胺(DMA)、丙烯酸羟乙酯(HEA)、硼酸为原料制备出了一种基于动态硼酸酯键的自修复水凝胶,该水凝胶在室温下修复48 h,自愈效率达100%,还具有良好的稳定性、类弹性体性能以及水致形状记忆性能。
如图6所示,Cai等[37]将单壁碳纳米管(single wall carbon nanotube,SWCNT)引入到硼酸和PVA交联形成的水凝胶中,可使切口在30 s内部分愈合,60 s内完全恢复正常。除此之外,在3.2 s的愈合时间内,水凝胶的电导率可恢复到其初始电导率的(98±0.8)%。并且单壁碳纳米管可以增强水凝胶的力学性能和导电性,在生物传感器、电子皮肤、可穿戴电子器件等领域具有广泛的应用前景。
除PVA外,海藻酸钠糖单元上的多重羟基也可与硼酸形成动态硼酸酯键,丁晓亚等[38]利用2-甲酰基苯基(2-FPBA)、超支化聚乙烯亚胺与海藻酸钠反应构建了一种动态可逆交联的自愈水凝胶,在室温下放置接触20 min即可完成自愈。该水凝胶制备条件温和、过程简单快速,使用含较多氨基基团的聚乙烯亚胺作为原料,使合成的水凝胶兼具自修复性能和可注射性能,可应用于组织工程支架、药物控释载体以及3D生物打印等领域。
2.2.2 亚胺键
亚胺键,又被称为席夫碱(Schiff base),由醛基(—CHO)和伯胺基(—NH2)之间发生亲核加成反应生成。亚胺键是一种较强的可逆共价键,常被作为动态交联键来制备自愈水凝胶[39]。
壳聚糖主链上含有丰富的氨基,且具有良好的生物相容性,适合制备基于亚胺键的自愈水凝胶。壳聚糖与乙二醛、戊二醛等小分子双醛交联制备水凝胶的研究已有报道,但小分子双醛的毒性往往限制了其在生物医药领域的应用[40]。海藻酸盐是一类能够用于生物医学领域且来源广泛的高分子生物材料。通常使用强氧化剂将其结构中的部分羟基(—OH)氧化成醛基(—CHO),生成氧化海藻酸盐后用作交联剂。Chen等[41]报道了一种与微球集成的抗菌可生物降解复合水凝胶敷料,该敷料是由氧化海藻酸盐和羧甲基壳聚糖基于动态亚胺键构建,并负载盐酸四环素明胶微球形成的复合水凝胶,可以作为抗菌复合敷料以促进伤口愈合。另外,壳聚糖(CS)还可与纤维素交联,实现自愈水凝胶的制备。Cheng等[42]以壳聚糖和纤维素纳米纤维这2种原料制备了自愈性可调的新型复合自愈水凝胶,该水凝胶可在9 h内完全恢复。
2.2.3 酰腙键
酰腙键由醛基或羰基与酰肼基发生缩合反应形成。由于酰腙键中不仅含有亚胺键,还存在氢键作用力,所以比亚胺键更加稳定。在酸性条件下,酰腙键能够进行动态可逆的断裂与形成,从而具有自修复的能力[50]。
侯一凡等[45]利用高碘酸钠氧化海藻酸钠,然后通过可逆的酰腙键与聚乙二醇-二苯甲酰肼进行交联,制备得到了较高弹性的pH响应水凝胶。实验结果表明,该水凝胶可以通过改变pH值实现溶胶-凝胶间的转化,有望应用于药物输送、器官修复等方面。
此外,Xiao等[46]利用含有丰富醛基的双醛纤维素纳米晶(dialdehyde cellulose nanocrystals,DACNCs)和酰肼封端聚乙二醇(acylhydrazine-terminated polyethylene glycol,HZ-PEG-HZ)作为交联剂,通过动态可逆的酰腙键合成了一种纳米复合自愈水凝胶(图7)。由于酰腙键的动态可逆性,通过调整愈合pH值、时间、浓度,可使水凝胶在8 h内愈合,自愈效率能达到100%。因此,该水凝胶具有良好的自愈性和较高的生物相容性,在组织工程和生物医学工程领域具有潜在的应用价值。
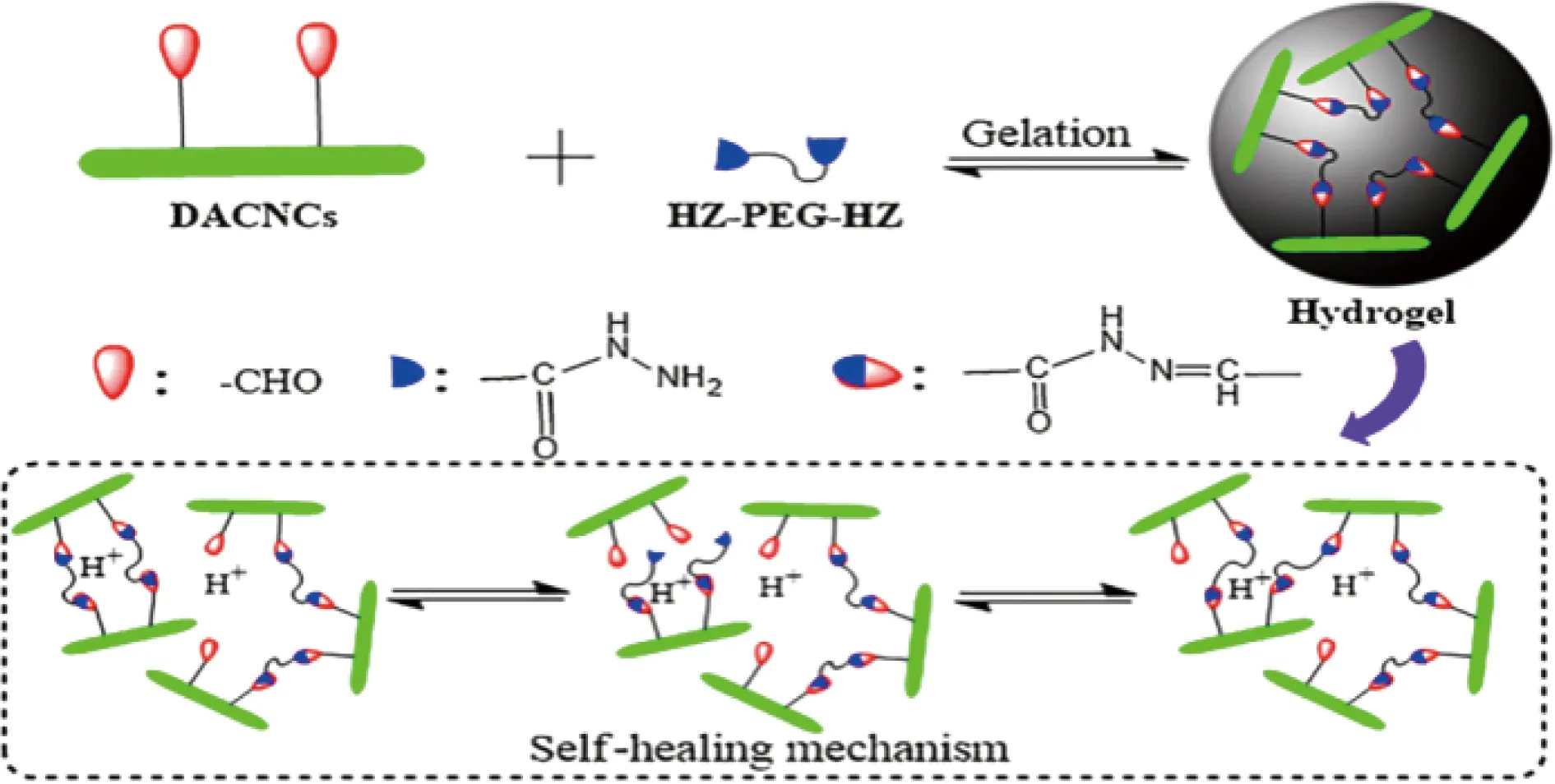
图7 二醛纤维素纳米晶基水凝胶的合成及自修复机制[46]
2.2.4 二硫键
二硫键广泛存在于蛋白质结构中,硫醇在氧化条件下可形成分子间二硫键,二硫键在还原条件下又可以断裂形成巯基,如果将这种动态化学键引入水凝胶中,可赋予水凝胶一定的自愈能力[51-52]。
Zhang等[47]通过将牛血清白蛋白中的二硫键进行重组,构建了一种新型的可快速自愈的蛋白水凝胶。该蛋白水凝胶可在1~2 min内响应H2O2刺激并快速愈合,愈合效率达100 %。另外,Zhang等[49]以巯基酰肼双功能化的透明质酸与氧化海藻酸钠为原料,通过腙键和二硫键制备了一系列可注射原位双交联水凝胶。实验结果表明,该水凝胶具有良好的综合性能,在药物缓释领域具有一定的应用潜力。
3 自愈水凝胶的生物医学应用
自愈水凝胶作为一种新型的智能软材料,与生物组织具有较高的相似性。近年来,自愈水凝胶在生物医学领域的应用越来越受欢迎,本节主要论述自愈水凝胶在组织工程、药物输送、细胞培养等生物医学领域取得的应用研究进展。
3.1 组织工程
由于自愈水凝胶具有高水合率、较好的粘性以及良好的自修复能力等优点,在组织修复和再生中发挥了重要的作用,主要表现在血管组织修复、软骨缺损修复、神经修复、心脏组织修复等[53]。
目前,虽然临床上已有多种血管组织网络构建方法,但是异体排斥、结构易破损等问题仍然存在。为了进一步改进这些缺点,Tseng等[54]利用自愈水凝胶构建了一种血管化结构。他们采用聚乙二醇二丙烯酸酯(PEGDA)、二硫苏糖醇(DTT)和硼砂溶液混合制备出一种遇葡萄糖可自动降解的自愈水凝胶,并将葡萄糖敏感的水凝胶注射到分支管状非葡萄糖敏感水凝胶中,葡萄糖敏感水凝胶碎片迅速自愈形成分支管状水凝胶。将其整体浸泡在细胞培养基中,可快速去除葡萄糖敏感性水凝胶,得到相应的管状通道,最后将血管内皮细胞注入到管状通道中。结果表明,神经干细胞和血管内皮细胞可以在该水凝胶形成的管状通道结构中生长繁殖(如图8所示),14 d后可以看到内皮细胞形成毛细管状结构,而神经干细胞形成神经球样结构。因此,该水凝胶有望用于血管结构的再生。
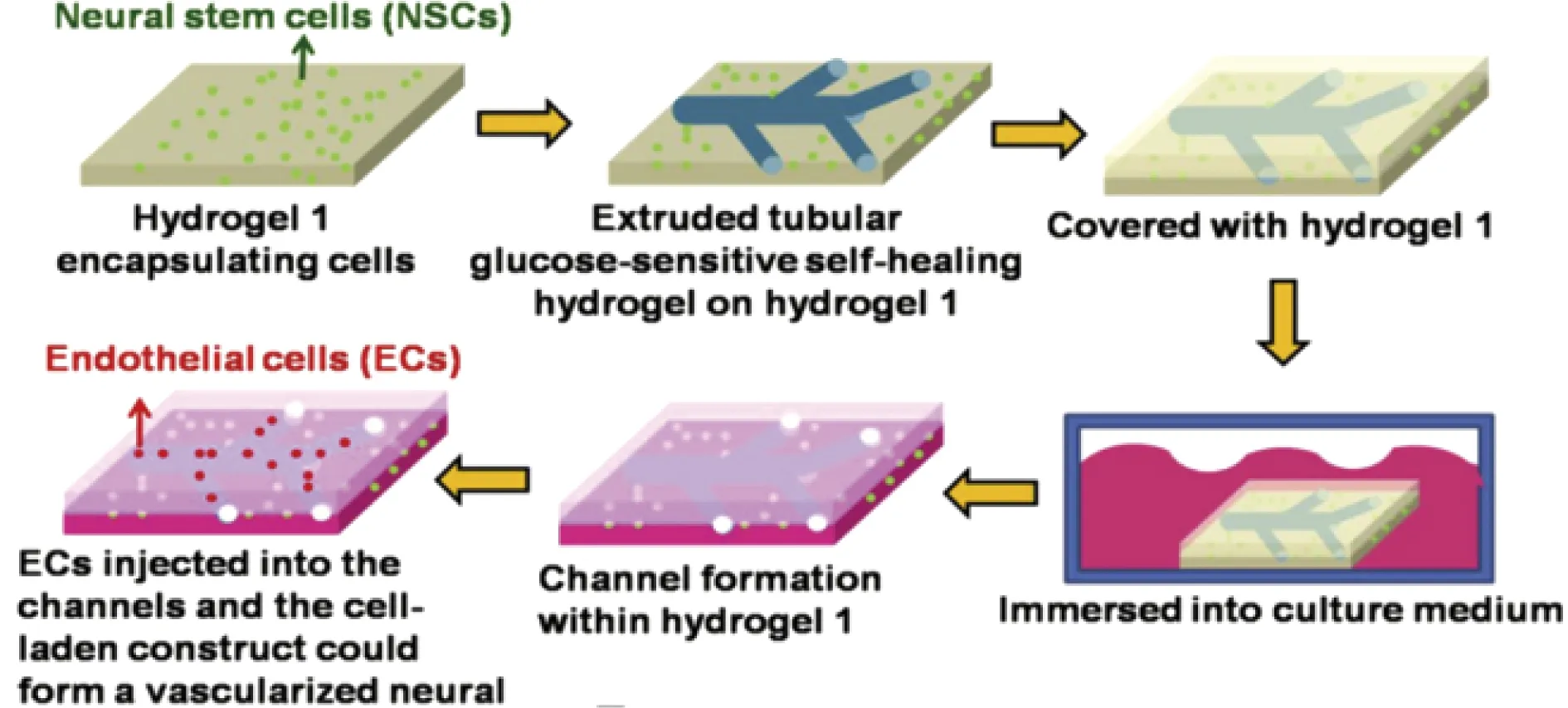
图8 自愈水凝胶构建血管结构过程示意图[54]
另一方面,因创伤或手术所致的骨缺损是临床上常见的疾病,治疗方法主要依赖植骨。但传统的植骨技术治疗时间较长,并且较易出现骨折不愈合等并发症,实验表明自愈水凝胶在骨损伤的修复方面有较好的促进作用[55,56]。壳聚糖和海藻酸钠作为一种天然高分子生物材料,来源广、成本低,并且其分子链上存在大量活性基团(羟基、氨基、羧基),易于进行化学修饰,从而与其他物质反应制备出水凝胶,具有良好的生物相容性和亲水性,适用于软骨组织分化。李云洁等[57]采用羧甲基壳聚糖和氧化海藻酸纳制备出不同交联度的水凝胶。壳聚糖中的—NH2和海藻酸钠中的—CHO能形成可逆的亚胺键,从而使断裂的水凝胶发生自愈,可维持支架材料的完整性和稳定性。另外,充分交联的可逆亚胺键使水凝胶具有更强的黏附性,能够非常紧密地填充在软骨缺损部位,支撑周围健康软骨组织和软骨再生修复。
3.2 药物输送
水凝胶的多孔结构可以装载药物,并且通过水凝胶对靶点的响应性可以精准控制药物的释放量。自愈水凝胶载体具有可注射性,可以起到防止药物降解的作用,在药物输送领域有潜在的应用前景[58]。
Song等[59]将N-异丙基丙烯酰胺(NIPAM)和丙烯酰胺(AM)嵌段共聚物作为第二网络引入羧甲基纤维素单网络凝胶(CMC Gel)中,构建了双网络水凝胶(CMC/PNIPAM-co-PAM)。由于CMC与PNIPAM-co-PAM在双网络水凝胶中存在氢键或其他分子间作用力,CMC/PNIPAM-co-PAM凝胶的热稳定性和力学性能优于PNIPAM-co-PAM凝胶。该双网络水凝胶显示出对pH值和温度的智能双重响应行为。基于此特性,将药物四环素负载到双网络水凝胶中,可以精确靶向治疗肠道细菌感染。
Chen等[60]利用氧化海藻酸钠中醛基与羧乙基壳聚糖中的氨基形成亚胺键进行交联,制备了自愈水凝胶,并通过包裹超顺磁性氧化铁纳米颗粒制备了磁性微球,同时也将模型抗癌药物5-氟尿嘧啶包埋在微球中,制备包埋5-氟尿嘧啶和磁性氧化铁的复合水凝胶微球。基于动态的亚胺键可赋予水凝胶自愈性和可注射性,适用于不同部位的药物输送,并且,由于磁性和自愈性的良好协同作用,可以同时实现自愈和磁性遥控,使负载药物的复合水凝胶微球能够更加快速、准确地到达靶部位,提高药物输送效率。
3.3 细胞培养
体外细胞培养是生物医学研究中必不可少的技术。由于自愈水凝胶中的三维网状结构类似于细胞外基质,不仅可以提供水和营养物质的交换,还可起到支撑作用,是细胞增殖和分化的理想培养基质,目前被广泛用作细胞培养的三维支架[44,61,62]。
Yang等[44]利用动态共价酰腙键构建了一类新型的纤维素自愈水凝胶,所得水凝胶具有优良的自愈能力、良好的生物相容性和稳定的力学性能,可以作为L929细胞的三维培养支架,使细胞保持较高的活性和增殖能力。Zhang等[63]将磁响应光子晶体(Fe3O4@SiO2)集成到明胶水凝胶中,制备出了具有磁性和光热控制自愈能力的仿生结构水凝胶。由于Fe3O4纳米粒子在近红外(NIR)辐射和外加磁场的作用下会吸收热量,从而刺激水凝胶的交联以达到愈合,使水凝胶具有仿生结构,可应用于3T3细胞培养。
4 结 语
尽管传统水凝胶应用比较广泛,但受损易导致破裂,影响网络结构的完整性,从而缩短使用寿命。近年来,随着在该领域研究的扩展和深入,自愈水凝胶的开发在生物医学研究中受到广泛关注。目前,通过动态可逆交联方式制备的水凝胶往往具有自愈特性。随着对水凝胶的硬度和强度等力学性能需求的增加,通过单一的物理交联或者化学交联制备的自愈水凝胶均难以满足实际应用需求。因此,通过多种机制的协同作用来制备高强高韧的自愈水凝胶将成为未来的发展趋势。其中,双网络水凝胶、纳米复合水凝胶的出现,为自愈水凝胶的制备及应用研究开辟了一条新的途径。总之,自愈水凝胶材料的研究尚处于起步阶段,大部分自愈水凝胶仍存在力学性能差和响应性功能弱等缺点,这些问题的解决将极大推动自愈水凝胶在生物医学中的研究和应用。