CD4阴性CD8弱阳性的罕见表型T幼稚淋巴细胞白血病伴肝转移1例*
杨冬梅,张兴莹,邢 艳
1.四川省宜宾市第二人民医院检验科,四川宜宾 644000;2.四川省宜宾市第二人民医院临床医学研究与转化中心,四川宜宾 644000;3.川北医学院医学检验系,四川南充 637000
T幼稚淋巴细胞白血病(T-PLL)是一种罕见且侵袭性极强的T细胞淋巴瘤,其临床表现多变,恶性程度高,给患者带来生命危害。异常T淋巴细胞的免疫表型识别和T淋巴细胞受体(TCR)重排检测是诊断T-PLL的关键,常见的免疫表型主要表达CD2、CD3、CD5、CD7、CD4、TCRα/β等T淋巴细胞标记。CD4阴性CD8弱阳性(CD4-/CD8dim)异常免疫表型的T-PLL极为罕见,本研究就宜宾市第二人民医院(以下简称“本院”)血液科收治1例罕见免疫表型T-PLL伴肝转移的患者并结合文献复习该患者的临床特征和诊疗特点,现报道如下。
1 临床资料
患者,女,65岁,因“反复心累、乏力1个月,白细胞异常升高4 d”入院。查体:颌下、颈部、腋窝、腹股沟均可触及肿大淋巴结,最大2 cm×2 cm,最小0.5 cm×0.5 cm,质硬,活动度尚可。可触及肿大肝脏,约肋下2 cm,质硬,无压痛,可触及肿大脾脏,Ⅱ度肿大。入院后实验室检查:白细胞计数为101.8×109/L,淋巴细胞计数为81.9×109L,血红蛋白为109.0 g/L,血小板计数为126.0×109/L,糖类抗原(CA)125为514.2 U/mL。头颈、胸腹部CT平扫+增强显示,双侧颈部多发淋巴结肿大,大者横径约1.1 cm。双肺门区及纵隔内、双侧腋窝多发淋巴结肿大,大者短径约1.8 cm;肝脾增大;肝门区、肝胃间隙、腹膜后、肠系膜和双侧腹股沟多发淋巴结,部分肿大。骨髓细胞学检查结果见图1。
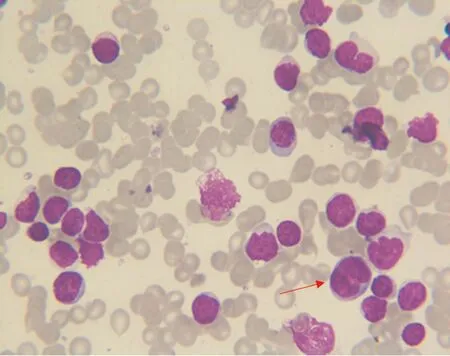
注:箭头所指为异常细胞。
淋巴细胞异常增多,占88.50%,形态学特点:胞体大小不一,形态多变;核染色质较粗糙,凹凸不平,核仁隐约可见;胞浆偏蓝,边缘不齐明显,疑似为淋巴瘤细胞。骨髓免疫组织化学染色显示:CD20(-)、CD19(-)、CD5(部分+)、CD10(-)、B淋巴细胞瘤(Bcl)-2(-)、CD2(+)、CD3(广泛+)、CD4(-)、CD8(-)、CD7(-)、CD56(-)、CD16(-)、CD25(-)、CD34(-)、末端脱氧核苷酸转移酶(TDT,-)、Ki-67(-),考虑T细胞-慢性淋巴细胞白血病(T-CLL)可能。外周血流式细胞免疫分型显示,淋巴区域细胞约占有核细胞的95%,前向散射光(FSC)小,其中查见约86%的异常细胞群,主要表达 CD2、CD7、CD38、TCRα/β、CD8dim、CD5dim、sCD3(bri)、cCD3,不表达CD1a、CD4、CD34。考虑T-PLL(表型非典型PLL)可能。见图2。细胞遗传学结果显示,47,X,-,+3,t(6;14)(q25;q11.2),der(21)t(1;21)(q21;p11.2),+mar[10]/46,XX[10];CEP17 位点信号扩增,比例约为37%。分子遗传学结果显示,TP53基因外显子4上检测到一个错义变异:c.215C>G;p.Pro72Arg(杂合),多态性位点(rs1042522)。肝脏穿刺取活检1粒,免疫组织化学染色显示,CD3(+)、CD2(+)、CD43(+)、CK(-)、CD20(-)、CD79a(-)、CD5(-)、CD4(-)、CD10(-)、CD8(部分+)、Bcl-2(部分弱+)、CD23(-)、细胞周期素D1(-)、GrB(-)、细胞毒颗粒蛋白(TIA-1,-)、Ki-67(+,约60%),结果支持肝脏可查见T淋巴瘤细胞。见图3。
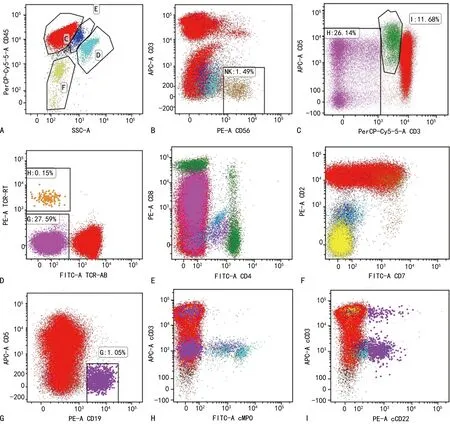
注:A为CD45/SSC设门,红色为异常淋巴细胞群;B为部分表达Scd3(B);C、D为CD5dim和TCRα/β(+);E为CD4(-)和CD8dim;F为CD7(+)和CD2(+);G为CD5dim和CD19(-);H、I为Ccd3(+)。
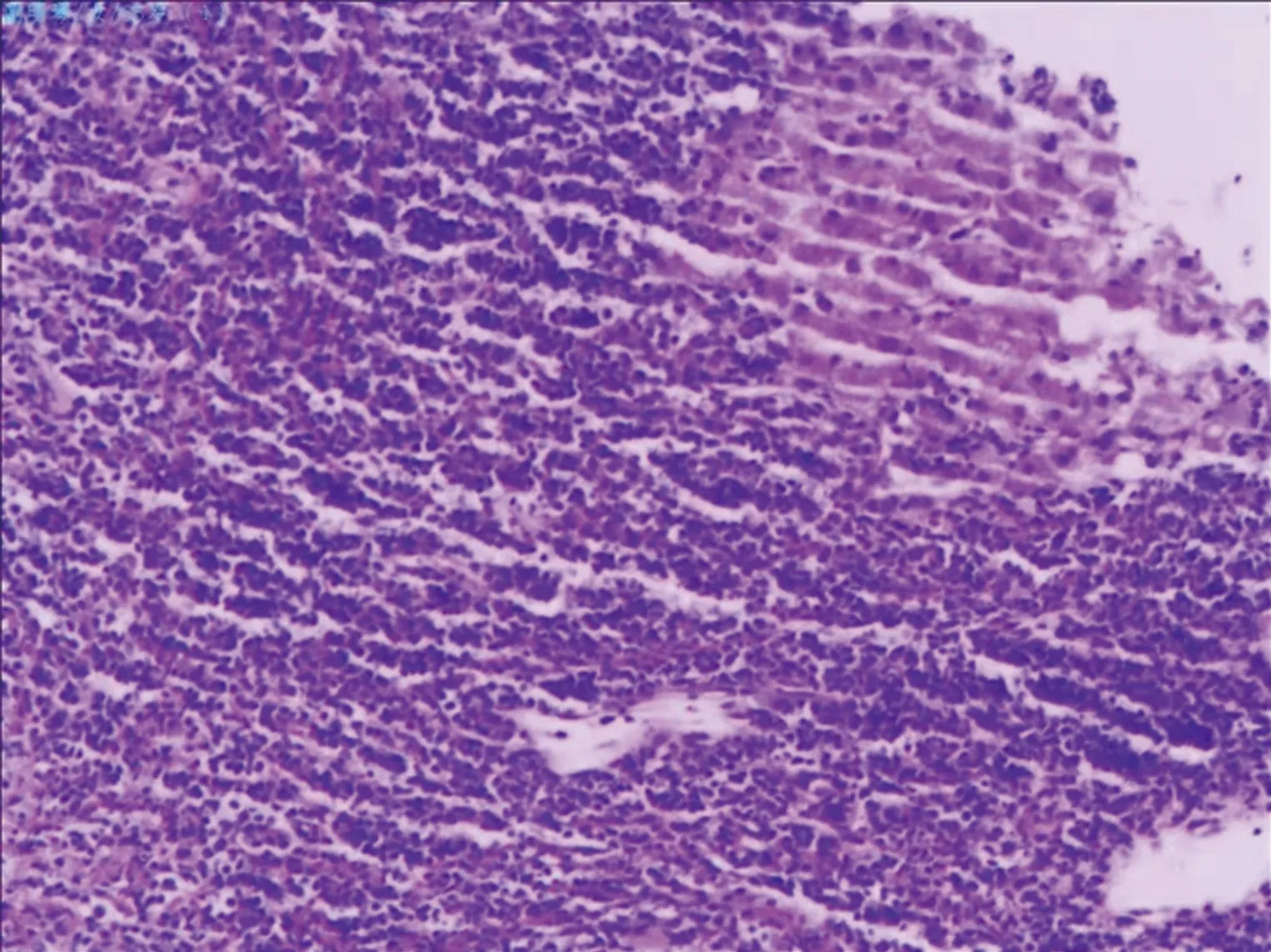
图3 肝脏免疫组织化学染色(×400)
综合诊断:该T-PLL患者年龄大,入院一般情况较差,感染较严重,治疗前予以VP方案(长春瑞滨30 mg+地塞米松15 mg)化疗减轻肿瘤负荷,同时予以抗感染及其他对症支持治疗。化疗期间患者全身感染加重,发生感染性休克,全身多器官衰竭,于确诊5 d后死亡。
2 讨 论
T-PLL是一种极为罕见的、侵袭性更强的具有成熟胸腺后T淋巴细胞表型的前淋巴细胞增生为特点的T淋巴细胞肿瘤,该疾病进展快,恶性程度高,中位生存期仅约为19个月[1-2]。T-PLL的诊断依赖于形态学和(或)免疫表型异常的T淋巴细胞的识别,并与分子遗传学异常相关。由于目前可用的T淋巴细胞克隆分析的重叠及T淋巴细胞肿瘤诊断特征的局限,T-PLL的诊断具有挑战性。
根据国际T-PLL小组提出的专家共识[3],如果满足所有3个主要标准或满足2个主要标准和1个次要标准,则可以对T-PLL进行诊断。主要标准:(1)外周血或骨髓中至少存在5×109/L表型T-PLL细胞;(2)T淋巴细胞克隆性异常;(3)14q32或Xq28异常或T淋巴细胞白血病/淋巴瘤1A(TCL1A)或成熟T淋巴细胞增殖1(MTCP1)基因表达。次要标准:(1)11号染色体异常(11q22.3;ATM);(2)8号染色体异常,idic(8)(p11)、t(8;8)或8q三体;(3)5、12、13、22体异常或复杂核型;(4)涉及T-PLL特异性部位的疾病(如脾肿大)。在WHO分类的第五版[2]中,提出了3个基本标准,包括:(1)外周血或骨髓中淋巴细胞增多大于5×109/L的T-PLL免疫表型;(2)T淋巴细胞单克隆性;(3)TCL1A或MTCP1重排,或TCL1A蛋白表达,本案例符合二者推荐的诊断标准。有研究表明,T-PLL的典型特征主要为脾肿大(73%~81%)、B型症状(66%)、淋巴结肿大(46%~64%)、外周血白细胞显著增多及皮肤受累[4-5](25%)。本案例中白细胞计数高达101.8×109/L,且肝、脾肿大明显,与其大致相符,但需要与肝脾T淋巴瘤(HSTCL)相鉴别。HSTCL主要发于青年男性,由于肿瘤细胞主要分布于淋巴结外,尤其是肝、脾及骨髓的窦内浸润,因此以肝脾肿大、外周血细胞减少为主要表现。
流式细胞术免疫表型分析是诊断T-PLL的重要工具。典型的免疫表型为TCRα/β+/CD2+/CD3+/CD5+/CD7+/CD26+/CD52+,而CD1a和TdT均为阴性。CD4和CD8表达可变是导致T-PLL判断的难点,大多数是CD4+/CD8-(38%~74%)或CD4+/CD8+(17%~41%),极少数是CD4-/CD8+(13%~17%)和CD4-/CD8-(1%~8%)的T-PLL[6]。本案例患者骨髓免疫组织化学表现为CD4/CD8双阴性免疫表型,流式细胞分析提示CD4-/CD8dim。考虑到脾脏穿刺出血风险较大,因而选择肝脏穿刺病检,免疫组织化学提示CD4-/CD8(部分+),这与骨髓流式细胞术检测结果相符,提示肿瘤溯源一致,这种CD4-/CD8dim的T-PLL极为罕见。TCR基因的克隆性重排是T-PLL常见的遗传学异常,其中以TCL1重排(80%)最为常见,是T-PLL相对特异性的诊断标记,常发生在14号染色体(90%)。本案例未完善TCL1基因重排检测,这也是本案例确诊的难点。此外,有研究指出髓细胞组织增生基因表达增加和共济失调性毛细血管扩张症突变基因缺失也与T-PLL发病有关[7-8]。
T-PLL治疗上提倡使用抗CD52单抗,总缓解率约为75%,2/3的患者得到缓解[9-10]。有研究表明异基因造血细胞移植(HCT)对T-PLL可产生持久缓解,特别是能达到完全缓解或至少达到部分缓解[11-12]。同种异体-HCT后的3年无进展生存期和总生存期分别为26%和36%。未来需要更多的病例报告来建立T-PLL表型的模式,这将有利于更好地理解和诊疗T-PLL。

