长链非编码RNA-GAS5竞争性结合miR-10调控SiHa细胞的增殖、迁移及侵袭能力的影响*
王阳阳,刘 耘,杨红梅,董仙萍,刘桂艳△
1.河北省唐山中心医院妇科,河北唐山 067000;2.河北省开滦总医院妇科,河北唐山 067000;3.河北省唐山市妇幼保健院妇科,河北唐山 067000
宫颈癌是女性常见恶性肿瘤之一[1-2],相关研究已证实人乳头瘤病毒(HPV)是宫颈癌的主要病因[3-4],其中淋巴结转移是影响及限制宫颈癌患者生存率的主要问题[5],所以深入了解宫颈癌的发病机制,将有助于确定该疾病新的治疗及预后靶点。长链非编码RNA(lncRNA)是一类不具备编码蛋白功能的RNA,研究证实lncRNA水平异常与多种疾病发展有关[6-7],有研究显示, 在宫颈癌患者中,lncRNA小核RNA宿主基因1(SNHG1)在宫颈癌组织和宫颈癌细胞系中均呈高水平; LIANG等[8]发现lncRNA分化拮抗非蛋白质编码RNA(DANCR)通过与微小RNA-335-5p(miR-335-5p)竞争结合调控Rho关联含卷曲螺旋结合蛋白激酶1(ROCK1)从而促进宫颈癌的发生及发展。lncRNA-生长停滞特异性转录5(GAS5)是5′TOP RNA。有研究发现lncRNA-GAS5在前列腺癌和乳腺癌中是一个潜在的肿瘤抑制基因[9-10],但lncRNA-GAS5对宫颈癌的影响鲜有报道。因此本研究旨在分析lncRNA-GAS5、微小RNA-10(miR-10)及靶基因的相互关系,观察三者对宫颈癌细胞生物学行为的影响,初步探究lncRNA-GAS5在宫颈癌病理过程中的作用。现将结果报道如下。
1 资料与方法
1.1一般资料 选取2021年1月至2022年1月在河北省唐山中心医院接受手术治疗的48例宫颈癌手术患者作为研究对象,平均年龄为(51.16±14.26)岁。纳入标准:所有患者术前均未进行化学治疗;接受宫颈癌手术。排除标准:临床资料不全者。所有患者或家属均签署知情同意书,本研究通过河北省唐山中心医院医学伦理委员会批准。
1.2方法
1.2.1细胞培养、转染及分组 收集所有研究对象的肿瘤样本和癌旁正常组织样本置于-80 ℃环境中保存,提取人宫颈癌细胞株。将人子宫颈鳞癌(SiHa)细胞保存在含10%胎牛血清(FBS)、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养基中,在37 ℃含5% CO2的环境中培养。转染前24 h将SiHa细胞接种到6孔板,按照转染试剂说明书对细胞进行转染。分别将si-NC、lncRNA-GAS5、miR-10、血小板反应蛋白(THBS)2、lncRNA-GAS5+miR-10、lncRNA-GAS5+miR-10+THBS2转染至SiHa细胞,按照转染方式的不同将培养的SiHa细胞分为对照组、GAS5组、miR-10组、THBS2组、GAS5+miR-10组和GAS5+miR-10+THBS2组。
1.2.2实时荧光定量聚合酶链反应(qRT-PCR) 用TRIzol试剂提取细胞、组织中的总RNA, miR-10水平以U6或三磷酸甘油醛(GAPDH)作为内部参照,按照qRT-PCR试剂盒说明书,进行PCR反应。引物序列如下:GAS5正引向引物为5′-GGAAGCTGGATAACAGAGCGA-3′,反向引物为5′-GGTATTCCTTGTAATGGGACCAC-3′;miR-10正向引物为5′-AGCTGTACAAGTAAGGTGGCTCAGAGGAAGA GATT-3′,反向引物为5′-GGGAGAGGGGCTTAGGAACGAGGCGGCTGACCA-3′;U6正向引物为5′-CTCGCTTCGGCAGCACA-3′,反向引物为5′-AAC GCTTCACGAATTTGCGT-3′;GAPDH正向引物为5′-AATGGGCAGCCGTTAGGAAA-3′,反向引物为5′-GCGCCCAAT ACGACCAAATC-3′。
1.2.3免疫组化 将肿瘤石蜡组织切片并置于65 ℃环境中进行烤片,梯度脱蜡、水化。将切片置于柠檬酸盐抗原修复液中,进行抗原修复。加入5%的正常羊血清封闭15 min。 加入THBS2抗体(1∶800),置于4 ℃环境中过夜。加入辣根过氧化物酶标记的兔二抗,于37 ℃环境中孵育30 min。 采用二氨基联苯胺(DAB)显色后,以苏木精室温染色2 min,进行脱水和中性树脂封片,置于显微镜中观察切片。
1.2.4数据库预测 采用Starbase数据库预测lncRNA-GAS5和miR-10的结合位点(https://starbase.sysu.edu.cn/)及TargetScan数据库预测miR-10和THBS2的结合位点。 (http://www.targetscan.org/vert_71/)。
1.2.5双荧光素酶报告基因实验 构建lncRNA-GAS5野生型质粒PMIR-GAS5-WT和突变型质粒PMIR-GAS5-MUT,THBS2野生型质粒PMIR-THBS2-WT和突变型质粒PMIR-THBS2-MUT。将lncRNA-GAS5野生型/突变型质粒与miR-NC和miR-10共转染进SiHa细胞。将THBS2野生型/突变型质粒与miR-NC和miR-10共转染进SiHa细胞。转染24 h后,检测各组细胞中的荧光素酶活性。
1.2.6CCK8实验 转染24 h后,收集各组SiHa细胞接种于96孔板。随后每孔加入10 μL CCK-8溶液,黑暗中孵育2 h后,用酶标仪测定450 nm波长的吸光度(A)。
1.2.7transwell实验 将处于对数生长期的各组SiHa细胞调整浓度后按4×105/孔分别接种于6孔板。培养1晚后,分别转染对照组、GAS5组、miR-10组、THBS2组、GAS5+miR-10组及GAS5+miR-10+THBS2组的SiHa细胞,再置于37 ℃含5% CO2的培养箱中培养48 h。将细胞培养液换成不完全培养液饥饿12 h,使胰酶消化细胞,采用磷酸缓冲盐(PBS)缓冲液洗涤3次,计数并用不完全DMEM培养基稀释细胞,调整密度为1×106/mL。取24孔板,下室加入650 μL含10%FBS的DMEM完全培养液,用镊子放入8 μm膜孔径的transwell小室,在每孔上室加入200 μL细胞悬液,置于37 ℃含5% CO2的培养箱中培养24 h。从培养板中取出transwell小室,吸出液体,用干净的湿棉签擦净小室内膜上的细胞,不要碰到下层细胞。采用PBS缓冲液洗涤小室2遍后,浸入无水乙醇中放置0.5 h。用PBS缓冲液漂洗后将小室反扣于吸水纸上,室温干燥基底膜。配制结晶紫染液:取结晶紫0.05 g溶于甲醇制成0.5%的结晶紫溶液,用PBS溶液按照1∶5的比例稀释成0.1%的结晶紫染液。用结晶紫染色20 min,PBS缓冲液漂洗2遍,晾干。于倒置显微镜下对非细胞接种侧拍照。

2 结 果
2.1宫颈癌组织和癌旁正常组织的lncRNA-GAS5、miR-10和THBS2的表达水平比较 宫颈癌组织的miR-10表达水平高于癌旁正常组织(2.45±0.21vs.1.00±0.09,t=10.99,P<0.05),而宫颈癌组织的lncRNA-GAS5表达水平低于癌旁正常组织(0.34±0.03vs.1.00±0.08,t=-13.38,P<0.05)。宫颈癌组织中THBS2表达水平低于癌旁正常组织(1.00±0.11vs.3.56±0.42,t=-10.21,P<0.05)。
2.2lncRNA-GAS5、miR-10和THBS2调控的关系 将lncRNA-GAS5过表达质粒转染进SiHa细胞后,GAS5组miR-10表达水平较对照组明显升高 (11.02±1.95vs.1.00±0.08,t=12.576,P<0.05),转染miR-10后miR-10组的SiHa细胞中miR-10表达水平比转染前高(10.33±1.89vs.0.99±0.09,t=12.091,P<0.05)。
经Starbase和TargetScan数据库预测结果发现lncRNA-GAS5的3′-UTR有miR-10的结合位点, miR-10在THBS2的3′-UTR上具有潜在的结合位点,见图1。相比对照组,miR-10组PMIR-GAS5-WT及PMIR-THBS2-WT野生型质粒荧光素酶活性明显降低(29.12±3.34vs. 13.51±1.64,t=10.276,P<0.05;27.13±2.78vs. 12.13±1.43,t=11.753,P<0.05),但miR-10组的PMIR-GAS5-WUT及PMIR-THBS2-WUT突变型质粒的荧光素酶活性均无明显变化(29.54±3.65vs. 27.98±2.87,P>0.05;26.65±5.45vs. 25.14±4.76,P>0.05)。

图1 lncRNA-GAS5、miR-10、THBS2结合位点图
2.3lncRNA-GAS5和THBS2对SiHa细胞增殖、迁移的影响 相比对照组,GAS5组和THBS2组SiHa细胞的A及侵袭细胞数降低,而miR-10组SiHa细胞的A及侵袭细胞数升高,差异均有统计学意义(P<0.05);相比miR-10组,GAS5+miR-10组SiHa细胞的A和细胞迁移细胞数降低,差异均有统计学意义(P<0.05);相比GAS5+miR-10组,GAS5+miR-10+THBS2组SiHa细胞的A和细胞迁移细胞数降低,差异均有统计学意义(P<0.05)。见表1,图2。

表1 lncRNA-GAS5和THBS2对SiHa细胞增殖、迁移的影响
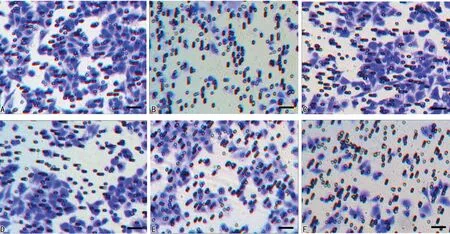
注:A为对照组;B为GAS5组;C为miR-10组;D为THBS2组;E为GAS5+miR-10组;F为GAS5+miR-10+THBS2组。
3 讨 论
近年来,lncRNA已成为基因调控网络的关键组成部分,lncRNA 通过与非编码基因和编码基因相互作用来调控疾病的发病机制,其中lncRNA-GAS5通过与糖皮质激素受体域结合而诱导细胞凋亡,在癌症研究领域中受到越来越多的关注[11]。目前有研究发现在乳腺癌、肾细胞癌、膀胱癌、前列腺癌和胰腺癌等癌症中,观察到lncRNA-GAS5水平异常下降[12]。本研究结果表明,宫颈癌组织的lncRNA-GAS5表达水平低于癌旁正常组织(P<0.05)。
近年来关于lncRNA作用机制的相关研究发现lncRNA表达失调已被证明与多种癌症的发展相关[13],lncRNA可以与微小核糖核酸(miRNA)相互作用影响miRNA的靶基因发挥相关生物学功能。竞争性内源性RNA(ceRNA)假说表明,在ceRNA的作用网络中lncRNA通过自身携带的MREs与miRNA的下游靶基因的信使RNA(mRNA)竞争结合miRNA发挥调控作用,当lncRNA吸附结合某个miRNA后,就能够将该miRNA所靶向的mRNA释放出来,编码蛋白质发挥生物学效应,此时的lncRNA与mRNA即可称为一对ceRNA,此揭示了一种RNA间相互作用的新机制[14]。为了探究lncRNA-GAS5在宫颈癌中的作用,本研究发现lncRNA-GAS5的3′-UTR有miR-10的结合位点, miR-10在THBS2的3′-UTR上具有潜在的结合位点,这提示THBS2是miR-10的靶基因。本研究通过免疫组化发现宫颈癌组织中THBS2水平低于癌旁正常组织(P<0.05),提示THBS2具有抑制宫颈癌的功能。WU等[15]研究发现,在SiHa中,THBS2表达水平下降,并且过表达THBS2可以抑制miR-221-3p血管生成功能,这与本研究结果相符。
本研究发现,相比对照组,miR-10组PMIR-GAS5-WT及PMIR-THBS2-WT野生型质粒荧光素酶活性明显降低(P<0.05),但miR-10组PMIR-GAS5-WUT及PMIR-THBS2-WUT突变型质粒的荧光素酶活性均无明显变化(P>0.05)。表明lncRNA-GAS5、miR-10、miR-10及THBS2均存在靶向结合关系。
本研究通过进一步细胞实验探究GAS5+miR-10+THBS2信号轴对于宫颈癌SiHa细胞生物学行为的影响发现,相比对照组,GAS5组和THBS2组SiHa细胞的A及侵袭细胞数降低,而miR-10组SiHa细胞的A及侵袭细胞数升高;但相比miR-10组,GAS5+miR-10组SiHa细胞的A和细胞迁移细胞数降低;相比GAS5+miR-10组,GAS5+miR-10+THBS2组SiHa细胞的A和细胞迁移细胞数降低,差异均有统计学意义(P<0.05)。这说明上调lncRNA-GAS5的表达水平能抑制细胞的增殖、迁移和侵袭,而miR-10恢复了这种抑制效果。同时,THBS2逆转了miR-10的促进增殖、迁移能力。
综上所述,lncRNA-GAS5的异常表达可能和宫颈癌有关,lncRNA-GAS5通过抑制miR-10上调THBS2的表达水平从而抑制宫颈癌细胞的增殖、迁移和侵袭。

