早期妊娠丢失患者蜕膜组织中血管重塑相关miRNA及其靶基因表达的研究
俞田田 洪丽华 张颖 陆海茜 范建霞
早期妊娠丢失(early pregnancy loss,EPL)是人类生殖中最常见的并发症,定义为妊娠12 周末以前发生的流产[1]。EPL 的病因和发病机制复杂,涉及多方面因素。已知的病因包括胚胎染色体异常、母体生殖道解剖学异常、内分泌紊乱、创伤、感染、遗传学、免疫功能障碍和父亲遗传异常(父系异常)。此外,环境危险因素如咖啡因、酒精、吸烟也影响EPL 的发病率[1-2]。
miRNA 是一类在真核细胞中发现的约为22 个核苷酸的非编码内源性RNA 分子,通过直接结合mRNA靶点的3'非翻译区(3'-untranslated region,3'-UTR)参与转录后基因调控[3-4]。近年来,越来越多的研究表明miRNA 在妊娠过程中发挥重要作用,并发现miRNA 在复发性流产中的异常表达[5-6]。随着基因芯片技术的应用,越来越多的miRNA 被鉴定出来,它们不仅参与调节胚胎着床期上皮细胞的增殖和分化,还参与调节妊娠早期子宫内膜蜕膜化和胎盘发育[7-9],miRNA 可通过调控相应的靶基因影响蜕膜血管生成,并进一步影响滋养层细胞黏附和侵袭蜕膜的过程[10]。笔者团队前期采用miRNA 芯片筛选EPL 蜕膜组织中的差异表达miRNA,发现3 种与血管重塑相关的miRNA(miR-125a-5p、miR-29c-3p 和miR-193a-5p)在EPL 患者蜕膜组织中表达上调[11]。生物信息学分析表明,血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)和基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)是这3 个miRNA 的靶基因[12]。本研究旨在定量分析EPL 患者蜕膜组织中miRNA 的表达水平,确定差异表达的miRNA,并采用qRT-PCR 和Western blot 法验证差异表达miRNA 的相关靶基因,从而揭示miRNA 与导致流产因素之间的相关性。
1 对象和方法
1.1 对象 选取2020 年10 至12 月在上海交通大学医学院附属国际和平妇幼保健院门诊手术室行早孕人工流产手术的患者40 例为研究对象,其中因EPL 行人工流产手术者20 例(EPL 组),正常早孕要求终止妊娠行人工流产者20 例(对照组)。EPL 组和对照组纳入及排除标准同已发表文献[13]。收集每例患者废弃的流产蜕膜组织,浸于PBS 中清洗血迹,一部分(EPL 组和对照组各4 例)放入冻存管中,-80 ℃冰箱保存待蛋白提取;另一部分(EPL 组和对照组各16 例)放入含有1 mL RNAiso Plus 的冻存管中,-80 ℃冰箱保存待RNA 提取。本研究经上海交通大学医学院附属国际和平妇幼保健院医学伦理委员会审查通过[批准文号:(GKLW)2019-20],所有患者或其家属均签署知情同意书。
1.2 主要试剂及仪器 RNAiso Plus(日本TaKaRa 公司,货号:9109);反转录试剂盒(日本ToYoBo 公司,货号:FSQ-101);哺乳动物细胞miRNA 荧光报告质粒(pMIR-Report Luciferase,美国Promega 公司);pRL-TK Renilla 报告质粒(美国Promega 公司);鼠抗人甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体(武汉三鹰生物技术有限公司,货号:60004-1-Ig);鼠抗人MMP-2 多克隆抗体(武汉三鹰生物技术有限公司,货号:66366-1-Ig);兔抗人VEGFA 多克隆抗体(武汉三鹰生物技术有限公司,货号:19003-1-AP);山羊抗鼠IgG(H+L)二抗(美国Invitrogen 公司,货号:C31430100);山羊抗免IgG(H+L)二抗(美国Invitrogen 公司,货号:C31460100);实时荧光定量PCR 仪(瑞士Roche公司,型号:LightCycler480 II)。
1.3 细胞系 原代人胚肾细胞转染5 型腺病毒DNA得到的永生化细胞HEK 293 细胞系由浙江大学医学院免疫学研究所王青青教授实验室馈赠。
1.4 蜕膜组织中与血管重塑相关的差异表达miRNA检测 采用qRT-PCR 法。根据RNAiso Plus 试剂盒的说明书准备RNA 样品。按步骤提取两组患者蜕膜组织标本中RNA,并使用NanoDrop2000 进行浓度和纯度测定, 保存于-80 ℃冰箱待用。按照反转录试剂盒说明书将提取的RNA 反转录合成cDNA,立即放于冰上冷却待用。所得cDNA 用作定量PCR 的模板,在实时荧光定量PCR 仪上进行扩增。构建10 μL 的PCR 反应体系。PCR 反应条件:95 ℃预变性5 min,95 ℃变性10 s,60 ℃退火20 s,72 ℃延伸20 s,共40 个循环。以U6 为miRNA 相对表达水平的内参,GAPDH 作为靶基因的相对表达水平的内参,采用2-ΔΔCt法计算目的基因表达水平。采用的引物由上海生工生物公司合成,miRNA 反转录引物见表1,PCR 引物序列见表2。
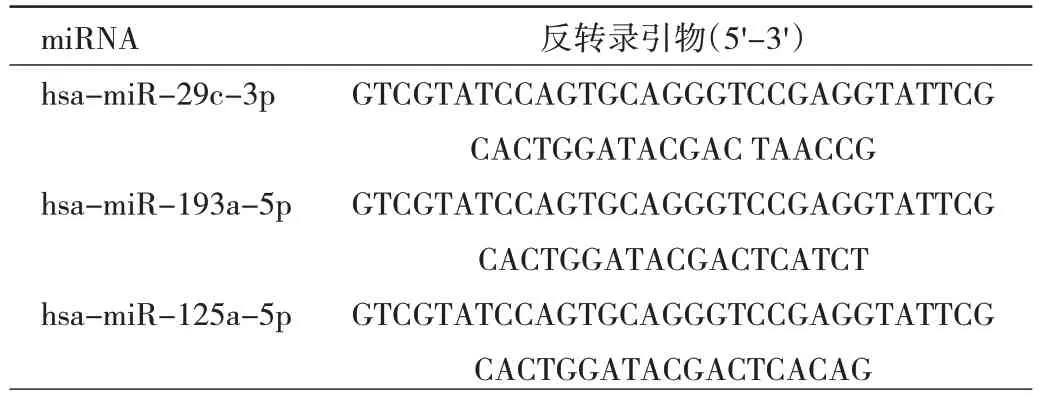
表1 miRNA 反转录引物
1.5 3'-UTR 报告基因检测 通过扩增人VEGFA 和MMP-2 mRNA 3'-UTR 并将其克隆到pMIR-REPORT荧光素酶报告基因质粒载体上,构建野生型人VEGFA和MMP-2 3'-UTR 荧光素酶报告载体。用荧光素酶报告质粒、pRL-TK Renilla 报告质粒和miRNA 模拟物(终浓度20 nmol/L)共转染HEK 293 细胞。生长24 h 后,收集细胞,按照美国Promega 公司生产商的说明书,以海肾荧光素酶作为参照,检测荧光素酶的活性。
1.6 蜕膜组织VEGFA 和MMP-2 蛋白表达水平检测采用Western blot 法。收集新鲜流产蜕膜组织,以RIPA裂解液(使用前数分钟内加入1%蛋白酶抑制剂)充分裂解后设置匀浆程序进行匀浆,提取蜕膜组织总蛋白,冰浴30 min裂解混匀,12 000 r/min,4 ℃离心20 min,上清液采用BCA 法蛋白定量,SDS-PAGE 分离蛋白质,之后转膜到聚偏二氟乙烯膜上(使用前先用甲醇活化5 min),室温下5%脱脂奶粉封闭1 h 后,加入VEGFA、MMP-2 及GAPDH 一抗(1∶1 000 稀释)4 ℃摇床孵育过夜,TBST 洗膜3 次,加入HRP 标记二抗(1∶5 000 稀释)摇床室温孵育1 h,TBST 洗膜3 次,增强化学发光法显影,使用Image J 软件计算各个蛋白条带的灰度值,内参为GAPDH。
1.7 统计学处理 采用GraphPad Prism 9.0 统计软件。符合正态分布的计量资料组间比较采用两独立样本t检验,不符合正态分布的计量资料组间比较采用Mann-WhitneyU检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者蜕膜组织中血管重塑相关的3 个miRNA 表达水平比较 与对照组比较,EPL 组患者蜕膜组织中miR-29c-3p、miR-193a-5p和miR-125a-5p表达水平均升高,差异均有统计学意义(均P<0.05),见图1。

图1 两组患者蜕膜组织中miRNA 相对表达水平比较
2.2 荧光素酶报告基因分析 笔者先前的研究中,miRNA 靶基因预测软件显示VEGFA 是miR-29c-3p 和miR-125a-5p 的靶基因(图2A),MMP-2 是miR-29c-3p、miR-125a-5p 和miR-193a-5p 的共同靶基因(图2B)[12]。为了证实先前的发现,将目标基因(VEGFA 和MMP-2)的3'-UTR 序列克隆到荧光素酶报告载体中。将构建的报告质粒与miRNA 模拟物共转染HEK 293细胞,检测荧光素酶活性。结果表明,miR-29c-3p 和miR-125a-5p 模拟物能显著抑制VEGFA 3'-UTR 报告质粒的荧光素酶活性,但miR-29c-3p 或miR-125a-5p模拟物不影响空质粒,见图3A。同理miR-29c-3p、miR-125a-5p 和miR-193a-5p 模拟物能显著抑制MMP-2 3'-UTR 报告质粒的荧光素酶活性,但不影响空质粒,见图3B。

图2 差异表达miRNA 与预测靶基因VEGFA、MMP-2 的3'-UTR 结合序列(A:差异表达miR-29c-3p、miR-125a-5p 与预测靶基因VEGFA 的3'-UTR 结合序列;B:差异表达miR-29c-3p、miR-125a-5p、miR-193a-5p 与预测靶基因MMP-2 的3'-UTR 结合序列)

图3 差异表达miRNA 对预测靶基因VEGFA 和MMP-2 的靶向作用
2.3 两组患者蜕膜组织中VEGFA 和MMP-2 mRNA 和蛋白表达水平比较 qRT-PCR 法检测发现,与对照组比较,EPL 组患者蜕膜组织中VEGFA 和MMP-2 mRNA表达水平均降低(均P<0.05),见图4。Western blot 法检测发现,与对照组比较,EPL 组蜕膜组织中VEGFA和MMP-2 蛋白表达水平均降低(均P<0.05),见图5。

图4 两组患者蜕膜组织中VEGFA 和MMP-2 mRNA 表达水平比较
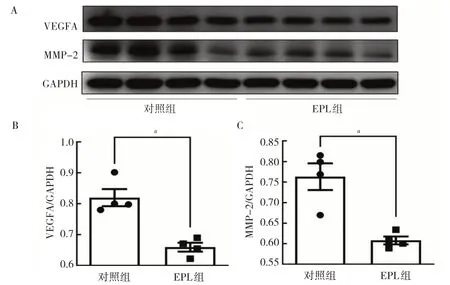
图5 两组患者蜕膜组织中VEGFA 和MMP-2 蛋白表达水平比较(A:两组患者蜕膜组织中VEGFA 和MMP-2 蛋白表达的电泳图;B:两组患者蜕膜组织中VEGFA 蛋白表达水平比较;C:两组患者蜕膜组织中MMP-2 蛋白表达水平比较)
3 讨论
EPL 是人类生殖过程中最常见的并发症,给育龄期女性造成巨大压力和身心创伤,导致其抑郁、焦虑和自尊心下降等。尽管疾病相关基因组分析已经证实了在妊娠失败患者中有大量差异基因的表达,但自然流产的机制仍不清楚。蜕膜作为母胎界面“胚胎孕育”的“土壤”,对胚胎着床、妊娠建立与维持起着极为重要的作用。母体来源的蜕膜细胞与胚胎来源的滋养细胞通过细胞因子交流对话、协调互作完成母胎界面重塑进程,并且蜕膜细胞的生理活动以这种方式在滋养细胞的调控下有序地发育、成熟或凋亡。越来越多的证据表明,蜕膜血管生成和子宫螺旋动脉重塑对成功妊娠至关重要,早期血管生成过程中蜕膜血管发育受损以及子宫肌层螺旋动脉重塑异常导致复发性流产[14-15]。
VEGF 是一种高度特异性的促血管内皮生长因子,促进血管通透性的增加、血管内皮细胞的迁移、增殖以及血管再生[16]。在啮齿类动物中,VEGFA 是参与胎儿和胎盘血管生成、胚胎着床和发育以及蜕膜化的关键因子[17]。有研究表明复发性流产患者绒毛和蜕膜组织中缝隙连接蛋白和VEGF mRNA 和蛋白表达水平均明显低于正常早孕妊娠妇女,表明两者表达的降低可能通过影响胎盘和胚胎的血管生成而促进流产的发生[18]。并且近期研究进一步发现信号转导和转录激活因子3 信号通路及其下游基因如D 型细胞周期蛋白和VEGF 的降低导致绒毛滋养细胞增殖不足,并伴随胎盘和蜕膜的血管生成缺陷,导致早期不明原因的妊娠丢失[19]。MMP-2 是MMP 家族的一员。母胎界面MMP 活性的调节似乎对成功着床和胎盘形成至关重要[20]。多项研究表明,滋养层侵入需要MMP-2 和MMP-9 的合成和活化[21-22]。特别是MMP-2 与滋养层侵入细胞外基质的重塑过程有关[23]。在整个妊娠期间,MMP-2 在蜕膜组织中稳定表达,在子宫内膜蜕膜化、胚胎侵袭和血管生成中起重要作用[24-25]。近期有研究表明在不明原因复发性流产患者绒毛组织中,miR-125a-5p 的表达上调可能抑制其靶基因MMP-2的正常表达,从而导致胚胎黏附和植入能力下降、胚胎侵入子宫蜕膜能力受损,导致流产发生[26]。
本研究进行了qRT-PCR,证实与血管重塑相关的miR-29c-3p、miR-193a-5p 和miR-125a-5p 在EPL 患者蜕膜组织中表达上调。差异表达miR-29c-3p、miR-193a-5p 和miR-125a-5p 靶向VEGFA 和MMP-2。qRT-PCR 和Western blot 结果显示,EPL 组患者蜕膜组织中VEGFA 和MMP-2 mRNA 和蛋白表达水平均低于对照组,提示上调的miRNA 可能通过转录后调节途径下调VEGFA 和MMP-2 的表达,使两个在血管生成和胎盘形成过程中的重要蛋白表达减少,导致子宫内膜蜕膜化不良、胚胎浅着床、胎盘血管形成受阻,最终导致流产发生。此外,荧光素酶报告基因分析证实了miRNA 表达水平(miR-29c-3p、miR-125a-5p 和miR-193a-5p)与其靶基因(VEGFA 和MMP-2)之间的负相关性。这些差异表达的miRNA 与其靶基因密切相关,通过下调靶基因VEGFA 和MMP-2 参与调控早孕蜕膜组织的功能,在EPL 的发生中起着重要作用。
综上所述,在早期妊娠蜕膜组织中,与血管重塑相关的3 个差异表达miRNA(miR-29c-3p、miR-125a-5p、miR-193a-5p)可能通过下调靶基因VEGFA 和MMP-2参与EPL 的发生、发展。本研究主要探讨miRNA 与早期妊娠维持及自然流产的潜在关系,而这3 种miRNA参与EPL的确切机制还有待进一步深入研究。

