Nrf2 调控PI3K/Akt 信号通路促进肺腺癌进展的机制研究
孙定周 张鑫 朱洁晨 朱述阳
肺癌是全球范围内危害人类健康的常见肿瘤之一,其发病率和病死率均位于恶性肿瘤的首位[1],而腺癌是其最常见的病理类型[2]。目前,手术是早期肺癌患者的首选且最有效的治疗方式。然而,肺癌的早期症状缺乏典型性,部分患者偶可见咳嗽、痰中带血、消瘦等症状,因此大部分患者一经诊断即处于进展期,预后极差。近年来,关于肺癌的基础及临床研究发展迅速,临床治疗理念不断更新,而靶向治疗联合免疫治疗则有可能为进展期肺癌的治疗带来新希望[3]。因此,探究肺癌细胞内分子表达异常的机制及其在肺癌发展中的作用,对肺癌的分子靶向治疗、改善患者预后具有重要意义。核因子E2 相关因子2(nuclear factor E2-related factor 2,Nrf2)是细胞抗氧化反应的主要调节因子,并与DNA 的损伤修复相关,可抑制细胞凋亡[4]。研究发现Nrf2 在多种类型的肿瘤细胞中被异常激活,可促进肿瘤细胞的增殖、迁移、侵袭能力并参与肿瘤细胞对放化疗抵抗的过程[5],表明Nrf2 可能作为一个良好的肿瘤治疗靶标。有研究指出,Nrf2 在肺癌中过表达[6-7],并与肺癌细胞的恶性生物学行为密切相关[8-10],但其作用机制目前尚不清楚。因此,本研究通过探讨Nrf2 对肺腺癌细胞增殖、迁移能力的影响,进一步研究Nrf2 促进肺腺癌进展的可能机制,以期为肺癌的靶向治疗提供理论依据。
1 材料和方法
1.1 材料
1.1.1 组织标本收集 收集2020 年10 月至2021 年10月在徐州医科大学附属医院住院并接受手术治疗的30 例肺腺癌患者的癌组织及癌旁组织标本。所有患者术前均未接受过放化疗,经术后病理检查确诊为肺腺癌。本研究经徐州医科大学附属医院医学伦理委员会审查通过(批准文号:XYFY2022-KL278-01)。
1.1.2 细胞、试剂及仪器 人肺腺癌细胞系A549 细胞购自中科院上海细胞库。FBS(批号:A4766801)、RPMI 1640 培养基(批号:R5158)均购自美国Gibco 公司;Trizol 试剂(批号:15596026)购自美国赛默飞公司;反转录试剂盒(货号:RR014B)、RT-qPCR 试剂盒(货号:RR086B)均购自日本TaKaRa 公司。Nrf2 过表达质粒(vector-Nrf2)及阴性对照质粒(vector)均购自上海吉凯公司;Lipofectamine 2000 转染试剂(批号:C0518)、组织抗原修复液(批号:P0081)、抗体稀释液(批号:P0277)均购自南京碧云天公司;Nrf2 小干扰RNA(small interference RNA,siRNA)序列、Nrf2 引物均购自上海生工公司;Transwell 小室(货号:3422)购自美国康宁公司;5-乙炔基-2'-脱氧尿苷(5-ethynyl-2'-deoxyuridine, EdU)试剂盒购自上海碧云天公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、Nrf2、蛋白激酶B(protein kinase B,Akt)、磷酸化Akt(phosphorylated protein kinase B,p-Akt)、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR) 、磷酸化mTOR(phosphorylated mammalian target of rapamycin,p-mTOR)、B 淋巴细胞瘤-2基因(B-cell lymphoma-2 gene,Bcl-2)、Bcl-2 相关X 蛋白(Bcl-2-associated X,Bax)、E-钙黏蛋白(E-cadherin)抗体均购自武汉三鹰公司(批号分别为:10494-1-AP、16396-1-AP、60203-2-Ig、80455-1-RR、28273-1-AP、67778-1-Ig、26593-1-AP、50599-2-Ig、20874-1-AP);VD-850 型生物超净工作台购自苏州净化设备公司;Olympus IX71 型倒置荧光显微镜购自日本奥林巴斯公司;Mini Protean 3 Cell 型BIO-RAD 电泳-转膜仪购自美国伯乐公司;PHY-型病理漂烘仪购自常州市中威电子仪器厂;LM1235 石蜡切片机购自德国Leica 公司;TSJ-Ⅱ型电脑自动组织脱水机购自常州市中威电子仪器厂;JC101 型电热鼓风干燥箱购自上海成顺仪器仪表有限公司。
1.2 方法
1.2.1 肺腺癌组织及癌旁组织中Nrf2 蛋白表达分布检测 采用免疫组化法。在徐州医科大学附属医院病理科完成组织标本的石蜡包埋、切片(厚度4 μm)过程。切片经过脱蜡、梯度乙醇水化、修复抗原、漂洗后,加入内源性过氧化酶阻断试剂,漂洗后封闭,然后滴加Nrf2 一抗(稀释比例1∶300),室温孵育后漂洗,滴加二抗并孵育,漂洗后DAB 染色、苏木素复染、冲洗。随后将切片梯度脱水,透明并封片,室温下放置约5 d 后用倒置荧光显微镜摄片,随机挑选5 个视野拍摄,使用Image Pro Plus 软件计算图片的累计光密度/区域面积(integral optical density/area,IOD/Area)值。
1.2.2 肺腺癌组织及癌旁组织中Nrf2 mRNA 表达水平检测 采用RT-qPCR法。使用Trizol试剂提取总RNA,按照说明书的实验步骤将mRNA 反转录成cDNA,随后通过RT-qPCR 法检测Nrf2 mRNA 表达水平。采用2-ΔΔCt法评估目的基因Nrf2 的相对表达水平,GAPDH 作为内参基因。引物序列见表1。总反应体系20 μL,其中ddH2O 6.4 μL,SYBR Green 10 μL,cDNA 2.0 μL,正反向引物各0.8 μL。反应条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火1 min,72 ℃延伸10 min,共40 个循环。实验重复3 次。
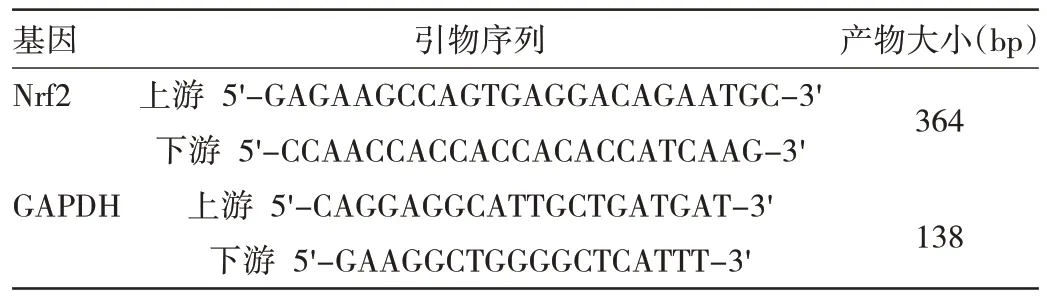
表1 RT-qPCR 引物序列
1.2.3 细胞培养和分组 将A549 细胞培养于含10%FBS、无青链霉素的RPMI 1640 培养基中,在37 ℃、5%CO2细胞培养箱中培养。A549 细胞传代培养至第4代,融合度达到70%时随机分为Nrf2 过表达组(vector-Nrf2 组)、过表达阴性对照组(vector 组)、Nrf2 沉默表达组(si-Nrf2 组)和沉默表达阴性对照组(si-NC组)。使用Lipofectamine 2000 转染试剂将5 μg 的vector-Nrf2、vector 以及siRNA 沉默序列、阴性对照序列分别转染到A549 细胞,转染6 h 后更换培养基,在正常条件下培养24 h 后裂解细胞提取蛋白样本,使用Western blot 法检测转染效果。
1.2.4 细胞迁移能力检测 采用Transwell 法。在转染vector-Nrf2、siRNA 沉默序列的24、48 h 后,消化、重悬A549 细胞并调整密度为1×105/mL,吸取200 μL 重悬液接种在Transwell 上层小室内,并向下层小室中添加800 μL 含有10%FBS 的培养基,37 ℃、5%CO2培养箱中孵育24 h 后取出。吸弃上室中的培养液,医用棉签蘸水后轻柔擦拭上室内侧未迁移的细胞,用PBS 清洗3 次后用4%多聚甲醛固定30 min,0.1%结晶紫染色15 min,双蒸水漂洗干净后倒扣在超净台内风吹晾干,在倒置荧光显微镜下拍照,使用Image J 软件计算迁移至小室底层的细胞数。
1.2.5 细胞增殖能力检测 采用EdU 荧光计数法。重悬A549 细胞并调整密度为1×104/mL,吸取100 μL/孔重悬液接种至96 孔板内培养16 h,按照产品使用说明书进行染色操作。倒置荧光显微镜下分别拍摄同一视野下的红色荧光(EdU 阳性细胞)和蓝色荧光(所有细胞核),使用Image J 软件分别计算红蓝色细胞总数,细胞EdU 阳性率与细胞增殖能力呈正相关关系,通过计算细胞EdU 阳性率检测细胞增殖能力。
1.2.6 细胞及组织标本中Nrf2 及下游磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinase,PI3K)/Akt 信号通路相关蛋白表达水平检测 采用Western blot 法。使用含有蛋白酶抑制剂的RIPA 裂解液提取总蛋白。使用浓度为10%十二烷基硫酸钠-聚丙烯酰胺凝胶进行电泳分离目标蛋白质,然后在湿转槽将蛋白转移到甲醇激活的聚偏二氟乙烯膜,1×Tris 盐缓冲液(tris buffered saline,TBST)洗膜5 min 后将膜浸入3%牛血清白蛋白,室温条件下封闭2 h。使用抗体稀释液将各抗体按照以下比例进行稀释:Nrf2(1∶1 000)、Akt(1∶1 000)、p-Akt(1∶1 000)、mTOR(1∶1 000)、p-mTOR(1∶1 000)、Bcl-2(1∶1 000)、Bax(1∶1 000)、E-cadherin(1∶1 000),在37 ℃下孵育2 h。GAPDH(1∶3 000)作为内参。再次用TBST 洗膜5 min×3 次后,ECL 发光法检测目标蛋白条带,并使用Image J 软件分析条带灰度值。
1.3 统计学处理 采用SPSS 22.0 及GraphPad Prism 9.0 统计软件。计量资料以表示,方差齐时,两组比较采用两独立样本t检验;方差不齐时,两组比较采用Welch'st检验。P<0.05 为差异有统计学意义。
2 结果
2.1 组织观测指标结果
2.1.1 肺腺癌组织和癌旁组织中Nrf2 表达的比较肺腺癌组织中Nrf2 阳性表达,主要位于肺腺癌细胞质,见图1。肺腺癌组织中Nrf2 的IOD/Area 值为0.380±0.040,高于癌旁组织的0.020±0.006,差异有统计学意义(t=5.03,P<0.01)。
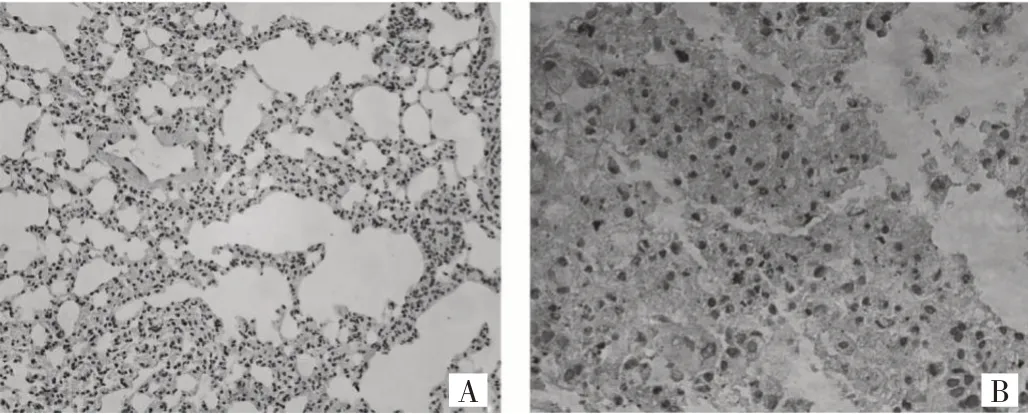
图1 Nrf2 在肺腺癌组织和癌旁组织中的表达(A:Nrf2 在癌旁组织中阴性表达;B:Nrf2 在肺腺癌组织阳性表达)
2.1.2 肺腺癌组织和癌旁组织Nrf2 mRNA 表达水平比较 肺腺癌组织中Nrf2 mRNA 表达水平为2.63±0.07,高于癌旁组织的1.00,差异有统计学意义(t=40.33,P<0.01)。
2.1.3 肺腺癌组织和癌旁组织Nrf2 蛋白表达水平比较 与癌旁组织比较,肺腺癌组织中Nrf2 蛋白表达水平为2.30±0.41,高于癌旁组织的1.04±0.27,差异有统计学意义(t=6.18,P<0.05),见图2。
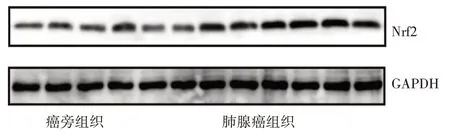
图2 肺腺癌组织和癌旁组织Nrf2 蛋白表达的电泳图
2.2 细胞观测指标结果
2.2.1 Nrf2 过表达或Nrf2 沉默对A549 细胞迁移能力的影响 vector-Nrf2 组迁移细胞数为(574.00±40.90)个/孔,高于vector 组的(409.00±11.70)个/孔,差异有统计学意义(t=15.52,P<0.05),见图3(插页)。si-Nrf2 组迁移细胞数为(218.00±29.55)个/孔,低于si-NC 组的(427.70±27.15)个/孔,差异有统计学意义(t=8.44,P<0.05),见图4(插页)。
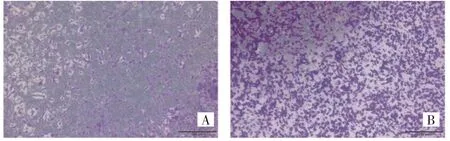
图3 Nrf2 过表达对A549 细胞迁移能力的影响(A:vector 组;B:vector-Nrf2 组)

图4 Nrf2 沉默对A549 细胞迁移能力的影响(A:si-NC 组;B:si-Nrf2 组)
2.2.2 Nrf2 过表达或Nrf2 沉默对A549 细胞增殖能力的影响 vector-Nrf2 组细胞EdU 阳性率为(38.87±0.50)%,高于vector 组的(28.60±0.95)%,差异有统计学意义(t=38.50,P<0.01),见图5(插页)。si-Nrf2 组细胞EdU 阳性率为(23.23±1.55)%,低于si-NC 组的(34.37±1.60)%,差异有统计学意义(t=6.32,P<0.05),见图6(插页)。

图5 Nrf2 过表达对A549 细胞增殖能力的影响

图6 Nrf2 沉默对A549 细胞增殖能力的影响
2.2.3 转染过表达质粒或siRNA 沉默片段对A549 细胞Nrf2 蛋白表达水平的影响 vector-Nrf2 组细胞Nrf2蛋白表达水平为1.68±0.29,高于vector 组的0.92±0.17,差异有统计学意义(t=3.83,P<0.05),见图7。si-Nrf2 组Nrf2 蛋白表达水平为0.52±0.09,低于si-NC组的1.06±0.13,差异有统计学意义(t=19.00,P<0.01),见图8。
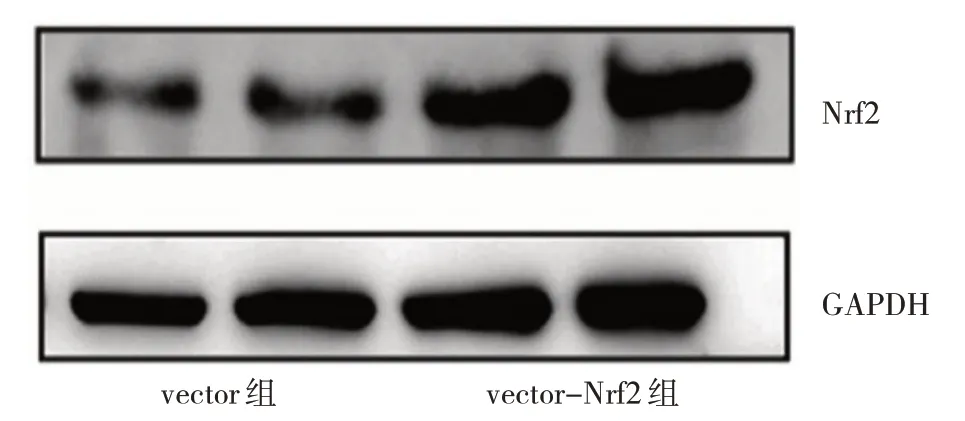
图7 Nrf2过表达对A549细胞Nrf2蛋白表达水平影响的电泳图
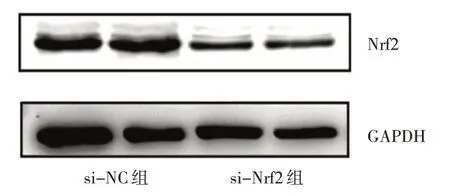
图8 Nrf2 沉默对A549 细胞Nrf2 蛋白表达水平影响的电泳图
2.2.4 Nrf2 过表达对细胞PI3K/Akt 信号通路相关蛋白表达的影响 vector-Nrf2 组中p-Akt、p-mTOR、Bcl-2蛋白表达水平均高于vector 组,而Bax、E-cadherin 蛋白表达水平均低于vector 组,差异均有统计学意义(均P<0.05);而两组Akt、mTOR 蛋白表达水平比较差异均无统计学意义(均P>0.05),见表2 和图9。

表2 Nrf2 过表达对细胞内PI3K/Akt 信号通路相关蛋白表达的影响
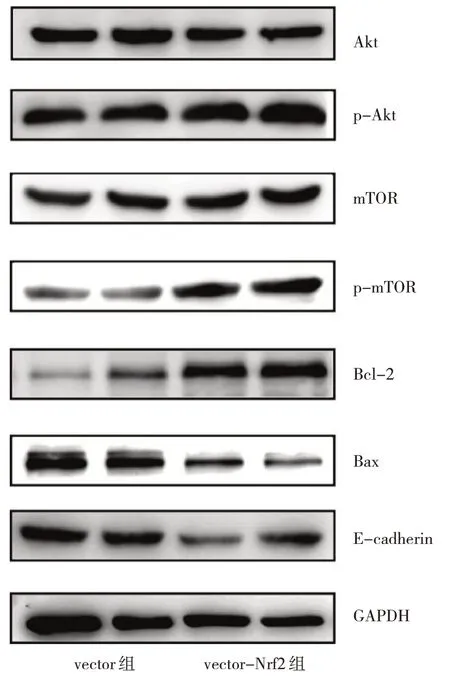
图9 Nrf2 过表达对细胞PI3K/Akt 信号通路相关蛋白表达水平影响的电泳图
2.2.5 Nrf2 沉默对细胞PI3K/Akt 信号通路相关蛋白表达的影响 si-Nrf2 组中p-Akt、p-mTOR、Bcl-2 蛋白表达水平均低于si-NC 组,而Bax、E-cadherin 蛋白表达水平均高于si-NC 组,差异均有统计学意义(均P<0.05);而两组Akt、mTOR 蛋白表达水平比较差异均无统计学意义(均P>0.05),见表3 和图10。
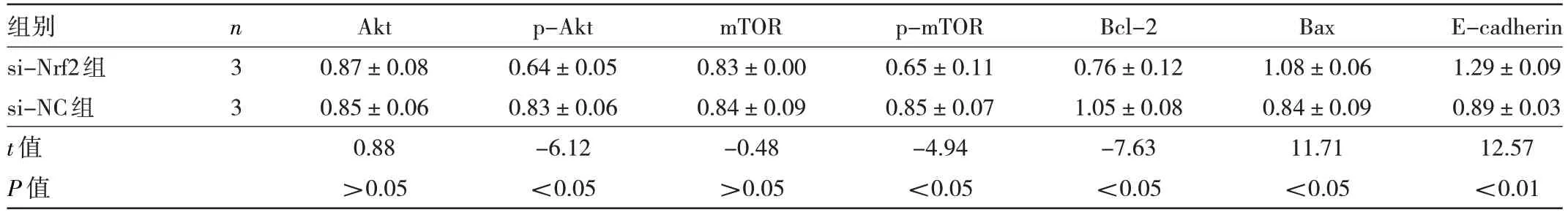
表3 Nrf2 沉默对细胞PI3K/Akt 信号通路相关蛋白表达的影响

图10 Nrf2 沉默对细胞PI3K/Akt 信号通路相关蛋白表达水平影响的电泳图
3 讨论
肿瘤的发病机制复杂,涉及到遗传、环境、基因突变、免疫微环境改变等诸多因素。近年来关于肺癌的研究发展迅速,临床治疗理念不断更新。随着吉非替尼、阿帕替尼、奥替雷斯及帕博利珠单抗等分子靶向、免疫药物的临床应用,肺癌患者的预后已经得到了初步的改善,但肺癌的病死率仍较高。因此,寻找有价值的分子标志物有助于揭示肺癌发展的分子机制,从而改善患者预后。
Nrf2 是细胞内调控氧化应激反应的重要元件。近年来研究表明,Nrf2 在多种肿瘤中过表达,并能促进肿瘤细胞的增殖和转移[11-12],但其促进肿瘤进展的机制尚不完全清楚。本研究通过RT-qPCR 法、Western blot法、免疫组化法发现肺腺癌组织中Nrf2 mRNA、蛋白表达水平均高于癌旁组织,表明Nrf2 在肺癌的发展过程中可能发挥着不可忽视的作用。肿瘤的发展与肿瘤细胞的无限增殖、侵袭和转移密切相关。因此,本研究体外培养了A549 肺腺癌细胞,将Nrf2 过表达质粒、si-RNA 沉默片段瞬时转染至细胞内,通过EdU、Transwell 实验证明Nrf2 促进肺腺癌细胞迁移、增殖的能力。PI3K/Akt 信号通路是肿瘤研究中的经典信号通路,其异常激活可显著促进肿瘤细胞的增殖、迁移、侵袭[12-14],目前该信号通路抑制剂Copanlisib 可显著提高滤泡性淋巴瘤患者的预后[15]。本研究结果表明,Nrf2沉默可抑制A549 细胞内的PI3K/Akt 信号通路,使其相关蛋白p-mTOR、p-Akt 蛋白表达水平降低,Nrf2 过表达则可促进该信号通路的激活。研究表明,Bcl-2、Bax、E-cadherin 作为PI3K/Akt 信号通路的下游分子[16-17],受到多种上游蛋白调控,进而影响细胞的凋亡、迁移、侵袭能力[18]。本研究中Nrf2 沉默后的A549细胞内的Bcl-2 蛋白表达水平降低,而Bax、E-cadherin蛋白表达水平升高,而Nrf2 过表达后上述分子的蛋白表达水平则相反。
本研究结果在一定程度上验证了Nrf2 在肺癌进展中发挥的作用,进一步阐明了其作为肺癌治疗靶点潜在可行性。之前的研究表明Nrf2 具有抗氧化剂氧化作用,可以保护细胞抵抗内源性和外源性氧化应激,减轻细胞损伤[19]。本研究体外实验则表明Nrf2 可以增强肺腺癌细胞的增殖和迁移能力,在肿瘤的恶化进展中发挥重要作用。有文献表明Nrf2 的生物学作用可能会在癌组织中发生改变,主要体现在相关信号通路的过度激活,这可能与Nrf2 蛋白翻译后修饰形式不同有关[20-23]。例如有研究报道Nrf2 的翻译后修饰在细胞癌变过程中发挥重要调节的作用,证据表明翻译后修饰可以影响Nrf2 信号转导,Neh1 结构域的p300/CREB 结合蛋白对Nrf2 的乙酰化促进其与ARE 蛋白的结合[20]。在肺腺癌细胞中,下调Nrf2 的乙酰化可导致氧化应激水平增加并激活JNK 信号通路,进而促进肺癌细胞的侵袭[21-23]。而本研究结果则表明Nrf2 的高表达促进了下游Akt 和mTOR 蛋白磷酸化,表明Nrf2 可能通过非自身蛋白修饰途径促进肿瘤进展,虽然目前的证据表明Nrf2 翻译后修饰可以上调其在癌症中的表达,但每种修饰在不同癌症类型中的确切功能、相关性和丰度需要进一步阐明。由于Nrf2 在正常或癌变细胞中扮演不同角色,这提示产生这种现象的分子机制可能是未来的研究方向。
综上所述,Nrf2 在肺腺癌组织中过表达,可能通过调控PI3K/Akt 信号通路,进而调控Bcl-2、Bax、E-cadherin 的表达而影响肺腺癌细胞的增殖、迁移能力,有可能成为一个潜在的分子靶标用于肺腺癌的治疗。

