桉树生长和防御相关酶对摩西管柄囊霉和青枯菌的响应*
黄 迪 陈 园 钟泺龙 梁家俊 王正木 陈祖静
(华南农业大学林学与风景园林学院 广东省森林植物种质创新与利用重点实验室 广州 510642)
桉树(Eucalyptusspp.)是世界三大速生丰产林树种之一,具有重要的经济和生态价值(潘嘉雯等,2018)。根据第9 次森林资源清查(2014—2018 年)数据,我国桉树人工林的面积占人工林总面积的6.85%,桉树人工林主要分布在广西、广东和福建等省,广东桉树人工林占总蓄积量的66.29%(Zhanget al.,2021)。青枯病是由茄科雷尔氏菌(Ralstonia solanacearum)引起的一种系统性维管束土传病害,被称为植物的“绝症”,青枯菌能危害200 多种植物(Weiet al.,2018)。近年来,桉树青枯病在多地发生,田间发病率超过60%(Ferrairaet al.,2018),对桉树产业造成了严重的损失。目前,对青枯病防控方法的研究集中在生物防治、化学方法、物理方法和抗病品种的选育等,生物防治具有减少不可再生资源的投入和环境友好的优点,而青枯病生物防治的研究主要集中在番茄(Solanum lycopersicum)、马铃薯(Solanum tuberosum)和茄子(Solanum melongena)等农作物上(Chaveet al.,2017),多年生林木中,桉树、木麻黄、桑树等青枯病发生严重,如何有效地防控林木青枯病的问题亟待解决(Yuliaret al.,2015;Ferrairaet al.,2018)。
丛枝菌根真菌(arbuscular mycorrhizal fungi,AMF)是一类有益的根际微生物,能与80%以上的陆生维管束植物形成丛枝菌根结构(Brundrettet al.,2018)。AMF 与根系互惠共生形成菌根结构,增加植物根系的吸收面积,提高植物养分的吸收效率,促进林木的生长和抗逆性(程鑫等,2023;Zhanget al.,2020;Hallasgo etal., 2022)。同时,AMF 可能调控植物茉莉酸、水杨酸和乙烯等多种激素的产生(Junget al.,2012),调控防御相关酶活性等植物的生理代谢过程而影响寄主的抗病能力(Chaveet al.,2017)。田间调查表明,菌根真菌能显著降低桉树青枯病发病率40%~72.78%(弓明钦等,2004)。然而,丛枝菌根真菌、桉树和青枯菌之间互作机制尚不清楚,极大地制约了丛枝菌根真菌在防控林木青枯病中的应用。因此,本研究以摩西管柄囊霉、巨桉和青枯菌三者之间不同的互作体系为研究对象,研究丛枝菌根真菌和青枯菌对桉树幼苗生理生化特征的影响,为利用丛枝菌根真菌防控桉树青枯病提供一定的技术依据。
1 材料与方法
1.1 试验材料
供试巨桉(Eucalyptus grandis)种子由莫晓勇教授惠赠。栽培基质为体积比3∶1 的沙子和蛭石。巨桉种子用1%的次氯酸钠溶液表面消毒15 min,萌发第10 天移栽至装有灭菌基质的花盆中,置于人工气候箱(MGC-800H,上海一恒科学仪器有限公司,中国)中培养,培养条件为光照16 h,温度28 ℃,光照强度100~200 W·m-2,湿度60%,黑暗8 h,温度22 ℃,湿度60%。
供试丛枝菌根真菌摩西管柄囊霉(Funneliformis mosseae,Fm)由华南农业大学林学与风景园林学院菌根生物学团队惠赠,菌剂为含有Fm 的孢子、菌丝、白车轴草(Trifolium repens)根段和沙子的混合物。
供试青枯菌采自广东省英德市林场3~4 年生桉树青枯病发病植株,分离、纯化和鉴定后获得桉树茄科雷尔氏菌(Ralstonia solanacearum)毒力YD 菌株。青枯菌在CPG 培养基上30 ℃下培养,制成1×109CFU·mL-1备用。
1.2 试验方法
1.2.1 桉树、摩西管柄囊霉和青枯菌之间不同互作体系的构建 选择长势良好且生长较一致的巨桉幼苗接种Fm 菌根化(mycorrhizal,Eg+Fm)和不接Fm(non-mycorrhizal,Eg+Nm)非菌根化处理,菌根化处理Fm 接种量约3 000 个孢子/盆,每周浇1~2 次低磷(30 μmol·L-1NaH2PO4)浓度的Long-Ashton 营养液,置于人工气候箱中培养,条件同上(Trottaet al.,1996)。接种Fm 第90 天用WGA488 染色,参照Trouvelot 等(1986)方法在荧光显微镜(OLYMPUS BX51)488 nm下检测Fm 与巨桉幼苗的共生情况。确认Fm 与巨桉幼苗根系共生后,用20 mL 1×109CFU·mL-1的青枯菌悬浮液浇灌植株根部,不接青枯菌的对照组巨桉幼苗用20 mL 无菌水浇灌根部,置于光照16 h,温度30 ℃,湿度80%,光照强度100~200 Wm-2,黑暗8 h,温度28 ℃,湿度80%的人工气候箱内进行培养。每个处理设3 个生物学重复,每个重复20 株巨桉幼苗。
1.2.2 巨桉幼苗生长指标观测 Fm 接种巨桉幼苗根系第90 d,观测巨桉幼苗株高、地径、根系生长情况、地上部分和地下部分生物量、氮、磷和钾养分含量,每个处理9 株植株。株高和地径测定分别使用尺子和游标卡尺;植株使用烘箱烘干,105 ℃杀青2 h 后75 ℃烘至恒质量后测定生物量,并计算根冠比和壮苗指数,其中,根冠比=地下干质量/地上干质量,壮苗指数=(茎粗/株高+根冠比)×全株干质量;根长、根直径、根表面积和根体积使用根系扫描仪WinRHIZO 测定。氮、磷和钾养分含量分别使用硫酸双氧水消煮-蒸馏法、硫酸双氧水消煮-钼锑抗比色法和硫酸双氧水消煮-火焰光度计法测定。
1.2.3 巨桉幼苗青枯病发病情况观测 巨桉幼苗根系受青枯菌侵染后,定期观测和记录巨桉幼苗的发病情况,每个处理9 株巨桉幼苗,参考分级标准计算发病率和病情指数,防控效果=[(非菌根化的巨桉病情指数-菌根化巨桉病情指数)/菌根桉树病情指数]×100%。
1.2.4 防御相关酶活性测定 分别于青枯菌侵染后0、12、24、48、96、144 和192 hour post-inoculation(hpi)采集各处理6 株巨桉根系和叶片组织样品,液氮速冻后储存于-80 ℃冰箱备用。巨桉幼苗受青枯菌侵染后不同时间点根系和叶片中的保护酶超氧化物歧化酶(Superoxide dismutase, SOD)活 性、 过 氧 化 物 酶(Peroxidase,POD)和多酚氧化酶(Polyphenol oxidase,PPO)活性测定参考《生物化学实验技术》中的方法(巫光宏等,2015)。苯丙氨酸解氨酶(Phenylalanine ammonia lyase,PAL)、β-1,3-葡聚糖酶(β-1,3-glucanase)和几丁质酶活性分别按照苏州科铭生物技术有限公司的PAL-2-Y、GA-2-Y 和JDZM-2-G 试剂盒操作说明进行测定。
1.3 数据分析
数据采用软件SPSS(IBM SPSS Statistics 19)进行统计分析,采用多重检验Duncan’s 法,在P< 0.05 水平下检验差异显著性,巨桉组织中酶活性指标之间进行Person 相关性分析,并利用软件Graphpad Prism 6 和Origin 2022 作图。
2 结果与分析
2.1 摩西管柄囊霉与巨桉幼苗根系共生良好
摩西管柄囊霉能与巨桉幼苗根系形成良好的共生关系(图1)。巨桉幼苗接种Fm 后,3 week postinoculation(wpi)时Fm 孢子萌发出大量菌丝(图1B),从巨桉幼苗幼嫩的根细胞侵入(图1C),在根系细胞层中蔓延,6 wpi 时Fm 在根内形成丛枝菌根结构(图1D),8 wpi 时丛枝菌根结构逐渐增多,形成长块状的丛枝结构(图1E),10 wpi 时丛枝占据整个根细胞(图1F),12 wpi 时形成椭圆形泡囊(图1G),泡囊数目逐渐开始增多,之后丛枝开始降解(图1H)。接种Fm 的12 wpi时,巨桉幼苗根系菌根侵染率为78.15%。
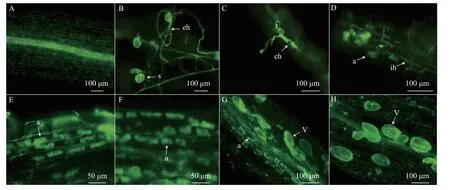
图1 摩西管柄囊霉在巨桉幼苗根系中定殖的时间进程Fig.1 The time course of F.mosseae infection in the roots of Eucalyptus grandis seedlings
2.2 摩西管柄囊霉菌根化促进巨桉幼苗健壮生长
巨桉幼苗接种Fm 第90 天,非菌根化巨桉幼苗叶片泛红,叶片面积较小,有明显的缺磷症状(图2A)。菌根化巨桉幼苗叶片绿色,叶片宽大,没有明显的缺磷症状(图2B)。与非菌根化巨桉相比,Fm 菌根化巨桉幼苗的株高(图2C)、地径(图2D)、整株干质量(图2E)和壮苗指数(图2F)都有显著增加,分别为对应Nm 的2.30 倍、4.38 倍、2.75 倍和1.71 倍。与Nm相比,Fm 菌根化巨桉幼苗的根长、根直径、根表面积、根体积和根冠比都显著性增加,分别为对应Nm 的1.79、1.39、1.64、3.55 倍和2.16 倍。Fm 菌根化巨桉幼苗地上部分和地下部分的氮、磷和钾含量都显著高于对应的Nm 处理,Fm 菌根化巨桉地上部分氮、磷和钾含量分别是Nm 的2.73、2.95 和1.72 倍,Fm 巨桉地下部分的氮、磷和钾含量分别是对照组的1.72、1.90 和1.43 倍(表1)。说明接种Fm 能有效促进巨桉幼苗根系伸长、侧根生长和根表面积扩大,增加巨桉组织中的氮、磷和钾含量,显著促进巨桉幼苗的生长。
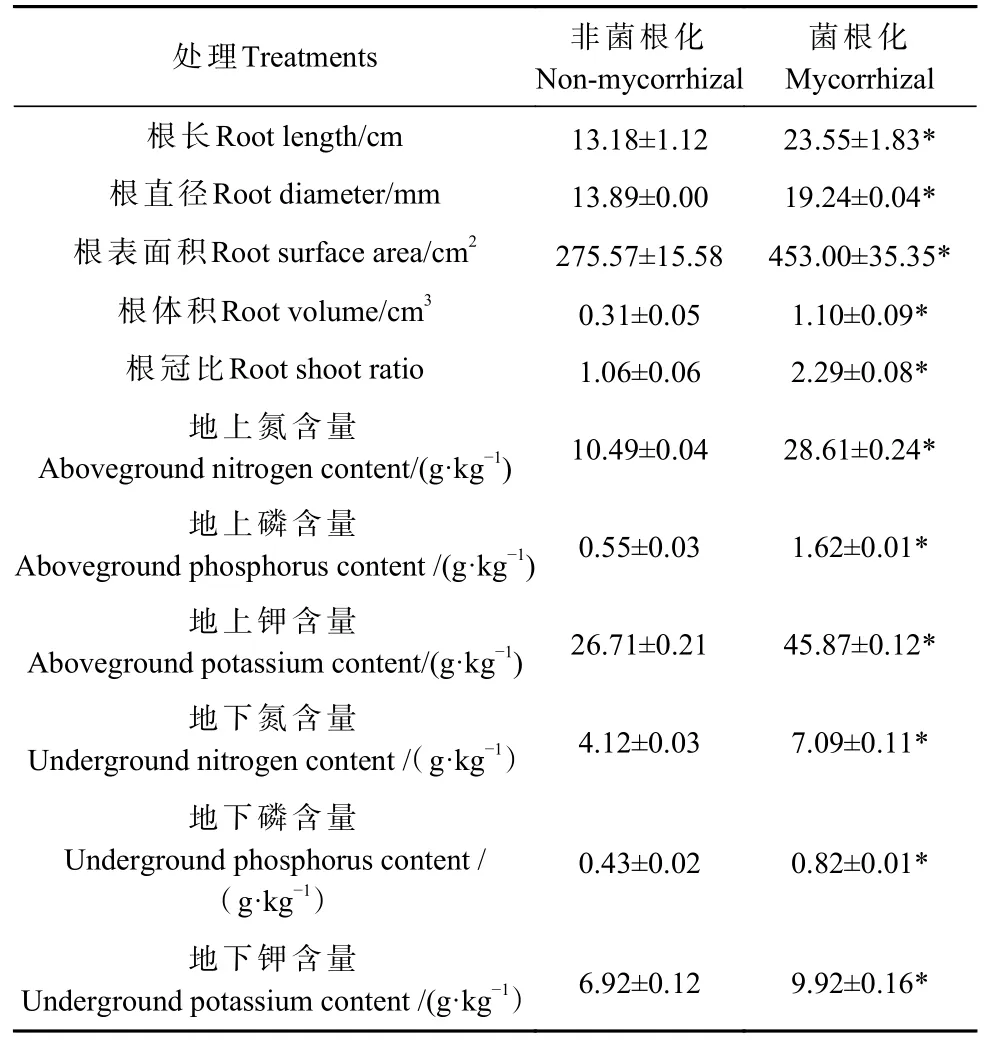
表1 摩西管柄囊霉菌根化巨桉幼苗根系的生长和植株组织中氮、磷和钾含量①Tab.1 Root growth and contents of N, P and K in the tissues of E.grandis seedlings with F.mosseae mycorrhizal
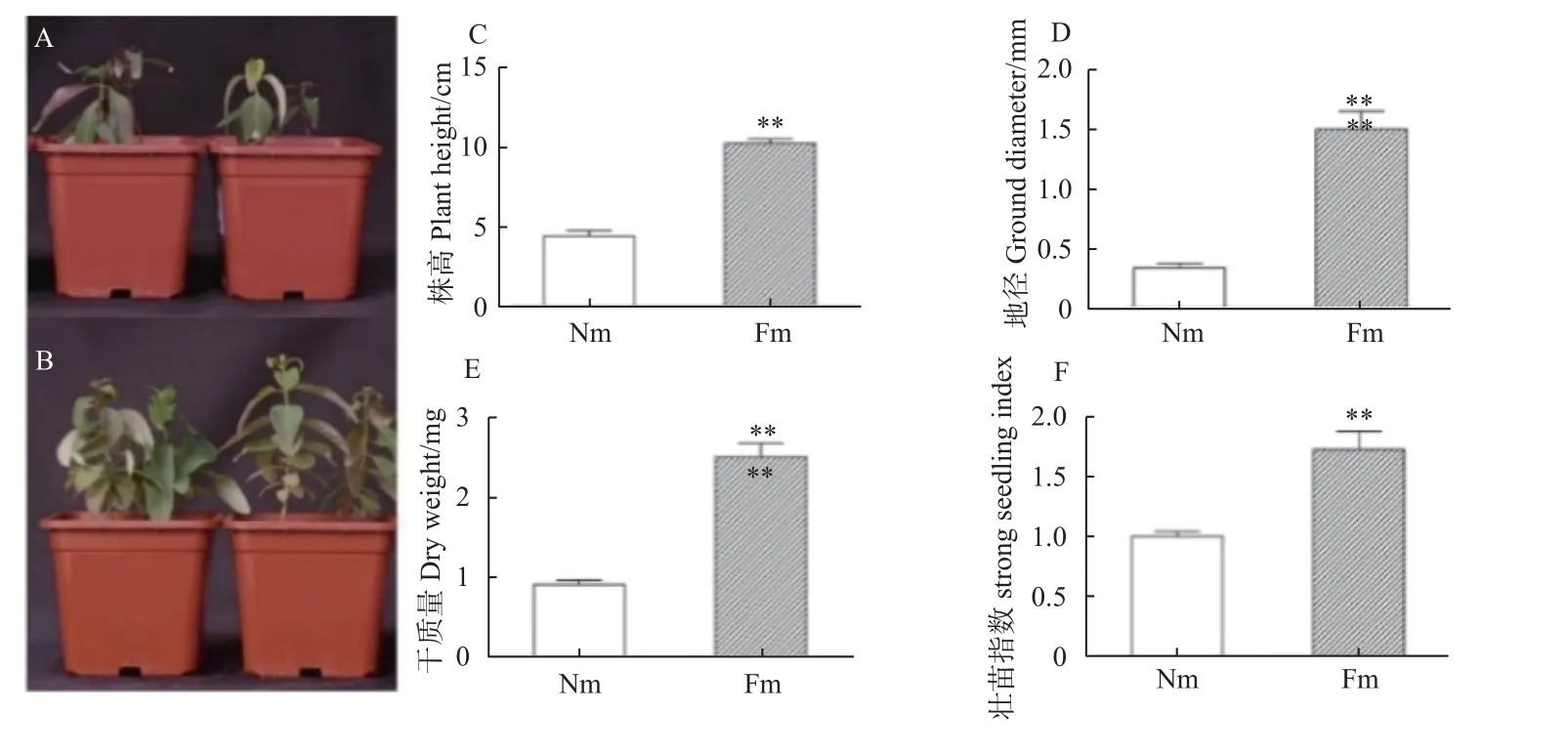
图2 摩西管柄囊霉菌根化与非菌根化的巨桉幼苗生长Fig.2 The E.grandis seedlings growth under F.mosseae mycorrhizal or non-mycorrhizal.
2.3 摩西管柄囊霉菌根化对巨桉幼苗青枯病的影响
受青枯菌侵染后,Nm 巨桉幼苗迅速发病,侵染青枯菌第3 dpi 叶片开始干枯皱缩,第5 dpi 叶片皱缩面积增大,占单片叶片25%左右,随着青枯菌侵染时间进程的增加,叶片从顶端叶片到局部萎焉,第12 dpi萎焉皱缩叶片超过整株植株的60%,部分叶片边缘干枯,青枯病病症明显,90%叶片发病,第22 dpi 整株叶片全部枯萎发病,发病率为100%。Fm 菌根化巨桉幼苗受青枯菌侵染后发病较为缓慢,第5 dpi 出现叶片褪绿泛红,第22 dpi 发病率为18.33%±1.45%,发病叶片呈紫红色,病情指数为15%±1.15%。Fm 菌根化巨桉幼苗对青枯菌的防控效果为81.67%±1.45%(表2)。说明接种Fm 能明显降低巨桉幼苗青枯病的发病率,青枯病症状减轻,延缓青枯病的发生。
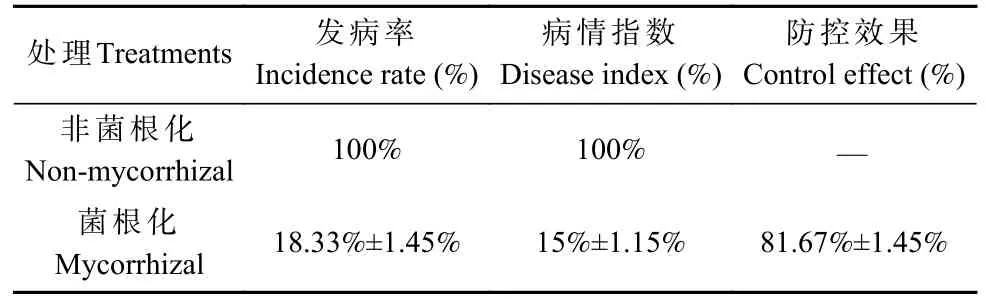
表2 青枯菌侵染巨桉幼苗的发病情况Tab.2 Disease incidence of E.grandis seedlings infection with R.solanacearum
2.4 接种摩西管柄囊霉和青枯菌对巨桉幼苗组织中保护酶活性的影响
无论巨桉幼苗是否接种Fm 和受青枯菌侵染,巨桉叶片组织中SOD 活性显著高于根系中(图3A)。随青枯菌侵染时间进程的增加,Fm 菌根化巨桉幼苗叶片和根系中的SOD 活性先升高后降低,分别在青枯菌侵染96 hpi 和192 hpi 时达到峰值(74.59±9.5) U·min-1g-1和(352.6±9.0) U·min-1g-1。受青枯菌侵染进程中,Fm菌根化巨桉幼苗叶片中SOD 活性均显著高于对应Nm 叶片中的活性,受青枯菌侵染12、48 和144 hpi 时Fm 根系中的SOD 活性与对应Nm 中的比较差异显著。青枯菌侵染进程中Nm 巨桉幼苗叶片受根系和叶片中的SOD 活性无显著变化。受青枯菌侵染后,无论是Fm 还是Nm 处理,SOD 活性在巨桉叶片中显著高于对应根系中(图3A)。
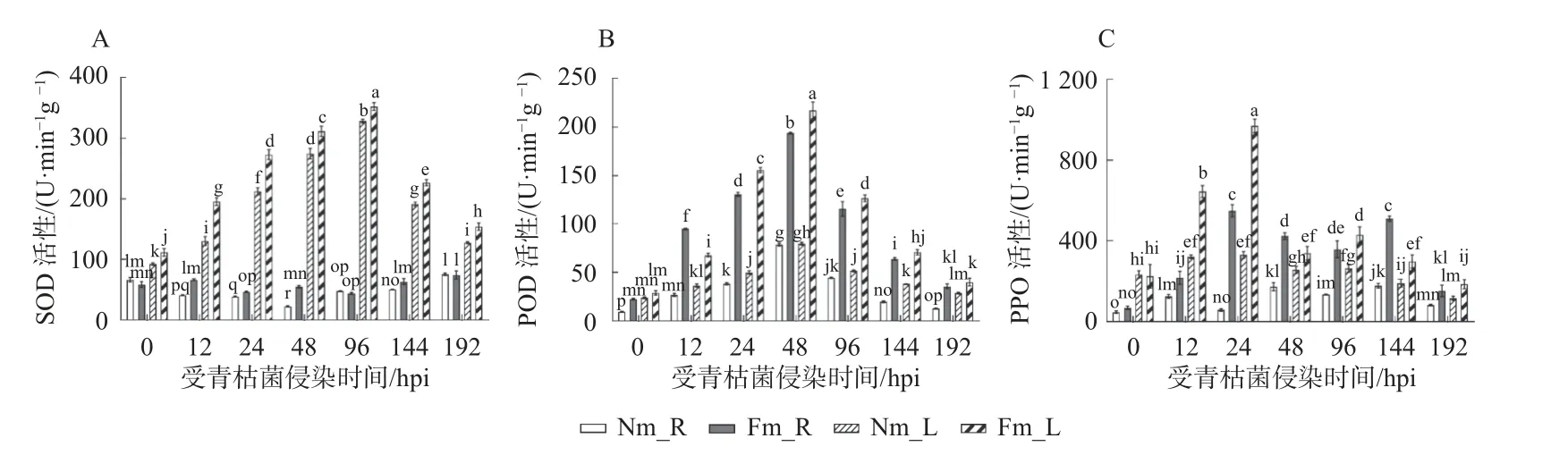
图3 青枯菌侵染对菌根化与非菌根化巨桉幼苗组织保护酶活性的影响Fig.3 Effects of tissue protection enzyme activity of E.grandis seedlings infected by R.solanacearum in different treatments
随青枯菌侵染时间的增加,菌根化巨桉幼苗根系和叶片中的POD 活性先升高后降低,均在48 hpi 出现最 高 峰,分 别 为(193.78±1.14)U·min-1g-1和(217.2±12.28)U·min-1g-1,为 对 应非菌 根 化 组 织 的2.46 倍和2.73 倍(图3B)。受青枯菌侵染24~144 hpi,Fm 菌根化巨桉幼苗叶片中POD 活性显著高于对应Nm 叶片中;(图3B)。Fm 菌根化巨桉幼苗组织中的PPO 活性随青枯菌侵染时间的增加呈现升高后下降趋势,且在Fm 中显著高于对应的Nm 中, Fm 菌根化巨桉幼苗根系和叶片的PPO 活性均在青枯菌侵染24 hpi 达到最高峰,分别为对应Nm 组织中的9.45 倍和2.94 倍(图3C)。总之,菌根化巨桉幼苗根系和叶片受青枯菌侵染后的PPO 和POD 活性总体趋势为先上升后下降,显著高于对应的Nm 组织中。
2.5 接种摩西管柄囊霉和青枯菌对巨桉幼苗组织防御相关酶活性的影响
受青枯菌侵染后,菌根化巨桉幼苗叶片的PAL 活性逐渐升高后降低,在青枯菌侵染144 hpi 时达到最高峰(182.74±5.38)U·min-1g-1,为对应Nm 中的2.13 倍。而PAL 活性在Fm 和对应Nm 受青枯菌侵染个时间点的根系组织中无差异显著。PAL 活性在巨桉幼苗叶片中显著高于根系中(图4A)。青枯菌入侵后,菌根化巨桉幼苗叶片PAL 活性显著增加有利于抵御青枯菌侵染。
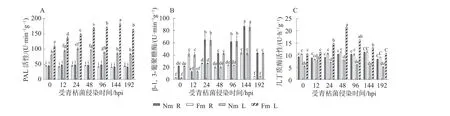
图4 青枯菌侵染对菌根化与非菌根化巨桉幼苗组织防御相关酶活性的影响Fig.4 Effects of defense-related enzyme activity of E.grandis seedlings infected by R.solanacearum in different treatments
受青枯菌侵染整个进程中,Fm 菌根化巨桉组织(根系和叶片)中的β-1,3-葡聚糖酶活性均显著高于对应Nm 中。随青枯菌侵染时间的增加,Fm 菌根化巨桉幼苗组织中β-1,3-葡聚糖酶活性总体呈先升高后下降的趋势,受青枯菌侵染144 hpi 时达到最高峰(85.48±8.50)U·min-1g-1和(87.0±67.89)U·min-1g-1(图4B)。无论Fm 菌根化还是Nm 处理下,受青枯菌侵染的同一时间点时β-1,3-葡聚糖酶活性在对应巨桉根系和叶片组织之间的差异均不显著(图4B)。受青枯菌侵染后,几丁质酶活性在Fm 青枯菌侵染48 hpi 时的菌根化巨桉幼苗叶片中最高(21.51±0.05 )U·h-1g-1,为对应Nm中的3.06 倍。青枯菌侵染进程中,几丁质酶活性在Fm 菌根化和Nm 的巨桉幼苗根系中的差异不显著。整体上,几丁质酶活性在叶片中随着青枯菌的侵染先升高后降低(图4C)。与对应的Nm 相比,青枯菌侵染后Fm 菌根化巨桉组织中的β-1,3-葡聚糖酶和几丁质酶迅速响应,活性显著升高,有利于寄主防御青枯病。
受青枯菌侵染的Nm 与Fm 菌根化巨桉幼苗组织响应的保护酶与防御相关酶活性之间呈正相关关系,其中SOD 活性与PAL 活性(r=0.82)、几丁质酶活性(r=0.77)和POD 活性呈显著正相关(r=0.77),POD 活性与几丁质酶活性呈显著正相关(r=0.94,P<0.01)(图5)。
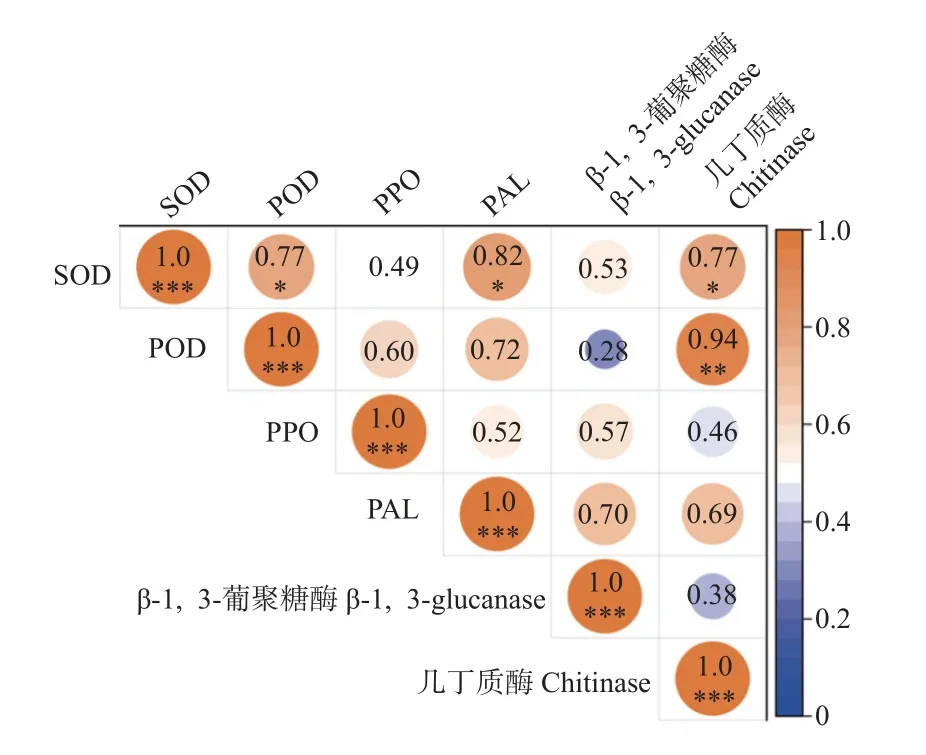
图5 巨桉幼苗组织响应摩西管柄囊霉和青枯菌相关酶活性的相关性Fig.5 Correlation among defense-related enzyme activities in the tissue of E.grandis seedlings responded to the F.mosseae and R.solanacearum
3 讨论
3.1 接种丛枝菌根真菌促进植物的生长
丛枝菌根真菌能与80%以上的陆生维管束植物形成丛枝菌根结构(Brundrettet al.,2018)。研究表明,番茄(Solanum lycopersicum)接种丛枝菌根真菌摩西管柄囊霉2 wpi 时开始检测到菌根,3~4 wpi 时菌根增多,4 wpi 时菌根定殖高达90%(Cesaroet al.,2020)。本研究中Fm 能在巨桉根系成功定殖,形成良好的共生关系,侵染率略低于其在草本植物大豆(Luet al.,2020)和 番 茄、灌 木 白 刺 花(Sophora viciifolia)(Xuet al.,2016)根系中的侵染率,但明显高于木本植物枳(Poncirus trifoliate)中的侵染率(张菲等,2019),相对草本与灌木,摩西管柄囊霉更难侵入多年生的木本植物根系,这可能与多年生木本植物根系木质化程度较高有关。同时,摩西管柄囊霉在巨桉幼苗根系比在番茄根系中形成菌根的时间晚,说明菌根侵率及其形成时间可能与物种、植株年龄、接种方式和菌剂接种量等有关(Xuet al.,2016)。接种丛枝菌根真菌能促进植株的生长。接种摩西管柄囊霉的白刺花株高、地径和根冠比明显增加(Xuet al.,2016)。本研究中为非菌根化的桉树生长,有明显的缺磷症状,而Fm 显著促进巨桉幼苗生长且叶片没有明显的缺磷症状,与田间桉树幼树接种苏格兰球囊霉的结果类似(弓明钦等,2004)。接种丛枝菌根真菌提高寄主植物对氮、磷和钾等营养元素的吸收和利用,菌根侵染程度与P、K 吸收的平均效应大小呈正相关,与氮吸收之间的关系不明显(Chandrasekaran,2020)。本研究中菌根化巨桉幼苗地上和地下部分的氮、磷和钾含量均显著高于对应的非菌根化组织(表1),Fm 与巨桉幼苗根系共生形成的丛枝、泡囊和菌丝等结构成为巨桉和Fm 之间营养交换的活性位点,有助于寄主吸收磷、氮、钾等营养元素,促进桉树幼苗健壮生长,间接提高桉树的抗病性(图1,2)。
3.2 接种丛枝菌根真菌对植物抗青枯菌能力的影响
接种摩西管柄囊霉提高寄主植物的抗病性,如提高大豆对根腐病的抗性和寄主抵御土传病原菌镰刀 菌 的 能 力(Karimiet al., 2016;Zhanget al.,2020;Hallasgoet al., 2022)。接种摩西管柄囊霉提高寄主植物的抗病性,摩西管柄囊霉菌根化后寄主防御相关酶活性和木质素等防御相关物质含量显著增加,可降低苜蓿萎蔫和根腐病发病率80.13%,有效防控根部病害(王晓瑜等,2019; Zhanget al., 2014; Songet al., 2015)。由青枯菌引起的林木青枯病发病严重,青枯菌接种数目、菌株致病力强度、植株生长状况和微生物群落组成等都影响青枯病的发病(Weiet al.,2018;马超等,2021;魏永成等,2021)。接种丛枝菌根真菌对青枯病有一定的防控作用。接种番茄异形根孢囊霉能够延缓青枯病发病时间(Chaveet al.,2017),丛枝菌根真菌降低马铃薯青枯病的危害,防治效果为65.2%(谭树朋等,2015)。田间调查显示,苏格兰球囊霉和彩色豆马勃能有效地降低青枯病发病率和病情指数,分别降低9.4%~15.6%和22.3~32.6(弓明钦等,2004)。本研究中,非菌根化处理的巨桉幼苗青枯病发病迅速,且发病率为100%,而Fm 菌根化的桉树幼苗青枯病发病时间延迟,症状减轻,对桉树幼苗青枯菌的防控效果为81.67%,明显高于桉树幼树田间试验效果,说明Fm 对桉树青枯菌的防控效果可能优于苏格兰球囊霉和彩色豆马勃,这也可能与菌根真菌的类型、菌剂质量和试验环境条件相关。青枯病有两种发病类型,典型青枯症状为植株感病后的7~21 dpi 内,叶片急剧失水萎蔫,不脱落而悬挂于枝条上;少数植株感病后,先是叶片有营养不良的症状,严重的发病症状或枯死则需要更长的时间才能被观察到(施仲美等,2000)。本研究中,非菌根化的巨桉幼苗感染青枯病发病后叶片快速干枯,植株死亡,属于第一种发病类型,而菌根化的巨桉幼苗感染青枯病的叶片有褪绿、发红和卷曲的现象,短时间内不会干枯死亡,属第二种发病类型,说明Fm与巨桉共生可能会影响青枯菌的发病类型。青枯菌主要通过根系伤口入侵,木质部导管被堵塞,影响寄主的水分代谢和磷元素等营养元素的吸收,青枯菌侵染后未菌根化的巨桉幼苗叶片有典型的缺磷症状,而菌根化的巨桉幼苗叶片缺磷症状不明显,这可能与Fm 能促进巨桉幼苗根系磷吸收有关(表1,图2)。
3.3 接种丛枝菌根真菌调控植物防御相关酶活性
同一植物的不同组织或不同生长时期,防御相关酶活性和基因的表达量具有时空特异性。受青枯菌侵染后,Fm 菌根化巨桉幼苗根系和叶片的防御相关酶活性先升高后下降,在Fm 菌根化巨桉幼苗叶片中显著高于对应非菌根化中,SOD、PPO、POD、PAL 和几丁质酶在巨桉幼苗叶片中的活性明显高于根系组织中,这与菌根化马铃薯中的SOD 和POD 活性受青枯菌侵染后明显增加的研究结果类似(谭树朋等,2015)。其中,SOD 参与保护植物免受病原菌攻击引起的氧化损伤,能将超氧阴离子迅速还原为过氧化氢,过氧化氢酶能将过氧化氢转化成水和氧气(Khoaet al.,2017),菌根化桉树中SOD 酶活性显著增加可能消除青枯菌侵染引起的活性氧伤害(Shasmitaaet al.,2019)。PPO 参与植物对病原体的防御,POD 参与木质素的生物合成、病原体防御和细胞壁多糖的交联等),提高植物的抗病能力(Shasmitaaet al.,2019)。本研究中,与非菌根化处理相比,菌根化巨桉幼苗叶片受青枯菌侵染后的PAL、β-1,3-葡聚糖酶和几丁质酶活性迅速升高,这与菌根化杨树抗溃疡病的研究结果一致(湛蔚等,2010)。PAL、几丁质酶和β-1,3-葡聚糖酶是抗病防御反应的诱导酶,青枯菌入侵后,菌根化桉树可能通过调控苯丙烷类代谢途径相关酶的活性,将酚类物质转化为木质素和植保素等抗菌防御相关物质,增强寄主对青枯菌的防御能力,从而提高桉树抗病性(Shasmitaaet al.,2019)。
4 结论
丛枝菌根真菌摩西管柄囊霉能与巨桉根系良好共生,接种摩西管柄囊霉显著增加桉树幼苗的生长和氮、磷、钾养分含量,显著促进桉树健壮生长。受侵染青枯菌后,摩西管柄囊霉菌根化桉树组织中防御相关酶SOD、POD、PPOPAL、几丁质酶和β-1,3-葡聚糖酶活性被快速和大幅激活,提高了寄主防御青枯菌的能力,摩西管柄囊霉菌根化处理明显延缓桉树青枯病的发病时间和减轻病症,对桉树青枯病的防控效果达到81.67%。

