羊痘病毒80、81 基因真核表达载体构建及鉴定
葛志毅,赵 微,程思危,周园霞,马欣欣,李有文
( 1. 塔里木大学动物与科学技术学院,新疆 阿拉尔 843300 ;2. 新疆生产建设兵团塔里木畜牧科技重点实验室,新疆 阿拉尔 843300 )
羊痘作为动物痘病毒病中一种严重的疾病,常会引起牛、羊的皮肤丘疹和炎症,对母羊和羔羊具有很高的致死率[1-3]。羊痘流行范围广,在中国、瑞典、印度等国家均有相关报道[4]。随着分子技术的不断发展,有关羊痘的研究不再局限于其症状、诊断,也进入了基因水平[5]。基因组研究表明,羊痘病毒基因组全长约150 kb,共编码147个开放阅读框(ORF),分中间区域和两端区域,两端区域(ORF001~ORF023和ORF124~ORF156)与致病性、选择宿主范围等有关[6]。两端区域基因研究内容较多,如ANK基因[7]、KLPL基因等[8]。而中间区域(ORF024~123)是核心部分,编码与病毒复制、转录、蛋白合成、加工等生物繁殖相关的重要蛋白[9]。80、81基因隶属核心部分,其编码基因与病毒的复制、蛋白合成相关。Tulman等[10]在对羊痘病毒基因组全序列进行分析研究时也只是注明80、81基因属于病毒粒子蛋白,而无其他信息,后续也未见其他研究。本试验在前人基础上探究80、81基因的生物学特性,研究其部分蛋白功能,以期为羊痘病毒的基础研究提供参考。
1 材料与方法
1.1 试验材料
pCDNA3.1 质粒、Vero 细胞、大肠杆菌DH5α 细胞,均由塔里木畜牧科技兵团重点实验室保存。
琼脂糖水平电泳仪(北京市六一公司)、隔水式恒温培养箱(上海市一恒科研仪器设备股份有限公司)、XMTP-204水浴锅(上海博讯实业有限公司)、Tanon3500凝胶成像分析系统(河南博奥诚恒科贸有限公司)、T100 PCR 仪(Thermo 科技有限公司)、高速离心机小型台式(eppendorf公司)、SWCJ-2FD超净工作台(BXOXUN公司)。
DNA Marker、琼脂糖凝胶回收试剂盒、质粒小提取试剂盒等购自北京天根生物工程技术有限公司;PrimeSTAR聚合酶、Q.Cut EcoR I 和Q.Cut Hind Ⅲ限制性内切酶、solutionⅠ均购自宝日医生物技术(北京)有限公司。
1.2 试验方法
1.2.1 生物信息学分析
分别使用在线网站SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat. pl? Page=npsasopm. html)和swiss model(https://swissmodel.expasy.org/interactive/)对羊痘病毒80、81基因表达蛋白二级和三级结构进行预测;在线软件Interpro(https://www.ebi.ac.uk/interpro/)对羊痘病毒80、81基因表达蛋白功能位点进行研究。
1.2.2 引物的设计与合成
根据GenBank 中检索的基因组序列(GenBank 登录号为AF124517)中80、81 基因的序列,使用Primer5.0 软件设计2对扩增引物,预计扩增产物大小为1 908和492 bp。上游引物添加EcoR Ⅰ酶切位点,下游引物添加Hind Ⅲ酶切位点,送至上海生物工程有限公司合成。引物序列见表1,虚线下标为保护性碱基,实线下标为酶切位点。
表1 引物序列信息Tab.1 A primer sequence's details
1.2.3 羊痘病毒80、81基因组的DNA提取
根据实验室中已存的羊痘病毒疫苗株,按照病毒基因组试剂盒说明书提取病毒基因组,于-20 ℃冰箱保存。
1.2.4 羊痘病毒80、81基因的扩增与回收
以提取的基因组为模板扩增羊痘80和81目的基因。
扩增反应体系:Prime STAR Max 25 μL、80/81-F 2 μL、80/81-R 2 μL、羊痘病毒基因组2 μL、RNase-free water 19 μL。扩增程序:95 ℃ 2 min;98 ℃ 10 s,55 ℃ 5 s,72 ℃ 10 s,循环35 次;72 ℃ 10 min。PCR 扩增产物经1.0%琼脂糖凝胶电泳鉴定后,用琼脂糖凝胶电泳回收试剂盒对PCR扩增产物进行回收,按照试剂盒说明书操作。
1.2.5 羊痘病毒80、81基因真核表达载体的构建
将经回收的80、81基因和pCDNA3.1质粒分别使用内切酶EcoR Ⅰ和Hind Ⅲ进行快速双酶切。酶切体系:胶回收80、81基因/pCDNA3.1质粒30 μL、Q.Cut EcoR Ⅰ 6 μL、Q.Cut Hind Ⅲ 6 μL、10×Q.Cut G.buffer 5 μL、RNase-free water 3 μL。酶切产物取10 μL琼脂糖凝胶电泳进行鉴定,鉴定正确的酶切产物进行胶回收。
将酶切成功的80、81目的基因与pCDNA3.1空载体酶切产物于16 ℃,利用T4 连接酶过夜连接。连接体系为:solutionⅠ 9 μL、pCDNA3.1 2 μL及胶回收羊痘病毒80、81基因7 μL。连接后的重组质粒命名为pCDNA3.1-80、pCDNA3.1-81,将重组质粒按照转化说明书操作,转化入大肠杆菌DH5α感受态细胞中进行克隆增殖。
1.2.6 羊痘病毒80、81基因真核表达载体的鉴定
转化增殖的连接产物挑取单克隆过夜培养后进行菌液PCR鉴定,鉴定结果为阳性的菌液产物提取重组质粒进一步进行双酶切鉴定,鉴定结果为两条酶切条带的产物送往上海生物工程有限公司进行验证。
1.2.7 Vero细胞培养与转染
37 ℃水浴复苏并培养Vero细胞,传代2~3次待细胞稳定,转染前1 d 传代,转染当天细胞需要达到70%~90%覆盖。使用HBS 稀释重组质粒pCDNA3.1-80、pCDNA3.1-81(使用无内毒素的试剂盒提取质粒),HBS稀释Lip2000,两液混合后加入Lip2000,37 ℃孵育6 h,更换培养基,加入新鲜生长培养基继续培养。
1.2.8 CCK-8测定转染后蛋白毒力
在转染12、24、36 h 后,分别取细胞悬液使用CCK-8试剂盒进行表达蛋白毒性检测。96 孔板接种细胞悬液100 μL,每孔加入CCK-8 10 μL,将细胞悬液置于培养箱中培养1~2 h,之后使用酶标仪检测OD450nm吸光度。
对汇总的吸光度采用SPSS Statistics 20.0 软件进行单因素方差分析。结果以“平均值±标准差”表示,P<0.05表示差异显著,P<0.01表示差异极显著。
1.2.9 羊痘病毒80、81基因转染效果鉴定
重组质粒转染Vero细胞48 h后,弃去细胞悬液进行破碎,按照细胞基因组试剂盒提取细胞基因组,PCR 特异性扩增羊痘病毒80、81基因,证明检测的Vero细胞中羊痘基因80、81基因转染成功,其蛋白在细胞中表达。扩增程序同1.2.4、1.2.5,使用核酸电泳进行鉴定。
2 结果与分析
2.1 羊痘病毒80、81基因生物信息学分析(见图1~图3)

图1 羊痘病毒80、81蛋白二级结构Fig.1 Protein secondary structure of capripoxvirus protein 80 and 81
由图1 可知,80 基因表达蛋白含有α-螺旋205 个,占32.28%;延伸链178个,占28.03%;β-转角60个,占9.45%;无规则卷曲192 个,占30.24%。81 基因表达蛋白含有α-螺旋30 个,占18.40%;延伸链65 个,占39.88%;β-转角26个,占15.95%;无规则卷曲42个,占25.77%。
由图2可知,80基因蛋白总长约为635个氨基酸,其分子量大小为73.43 kDa,等电点(PI)为6.88;在溶液中的不稳定指数为35(阈值40),推测蛋白性质稳定;亲水性平均系数为-0.083,表现出亲水性;预测80 蛋白主要以α 螺旋为主。81基因蛋白总长约为492个氨基酸,其分子量大小为40.59 kDa,PI 为5.32;在溶液中的不稳定指数为32.78,推测蛋白性质稳定;亲水性平均系数为0.674,表现出疏水性;预测81蛋白主要以无规则卷曲为主。
图2 羊痘病毒80、81蛋白三级结构Fig.2 Tertiary structure of sheep pox virus proteins 80 and 81
由图3可知,羊痘病毒80蛋白有2个解旋酶ATP结合位点,1 个解旋酶位点;羊痘病毒81 蛋白有1 个RNA 酶聚合位点,涉及病毒转录过程。

图3 羊痘病毒80、81蛋白功能位点Fig.3 Functional sites of proteins 80 and 81 of sheep pox virus
2.2 羊痘病毒80、81基因的扩增结果(见图4)
图4 羊痘病毒80、81基因PCR扩增结果Fig.4 PCR amplification results of sheep pox virus genes 80 and 81
由图4 可知,经PCR 扩增和琼脂糖凝胶电泳鉴定,成功扩增出1 908、492 bp的羊痘病毒80基因、81基因。
2.3 羊痘病毒80、81基因真核表达载体构建(见图5、图6)
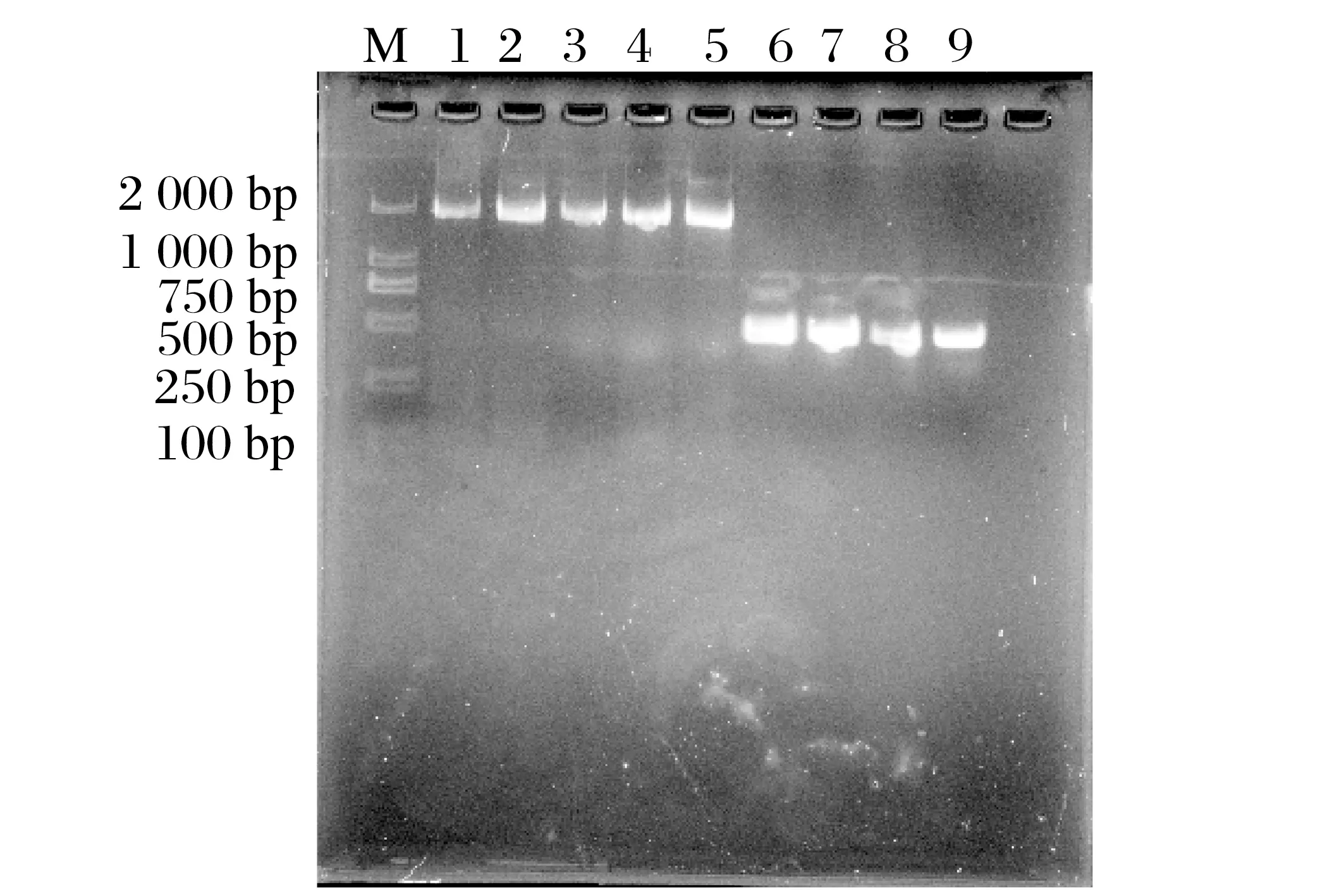
图5 羊痘病毒80、81基因酶切结果Fig.5 Enzyme digestion results of sheep pox virus genes 80 and 81
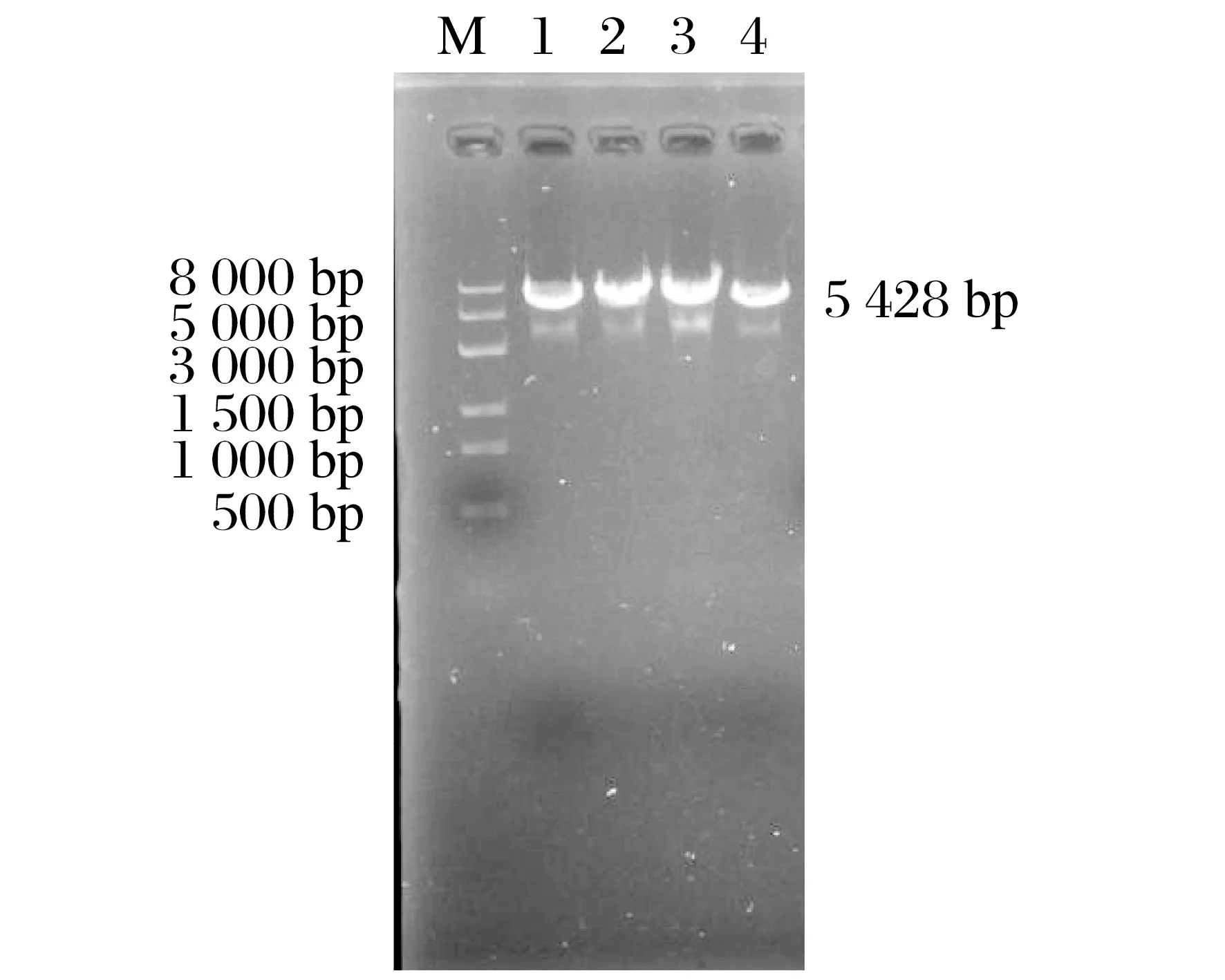
图6 pCDNA3.1质粒酶切结果Fig.6 pCDNA3.1 plasmid digestion results
对扩增的80 基因和81 基因及真核质粒pCDNA3.1 进行双酶切,之后进行核酸电泳鉴定。由图5可知,80、81基因由于本身是线性片段,酶切后未见其他变化。
由图6 可知,环状三条带质粒酶切后成线形单条带质粒,表明质粒酶切成功。
2.4 羊痘病毒80、81基因真核表达载体鉴定(见图7、图8)
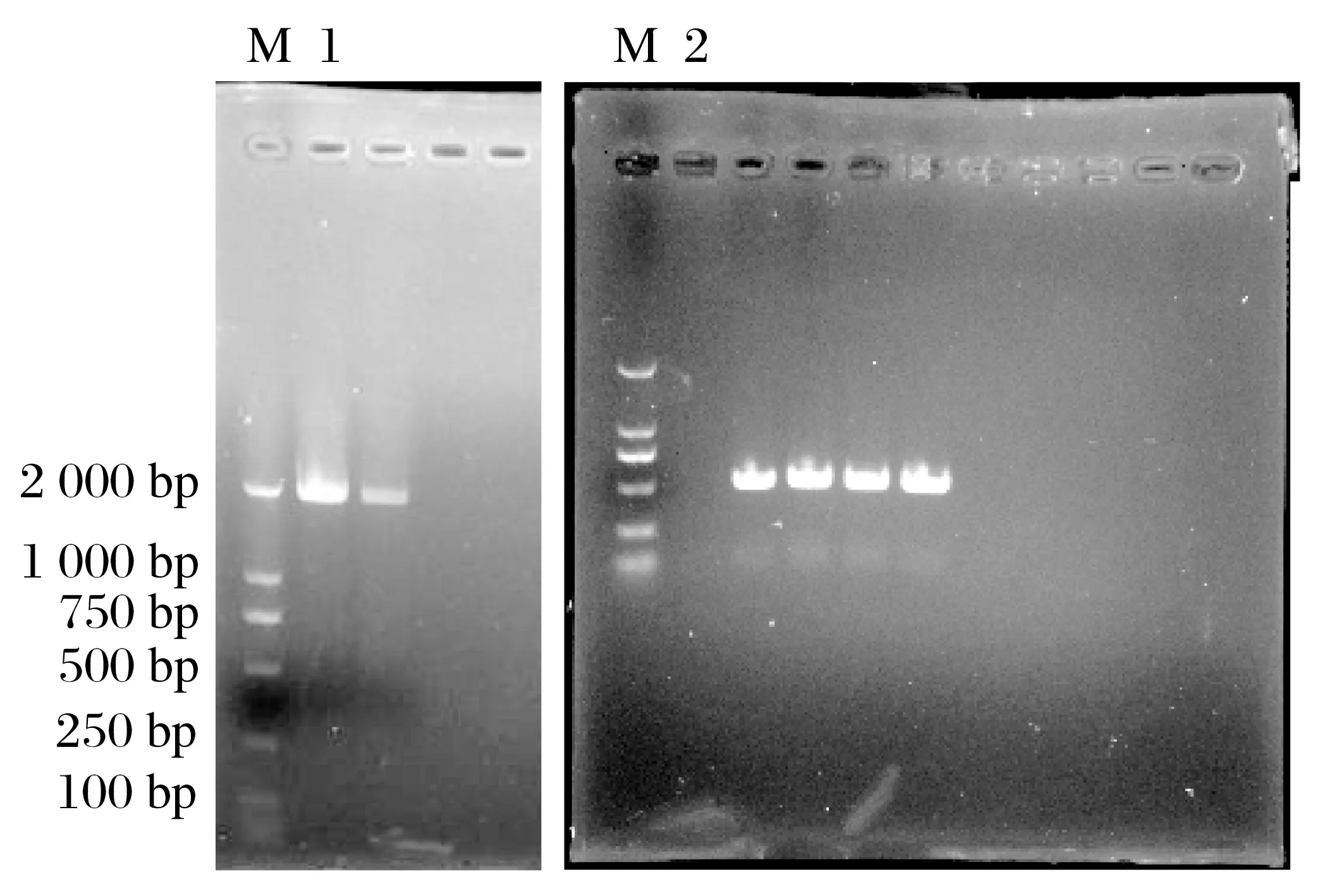
图7 PCR扩增结果Fig.7 PCR amplification results
图8 双酶切鉴定结果Fig.8 Double enzyme digestion identification results
由图7可知,连接产物经转化菌液增殖后进行PCR扩增,核酸电泳结果显示均能够扩增出羊痘病毒80、81基因,表明初步构建载体成功。
由图8 可知,羊痘病毒80、81 重组质粒均可酶切出一条质粒、一条目的基因条带,表明重组质粒构建成功。进一步将重组质粒送往上海生物工程有限公司进行序列测定,其测序结果也表明重组质粒构建成功。
2.5 羊痘病毒80、81基因转染后蛋白毒力(见图9)
由图9 可知,3 个时间段中,羊痘病毒80、81 基因转染Vero 细胞之后蛋白的细胞活力与对照组(pCDNA3.1 质粒)相比差异均不显著(P>0.05),表明细胞中羊痘病毒80、81蛋白均未表现出相关毒性因子。
2.6 羊痘病毒80、81基因转染效果鉴定
转染表达蛋白的Vero细胞破碎后提取基因组PCR扩增羊痘病毒80、81 基因,核酸电泳结果显示均可扩增出80、81基因,表明转染成功,结果见图10。
图10 细胞基因组PCR扩增结果Fig.10 PCR amplification results of cell genome
3 讨论
目前羊痘病毒预防以注射疫苗为主,疫苗主要为常规的灭活疫苗、弱毒疫苗,现阶段对基因工程疫苗和活载体疫苗也进行了探索。灭活疫苗由于效果差而不再使用[6],因此弱毒苗成为常用疫苗。与灭活苗相比,弱毒苗免疫效果明显,免疫力持久,免疫剂量低,但接种后动物后副反应较大,接种部位可能出现痘疹[11-12]。在新型基因工程疫苗方面,Carn等[13]对P32蛋白进行了探索,但由于P32蛋白表达量不高且不稳定等问题,P32 蛋白开发成亚单位疫苗受到了严重制约,因此羊痘病毒疫苗研发仍是需要加以探索的领域。本试验通过分析预测羊痘80、81基因蛋白特性,构建真核表达载体,探究羊痘病毒的80、81核心基因功能,以期为羊痘病毒疫苗的研发提供一定参考。
相比原核表达载体,本研究考虑到羊痘病毒的特性选用真核表达载体进行构建。构建后的羊痘病毒真核表达载体也表明浓度高,质粒与空载体连接容易等优势,与其他研究结论一致[14]。后续进行细胞表达,模拟病毒在细胞中感染过程更接近真实情况。由于真核载体pCDNA3.1质粒中间未插入绿色荧光标签,所以对80、81重组质粒转染效果验证无法使用荧光显微镜进行观察,只能选择转染48 h之后提取基因组进行PCR验证。虽然PCR验证成功,但相比荧光显微镜直接观察仍存在一定不足。80、81基因转染Vero细胞后,运用CCK-8试剂盒检测12~36 h表达蛋白的相关毒力因子[15]。单因素分析结果表明其与单质粒载体转染差异不显著,初步说明其表达蛋白在细胞中无毒力特性。但结合NCBI数据库中的基因预测,80、81基因均为病毒粒子蛋白,所以对其功能还需进一步研究验证。
4 结论
本研究初步构建了羊痘病毒80、81 基因真核表达载体,并验证了其在细胞中表达的蛋白不具备毒性,研究结果为后续羊痘病毒核心基因的研究提供了参考,也为羊痘病毒疫苗的研究提供更多依据。

