胸膜肺炎放线杆菌ApxⅡ蛋白重组腺病毒载体构建及免疫原性研究
颜运秋,黎满香,赵枭健,龙 娉
( 湖南农业大学动物医学院,湖南 长沙 410128 )
猪传染性胸膜肺炎(PCP)是由胸膜肺炎放线杆菌(APP)引起的一种猪呼吸系统的接触性传染病,急性型会导致猪突然死亡[1],是猪场重点防控的疾病之一[2-4]。目前,疫苗防控是预防PCP 的主要途径,国内市场上针对PCP的疫苗主要为灭活疫苗,但因交叉保护力不够等原因导致灭活疫苗使用并不普遍。此外,口服疫苗、亚单位疫苗、基因工程疫苗等可能具有显著的防控效果,有望解决传统疫苗存在的非特异性反应强、免疫效果不确实、保护期短等问题而受到广泛关注[5]。因此,研发有效的新型APP疫苗非常迫切。
APP 的侵袭力和持久性与众多毒力因子相关,Apx 毒素是其主要的毒力因子之一[6]。Apx毒素包括ApxⅠ、ApxⅡ、ApxⅢ和ApxⅣ,其中各型APP的ApxⅡ基因序列几乎完全一致,可作为疫苗的候选基因。重组五型腺病毒载体在新冠肺炎疫苗研究和临床应用中显示出很高的安全性和良好的免疫原性[7-8],在兽医中的研究也较多。肖莉等[9]构建了轮状病毒(PoRV)VP4 基因的重组腺病毒rAd-VP4,免疫猪后分别在第42和28 d产生较高的免疫球蛋白G(IgG)抗体水平,表明rAd-VP4可开发成PoRV的候选疫苗。王灿灿等[10]研究表明,口蹄疫病毒衣壳蛋白的重组腺病毒免疫小鼠后可诱导机体产生高水平的特异性抗体以及干扰素-γ(γ-IFN)和白细胞介素-10(IL-10)应答反应,表明该重组腺病毒具有良好的免疫原性。本研究将APP的ApxⅡ基因克隆到pDC316 穿梭载体,与腺病毒骨架载体pBHGlox(delta)E13Cre 共转染HEK293 细胞,获得携带放线杆菌APXⅡ基因的重组腺病毒载体疫苗rAd-APXⅡ,免疫小鼠后通过检测血清中ApxⅡ特异性抗体水平以及IgG1、IgG2a、IgG2b和IgG3抗体水平判断疫苗的免疫效果,以期为新型APP疫苗的开发提供参考。
1 材料与方法
1.1 试验材料
1.1.1 菌种、质粒及细胞株
大肠杆菌DH5α、腺病毒穿梭载体pDC316 和腺病毒骨架载体pBHGlox(delta)E13Cre由湖南农业大学预防兽医学实验室保存。HEK293腺病毒包装细胞购自ATCC。
1.1.2 试剂、试剂盒和引物
EcoRI、XhoI、T4 DNA 连接酶及Taq DNA 聚合酶(TaKaRa 公司);转染试剂Lipo2000(Invitrogen 公司)。DMEM高糖细胞培养基、胰酶溶液(Hyclone公司);胎牛血清FBS 和双抗(青霉素/链霉素)溶液(Gibco 公司);小鼠IgG1、IgG2a、IgG2b 和IgG3 ELISA 检测试剂盒(武汉伊莱瑞特生物科技有限公司)。其余试剂均为分析纯。
引物为F:GTTCTCGAGACCATGGTAATGTCAAAA ATCACTTTGTC;R:GGGGAATTCTCAGTAGATGCGATTAATGCAGCGA,由通用生物(安徽)有限公司合成。
1.2 试验方法
1.2.1 pDC316-APXⅡ载体构建和鉴定
用引物F/R 扩增APP 基因组DNA 中的APXⅡ基因,将其亚克隆到pDC316 载体中的EcoRI 和XhoI 酶切位点中,转化到大肠杆菌DH5α 感受态细胞中,提取阳性克隆pDC316-APXⅡ的质粒,进行双酶切鉴定。
反应体系(20 µL):pDC316-APXⅡ 6 µL、EcoRI 1 µL、Xho I 1 µL、10×Buffer 2 µL、H2O 10 µL。上述酶切体系37 ℃水浴反应30 min 后,进行1.5%的琼脂糖凝胶电泳鉴定。阳性克隆命名为pDC316-APXⅡ。
1.2.2 rAd-APXⅡ重组病毒包装、纯化和病毒滴度测定
采用中提试剂盒提取pDC316-APXⅡ和pBHGlox(delta)E13Cre 的质粒。在10 cm 培养皿里种1×106个HEK293 细胞,培养到细胞铺满皿底约80%~90%。使用Lipo2000脂质体进行转染,取1 μg pDC316-APXⅡ质粒和3 μg pBHGlox(delta)E13Cre 的质粒加入0.5 mL 无血清的DMEM培养基,同时取10 μL Lipo2000加入0.5 mL无血清的DMEM 培养基中室温静置10 min。将质粒溶液逐滴加入含Lipo2000的溶液中,混匀,室温静置15 min;之后溶液加入HEK293 细胞中,6 h 换含10%FBS 的DMEM 完全培养基继续培养。
细胞长满后按1∶3 进行传代,培养基为10%FBS 的完全培养基;传代3 d 后,每天观察细胞病态反应(CPE);当细胞有明显的CPE现象,且50%以上脱壁时即收细胞进行裂解收集病毒。再次放大培养,接种病毒,收集细胞沉淀,用PBS洗3遍,按照细胞培养上清的1/10体积加入PBS进行细胞重悬,-80、37 ℃反复冻融3次,离心,收集上清。
采用定量PCR 方法测定病毒滴度。引物序列如下:APX Ⅱ -120F:5'-AGAAAGCTGCCGCAGGTGTA-3',APXⅡ-120R:5'-CGACAGGACCAGTTGAAGACAA-3',APX Ⅱ-120PROBE:5'-FAM-ATAGGTAATGTAACAAAAGCGGT-BHQ1-3'。反应体系:2×PCR mix 10 μL、APXⅡ-120F 1 μL、DNA 2 μL、H2O 5 μL、APXⅡ-120R 1 μL、APXⅡ-120PROBE 1 μL。反应条件:95 ℃ 3 min;95 ℃ 15 s,40个循环;60 ℃ 30 s。
1.2.3 rAd-APXⅡ免疫小鼠和血清收集
在小鼠模型上研究重组rAd-APXⅡ疫苗的免疫剂量。选择SPF级别的昆明小鼠(4~6周龄,购自湖南景达实验动物有限公司)20 只,随机分成4 组,每组5 只小鼠。将重组腺病毒载体+生理盐水制成疫苗,注射体积为50 μL。rAd5-Null 组注射未插入基因的空载体包装的重组病毒,rAd-APXⅡ-低组、rAd-APXⅡ-高组注射的是重组腺病毒载体疫苗,并设置疫苗对照组(注射放线杆菌灭活疫苗)。免疫前24 h和疫苗免疫组第二次免疫后第2周采血一次,制备血清冻存于-70 ℃冰箱。试验设计见表1。

表1 试验设计Tab.1 Immune grouping and situation
1.2.4 小鼠血清中APXⅡ抗体的ELISA检测
包被上步制备的APXⅡ蛋白抗原(实验室原核制备和保存),以1 mg/L 浓度,每孔100 μL 包被96 孔酶标板,37 ℃ 2 h,用PBST(PBS+吐温)洗涤。每孔加100 μL 5%脱脂乳的PBST封闭液,37 ℃封闭1 h,洗涤;每孔加入PBS稀释(1∶100)的待检免疫血清,37 ℃孵育1 h,洗涤;每孔加入PBS稀释(1∶2 000)的HRP(辣根过氧化物酶)标记的羊抗小鼠IgG 作为二抗,37 ℃孵育1 h,洗涤;每孔加入100 μL TMB显色液(3, 3', 5, 5'-四甲基联苯胺),室温显色10 min后每孔加入50 μL 2 mol/L的硫酸终止反应,酶标仪测OD450nm值。
1.2.5 小鼠血清中的IgG1、IgG2a、IgG2b 和IgG3 抗体的ELISA检测
严格按照ELISA 试剂盒说明书操作检测血清中的IgG1、IgG2a、IgG2b和IgG3抗体水平。
1.3 数据统计与分析
试验数据采用SPSS 16.0 软件进行统计,方差齐时采用LSD 法进行组间两两对比,方差不齐时采用Dunnett 法进行方差分析;两变量间关系采用直线相关分析。结果以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果与分析
2.1 pDC316-APXⅡ双酶切鉴定结果(见图1)

图1 pDC316-APXⅡ双酶切结果Fig.1 Results of pDC316-APXⅡ double enzyme digestion
由图1可知,试验获得了预期大小的目的片段,说明成功构建了pDC316-APXⅡ载体。
2.2 病毒包装和滴度测定结果
正常、收毒前的Hek293细胞见图2、图3。
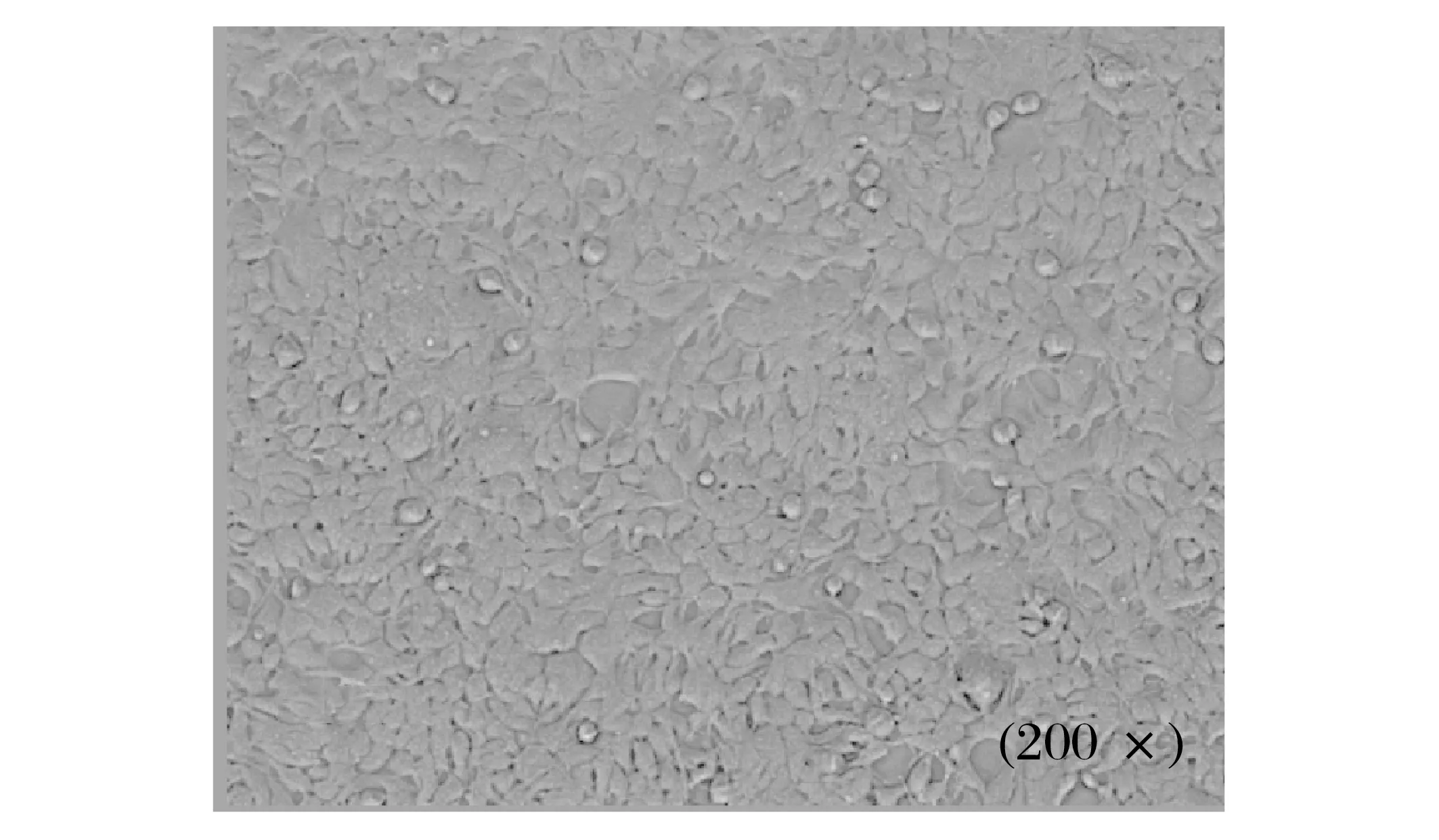
图2 正常的Hek293细胞Fig.2 Normal Hek293 cells
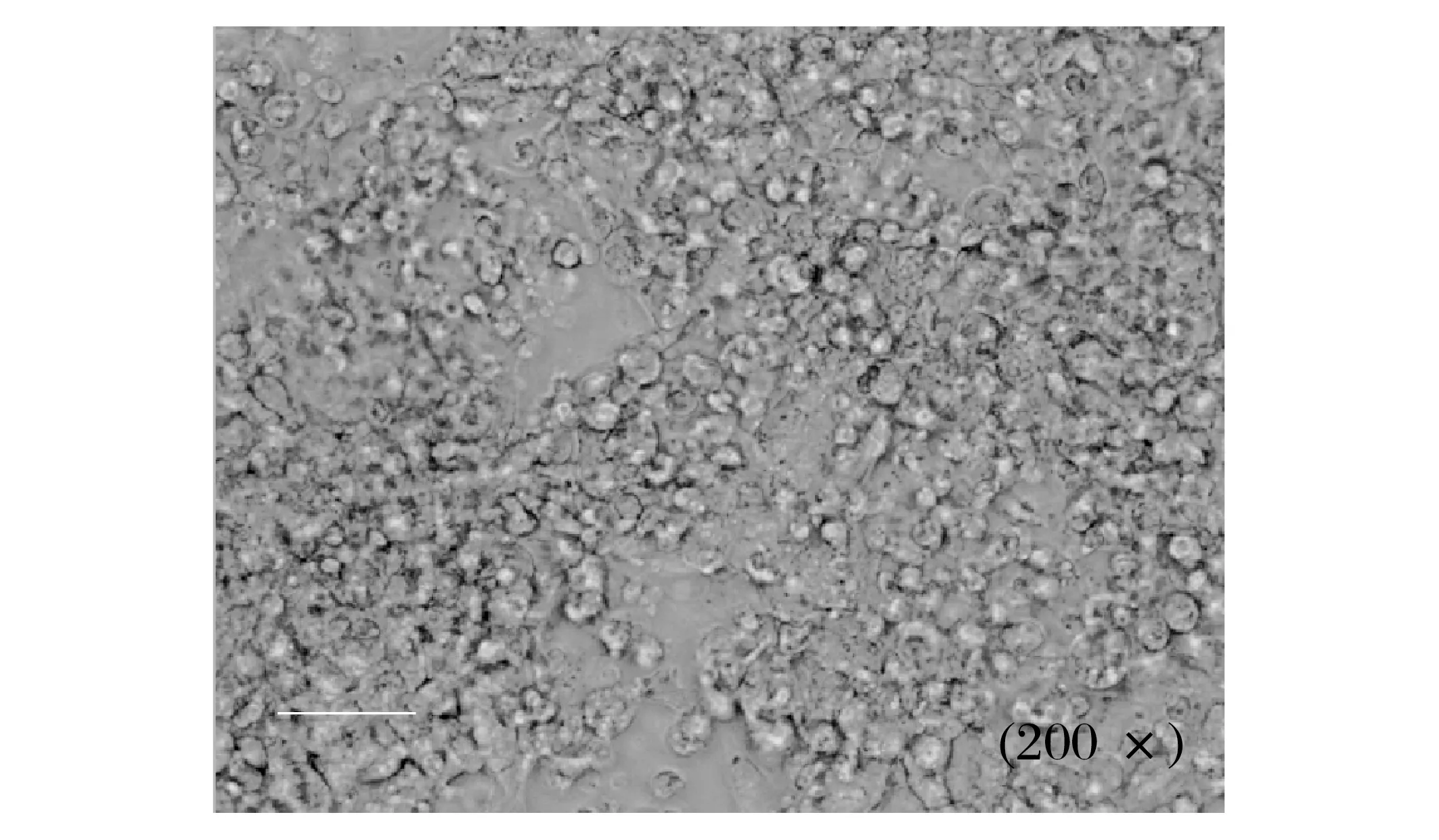
图3 收毒前的Hek293细胞Fig.3 Hek293 cells before exposure
由图2、图3 可知,收毒前的Hek293 细胞变圆脱落,符合腺病毒出毒时的形态。
采用荧光定量PCR检测病毒滴度,根据标准品扩增曲线(见图4)的CT 值和对应浓度计算得到标准曲线方程。病毒样本稀释100倍后,检测的CT值为14.20(见图5),根据标准曲线计算得到病毒滴度为1.20×1010个/mL。

图4 标准品标准曲线Fig.4 Amplification curves of standards

图5 病毒样本滴度Fig.5 Virus sample titer
2.3 免疫后的血清APXⅡ IgG抗体水平(见表2)
由表2可知,rAd5-Null组没有产生特异的APXⅡ IgG抗体;低、高浓度rAd-APXⅡ组均可产生较高的APXⅡIgG 抗体,其中高浓度组产生的抗体水平显著高于低浓度组(P<0.05);疫苗对照组产生的APXⅡ IgG 抗体水平高于rAd-APXⅡ低浓度组(P<0.05),但低于rAd-APXⅡ高浓度组(P<0.05)。
2.4 免疫后的血清IgG1、IgG2a、IgG2b 和IgG3 抗体水平(见表3)

表3 免疫后小鼠血清IgG1、IgG2a、IgG2b和IgG3抗体水平Tab.3 Serum IgG1, IgG2a, IgG2b and IgG3 antibody levels in immunized mice
由表3 可知,低、高浓度rAd-APXⅡ组和疫苗对照组的IgG1、IgG2a、IgG2b 和IgG3 抗体显著高于rAd-Null 组(P<0.05);高浓度rAd-APXⅡ组和疫苗对照组抗体显著高于低浓度rAd-APXⅡ组(P<0.05);高浓度rAd-APXⅡ组抗体水平略高于疫苗对照组,但差异不显著(P>0.05)。结果表明,rAd-APXⅡ组的细胞免疫应答和体液免疫应答水平均得到了显著提高。
3 讨论
本研究中,双酶切鉴定结果显示获得了3 700 bp 的载体片段和925 bp 的目的基因片段,表明试验成功构建了pDC316-APXⅡ载体,为下一步重组腺病毒的包装做好了准备。根据转染前后Hek293 细胞的形态变化,可知转染质粒在细胞内转录和翻译后,组装成的重组病毒量引起细胞变圆和脱落,定量PCR 检测结果表明成功包装了病毒。研究表明,APxⅡ是一种有活性的抗原。杨术杰等[11]在谷氨酸棒杆菌中表达截短的ApxⅡ蛋白可与猪抗ApxⅡ阳性血清进行特异性免疫,研究结果为兽用疫苗产业提供了质量可靠、低成本表达体系。万玉萌等[12]将含APXⅡ的重组质粒转化Rosetta 感受态细胞,通过IPTG 诱导表达,应用His单克隆抗体和临床阳性猪血清对表达的重组蛋白上清进行Western blot 分析。结果表明,APXⅡ重组蛋白可以稳定表达可溶性蛋白,可溶性蛋白能与His 单克隆抗体和临床阳性猪血清发生特异性反应,证明APXⅡ重组蛋白具有良好的免疫反应性。
本研究结果表明,rAd5-Null 组没有产生特异的APXⅡ IgG抗体;低和高浓度rAd-APXⅡ组均可产生较高水平的APXⅡ IgG抗体,且高浓度组产生的抗体显著高于低浓度组;疫苗对照组产生的APXⅡ IgG 抗体水平高于rAd-APXⅡ低浓度组,低于rAd-APXⅡ高浓度组。结果表明,rAd-APXⅡ注射小鼠后能够表达APXⅡ蛋白,同时刺激机体产生特异性的抗体。IgG1水平升高,表明保护性免疫中免疫应答向Th2(体液免疫应答)方向发展;IgG2a 水平升高,提示保护性免疫中免疫应答向Th1(细胞免疫应答)方向发展[13-15]。本研究结果表明,低、高浓度rAd-APXⅡ组和疫苗对照组的IgG1、IgG2a、IgG2b和IgG3抗体水平显著高于rAd-Null 组;高浓度rAd-APXⅡ组和疫苗组抗体水平显著高于低浓度rAd-APXⅡ组;高浓度rAd-APXⅡ组抗体水平略高于疫苗对照组,但差异均不显著。上述结果表明,rAd-APXⅡ组小鼠的细胞免疫应答和体液免疫应答水平均得到显著提高。
综上所述,包含APXⅡ基因的重组腺病毒载体rAd-APXⅡ,仅需一次注射即可刺激机体产生特异性的体液免疫和细胞免疫应答。与灭活苗相比,本研究的重组腺病毒载体rAd-APXⅡ生产成本低,应激小,可作为预防和治疗放线杆菌的疫苗。
4 结论
本研究构建的APP APXⅡ基因的重组五型腺病毒载体rAd-APXⅡ能够产生很好的细胞免疫应答和体液免疫应答水平,为进一步的疫苗研究奠定了基础。

