赤斑羚皮肤成纤维细胞的分离和培养
刘群秀,袁耀华,梁小虎,刘玉良,安俊辉,王东辉,黄茗鑫,蔡志刚*
( 1. 上海城建职业学院,上海 201415 ; 2. 上海动物园,上海 200335 ; 3. 成都大熊猫繁育研究基地,四川 成都 610081 )
赤斑羚(Naemorhedus baileyi)是一类小型哺乳动物,别名红山羊、红岩羊等,属于哺乳纲偶蹄目牛科羊亚科斑羚属(Naemorhedus),为典型的林栖兽类,善攀爬,多集群生活在海拔较高的林缘山地,主要以植物的嫩芽、绿叶为食[1-2]。赤斑羚的分布区域较小,仅栖息于某些亚洲国家,在我国仅分布于西藏东南部和云南西北部。由于栖息地丧失,其种群数量正在急剧减少[3-4]。1996 年,赤斑羚被IUCN列为易危(VU)物种,并于同年被中国濒危动物红皮书评定为稀有动物[5]。目前上海动物园拥有全国唯一的赤斑羚人工圈养种群。虽然国内外对于赤斑羚这一珍稀物种的研究在不断进行中,但目前对其生态学、遗传学、生理学及组织学等方面的研究仍十分匮乏。因此,在现有饲养管理模式的基础上,非常有必要应用分子生物学的方法和手段推进对该物种的保护。
体细胞系的建立和低温保存是研究濒危物种的特性和保存有价值资源的基础和重要方法[6]。皮肤成纤维细胞是皮肤主要的构成成分,对皮肤损伤的修复和再生[7-8]、对抗皮肤衰老具有重要作用[9]。目前有关赤斑羚的各方面研究较少,现有的赤斑羚报道大多是上海动物园提供的在人工圈养条件下的研究发现。赤斑羚是一种具有较大应用价值的濒危动物,有必要建立有效的赤斑羚皮肤成纤维细胞分离培养的方法和体系。基于此,在参考现有的多种实验动物皮肤成纤维细胞获取和培养方法基础上,本研究对赤斑羚原代皮肤细胞进行分离、培养,选出最适赤斑羚皮肤成纤维细胞获取方式,优化培养条件,测定并记录该细胞的生长特性,最终获得可稳定增殖的赤斑羚原代皮肤成纤维细胞,以此为培养赤斑羚皮肤成纤维细胞为基础的科研工作的进一步开展奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 样品采集
样本选自上海动物园繁育的赤斑羚,7岁龄,体重18~20 kg,谱系号:SHZ13-2,身体状态健康。
1.1.2 试剂与仪器
DMEM高糖培养基、磷酸缓冲液(PBS)、胶原酶Ⅰ型、胎牛血清(FBS)、二甲基亚砜、青霉素、链霉素溶液、台盼蓝染液均购自美国Gibco公司。
1.2 试验方法
1.2.1 赤斑羚原代皮肤分离
在实验室内取赤斑羚后腿内侧皮肤,剃毛后,皮肤表面采用20%碘酒和75%乙醇消毒处理,局部麻醉,随后取2 cm×2 cm 大小的全层皮肤,放入含250 U/mL 青霉素和250 mg/L 链霉素的无菌磷酸盐缓冲溶液(PBS)中浸泡。在超净工作台中轻轻刮去表皮细胞和皮下组织,保留真皮层,用眼科剪剪碎至1 cm×1 cm 的小块。用吸管转移至50 mL 离心管内,注入无菌双抗PBS 溶液,重复洗涤3 遍,并弃去洗涤液,将离心管置于冰上保存。
1.2.2 赤斑羚原代皮肤细胞分离
用PBS分别配置0.1% Ⅰ型胶原酶溶液,100目滤膜过滤除菌,随后装入50 mL 离心管,将剪碎的皮肤组织转移至离心管中,37 ℃水浴消化40 min,消化中每10 min 振荡一次。分别采用40 目和100 目的滤膜过滤消化完成的细胞悬浊液,1 200 r/min离心5 min后弃去上清液,将离心管的细胞吹打均匀后移入使用完全培养基的培养瓶,在37 ℃、5% CO2的细胞培养箱培养1~2 d,在此期间观察细胞的贴壁生长情况并根据情况更换同类完全培养基。
1.2.3 赤斑羚成纤维细胞的胰酶消化纯化
每隔2 d 在显微镜下观察细胞贴壁情况,待贴壁细胞长至90%时对细胞进行纯化。弃去培养液后采用PBS 清洗3 次,加入0.25%胰酶,在37 ℃条件下水浴消化细胞。吸取完全培养基反复吹打细胞,直到变圆的成纤维细胞完全均匀混合于培养液中,将液体移至15 mL 离心管,1 200 r/min离心2 min,弃去上清。加入完全培养基重悬细胞,吹打均匀后按1∶2进行传代培养。置于37 ℃、5% CO2的细胞培养箱培养。每间隔2 d 观察一次细胞生长情况,根据细胞贴壁生长情况及时换液和传代。
1.2.4 赤斑羚成纤维细胞冻存
细胞冻存:将生长良好的赤斑羚细胞先用PBS冲洗两遍,再去除漂浮的细胞;用预热浓度为0.25%的胰酶消化贴壁的细胞;其混合液于室温离心,再加入700 μL的完全培养基,溶解均匀后转移到细胞冻存管,并加入200 μL胎牛血清和100 μL二甲基亚砜,混匀。
程序性冻存盒冻存细胞:已加入冻存液的细胞放入程序性冻存盒并放进-80 ℃超低温冰箱储存24 h 后于液氮罐中存放。
1.2.5 赤斑羚成纤维细胞复苏
水浴锅预热至37 ℃,从-80 ℃取出细胞冻存管,放置于水浴锅2~3 min,使冻存液溶解;1 200 r/min 离心3 min,保留沉淀,加入完全培养基,重悬后接种于细胞培养瓶,再加入3 mL 完全培养基,在37 ℃、5% CO2的细胞培养箱中培养。第2 d换液时观察并记录细胞贴壁生长情况。
1.2.6 成纤维细胞生长特性检测
将复苏后的成纤维细胞接种于24 孔板(浓度为1×104个/mL),每孔加入1 mL 细胞悬浮液并进行细胞计数,在37 ℃、5% CO2的细胞培养箱培养,每隔1 d 进行一次细胞计数,每次计数3个孔,连续9 d计数。将所得数据绘制赤斑羚成纤维细胞生长曲线图(以培养时间为横坐标,细胞浓度为纵坐标)。
1.3 数据统计与分析
试验数据采用SPSS 9.0 软件中双尾检验进行分析。结果以“平均值±标准差”表示,P<0.05表示差异显著。
2 结果与分析
2.1 原代培养赤斑羚成纤维细胞形态观察(见图1)
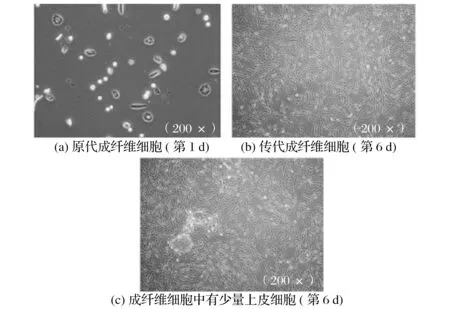
图1 原代培养赤斑羚成纤维细胞形态观察Fig.1 Primary culture of Naemorhedus baileyi fibroblasts
用胶原酶消化法解离的细胞在贴壁1 d 后,细胞向外伸展出现生长晕,主要成分为成纤维细胞和上皮细胞。由图1可知,培养4 d后成纤维细胞成为优势生长细胞。10 d时细胞密度达到80%以上,此时进行第一次传代,得到传代细胞。传代细胞快速贴壁生长,12~14 d 后细胞密度可达90%,表明细胞生长状态良好。倒置显微镜下观察成纤维细胞大多呈现细长梭状,胞体中央可见扁圆的细胞核,并伴有少量铺路石状的上皮细胞。
之后对含有上皮细胞的成纤维细胞使用差速贴壁法进行纯化,并对原代成纤维细胞经首次传代成功后所繁殖的细胞群体用于细胞系的构建。
2.2 赤斑羚成纤维细胞的冻存前及复苏后的活率(见表1、图2)

表1 赤斑羚成纤维细胞冻存前及复苏后细胞数Tab.1 Number before and after cryopreservation of Naemorhedus baileyi fibroblast cells

图2 冻存前后赤斑羚成纤维细胞活率的比较Fig.2 Comparison of fibroblast viability of Naemorhedus baileyi before and after cryopreservation
由表1 可知,第6 代赤斑羚成纤维细胞冻存前活率和复苏后细胞活率均在80%以上,适用于之后的研究。
由图2可知,冻存前后细胞活率差异不显著(P>0.05),表明冻存和复苏条件均适用于该细胞,细胞活力可完全满足细胞复苏及后续试验的要求。
2.3 赤斑羚成纤维细胞生长曲线(见图3)

图3 赤斑羚成纤维细胞生长曲线Fig.3 Growth curve of fibroblasts from Naemorhedus baileyi
由图3 可知,赤斑羚成纤维细胞生长曲线呈典型的“S”型,细胞的生长均经历了增长期、对数期和平台期,符合细胞在体外的生长规律。刚接到24孔板时,细胞生长速度缓慢且基数较少;从第4 d 开始,细胞生长速度显著加快,呈对数增长;第8 d 由于空间有限出现接触性抑制生长,且细胞数量较大,可能养分较少,出现细胞减少的现象。
3 讨论
已知赤斑羚分布范围包括印度的东南部、西藏自治区、云南省西北部、缅甸北部等区域[10-11]。由于赤斑羚分布广且分布区域的样本数稀少,目前关于其系统发育和分类地位尚不明确。Xiong等[12]对赤斑羚、长尾斑羚、喜马拉雅斑羚和中国斑羚进行了测序,并与GenBank中的中华斑羚(Naemorhedus caudatus:No. AY356357、FJ469673、U17861)、Nemorhaedus caudatus raddeanus(No.EU259099-EU259107、EU259195-EU259198)、斑羚(Naemorhedus goral:No.EU259118)、灰斑羚(Naemorhedus griseus:No.FJ207532、JN632664)、赤斑羚(Naemorhedus baileyi:No.JN632663、JX506309、JX506311、JX506310)序列进行了比较,发现赤斑羚是独立于它们的物种。但由于种群分布地和种群大小的关系,并没有太多的样本数据用于支撑分子进化的讨论,因此不能很好地解释赤斑羚的分类问题,今后关于斑羚属分类问题仍需要进一步研究[13]。
胶原酶消化法[14]以及组织培养法[15]是细胞分离的经典方法。由于组织培养法极易发生污染,一般多选用胶原酶消化法[16]。由于胶原酶解离细胞会损伤细胞,因此温度、酶浓度、处理时间尤为关键。在37 ℃时,酶浓度过高或消化时间过长,容易导致细胞破损死亡,造成剩余未损伤细胞不易贴壁生长,反之酶浓度过低或消化时间过短,则消化不完全,获得细胞量不多。本试验中,由于赤斑羚皮肤组织样本的珍贵性,在胶原酶消化过程中采取消化赤斑羚皮肤成纤维细胞的消化时间,结果得出胶原酶消化45 min是适用于赤斑羚皮肤成纤维细胞的消化时间[17-18]。
体细胞的建立和保存不仅是保存重要物种种质资源的必要条件,而且为基因组和体细胞发育研究提供了有价值的数据。自1996年以来,赤斑羚已成为我国濒危野生动物,因此建立赤斑羚皮肤成纤维细胞系很有必要。随着体细胞核移植技术(SCNT)的不断革新与成熟,该技术已被广泛用于拯救濒危物种[19-20]。SCNT通常以去核卵母细胞为受体,供体采用单细胞核,是一种将体细胞核转入成熟的去核卵母细胞中,从而激活新的克隆胚胎,进而培育出基因型与供体体细胞一致的克隆动物的方法。但体细胞核移植的效率和成功率仍然很低,其中一个重要的环节就是挑选核移植供体,而成纤维细胞质量好,有利于重构胚胎的发育,是最常用的供体细胞[21-22]。有研究以小熊猫皮肤成纤维细胞为供体,兔卵泡为受体成功获得了可发育的小熊猫-兔种间胚胎,进而充分肯定了皮肤成纤维细胞在珍稀动物种资源保护中所占的重要地位[23-24]。本试验成功培养了赤斑羚成纤维细胞,使赤斑羚基因组DNA 材料得以保存,为后续试验开展以及资源保护奠定了基础。
4 结论
本研究采用胶原酶消化法对赤斑羚的后腿内侧皮肤组织进行原代培养,择优培养出原代成纤维细胞,并通过传代使细胞进一步纯化。通过生物学特性检验确定了本试验所得的成纤维细胞有贴壁增长快、形态稳定等特点,可见本研究成功建立了培育赤斑羚成纤维细胞系的方法,也为赤斑羚的相关研究、濒危物种资源的保护以及赤斑羚体内皮肤治疗提供了理想的生物学材料和依据。

