结核分枝杆菌Rv0081基因编码蛋白的生物信息学分析
杨雨婷, 杨国平,2*
(1.大理大学 基础医学院医学微生物学及免疫学教研室,云南 大理 671000;2. 大理大学 云南省昆虫生物医药研发重点实验室,云南 大理 671000)
结核病是由结核分枝杆菌(Mycobacteriumtuberculosis, Mtb)感染引起的危害人类健康的慢性传染病,是全球十大致死原因之一。WHO最新结核病流行病学报告指出,每年约有1 000万人感染Mtb,140万人死于结核病,且全球约有17亿人口为Mtb潜伏感染者[1-5]。近年来,由于HIV合并感染、耐药菌株的产生及卡介苗预防效果不佳等原因,结核病的发病率明显上升,结核病的防治面临着巨大挑战。因此,开发安全、高效的新型结核疫苗对控制Mtb在全球范围内的流行具有重要意义。以蛋白抗原表位为基础合成的多肽疫苗可通过提供大量特异性抗原精确启动高效的保护性体液免疫和细胞免疫,且易于生产、储存,产生的副作用较小[6-10]。因此,对Mtb蛋白的抗原表位进行预测,并对所预测结果进行综合分析从而筛选出优势抗原表位,将为新型结核疫苗的研制奠定坚实的理论基础。Mtb休眠生存调节因子(Dormancy survival regulator,DosR)通过调节约48个休眠相关基因的表达而使Mtb进入休眠状态,与Mtb潜伏感染密切相关[11]。Rv0081基因是DosR调节系统中一个重要的转录调节因子,其编码的Rv0081蛋白参与Mtb在低氧等应激条件下的存活,是Mtb进入休眠状态的标志性抗原[12-13]。研究发现,Rv0081蛋白可通过促进全血细胞分泌干扰素(Interferon, IFN)-γ、白介素(Interleukin, IL)-12p70等细胞因子启动机体的适应性免疫反应,还可促进全血细胞分泌具有抗菌效应的促炎因子如肿瘤坏死因子(Tumor necrosis factor, TNF)-α、IL-6等发挥抗Mtb感染作用[14-15],表明该蛋白具有一定的免疫原性,有可能成为预防及诊断Mtb潜伏感染的潜在靶点。本研究应用多种生物信息学分析软件对Mtb Rv0081蛋白的生物学特征及抗原表位进行预测,为今后深入系统的分析Rv0081蛋白的免疫特性及研发新型结核疫苗提供参考。
1 材料与方法
1.1 材料
Rv0081蛋白的生物信息学分析所用分析软件及网址见表1。

表1 Rv0081蛋白的生物信息学分析相关软件Table 1 Software related to bioinformatics analysis of Rv0081 protein
1.2 方法
1.2.1 Rv0081蛋白氨基酸序列的获取 从NCBI网站获取Mtb Rv0081蛋白的氨基酸序列(NC_000962.3),该蛋白含114个氨基酸。经BLAST比对,该蛋白氨基酸序列与卡介苗菌株中的Rv0081蛋白氨基酸序列同源性为100%。
1.2.2 Rv0081蛋白的理化性质分析 运用生物信息学分析软件ExPASy中的ProtParam及ProtScale对蛋白的理化性质如氨基酸数目、消光系数、等电点、半衰期、不稳定系数及亲疏水性进行分析。
1.2.3 跨膜区、信号肽及亚细胞定位预测 TMHMM、SignalP-5.0 Server预测蛋白的跨膜区及信号肽,综合运用softberry及WoLF PSORT分析蛋白的亚细胞定位。
1.2.4 Rv0081蛋白的结构预测 使用SOPMA、DNAStar及SWISS-MODEL分别预测蛋白的二、三级结构。
1.2.5 Rv0081蛋白糖基化及磷酸化位点的预测 利用在线软件NetNGlyc-1.0 Server及NetPhos 3.1 Server预测蛋白糖基化及磷酸化位点。
1.2.6 Rv0081蛋白抗原表位的预测分析 运用DNAstar预测蛋白的B细胞抗原表位,综合分析蛋白的理化性质、二级结构、表面可及性、柔韧性及抗原指数筛选出优势B细胞抗原表位。运用SYFPEITHI、NetCTL 1.2 Server、Net MHC pan 4.1 server预测蛋白的CTL细胞抗原表位, SYFPEITHI及Net MHCⅡpan 4.0 server预测蛋白的Th细胞抗原表位,综合分析各软件预测结果,筛选出评分均较高的氨基酸序列作为优势CTL及Th细胞抗原表位。
2 结果与分析
2.1 Rv0081蛋白的理化性质生物信息学分析
结果显示Rv0081蛋白分子式为C543H914N160-O163S2,相对分子质量为12 356.32,理论等电点为8.12,主要由亮氨酸(15.8%)、丙氨酸(14.0%)及精氨酸(10.5%)组成。序列中带正电荷的氨基酸残基数为(精氨酸+赖氨酸)16个,带负电荷的氨基酸残基数为(天冬氨酸+谷氨酸)15个,原子总量为1 782,在A280处消光系数为2 980,不稳定系数为39.12小于40,表明该蛋白在体外为稳定蛋白质。在哺乳动物体外半衰期为30 h,在酵母菌体内半衰期>20 h,在大肠埃希菌体内的半衰期>10 h,满足原核表达系统的表达条件,可在体外诱导表达Rv0081蛋白。亲疏水性预测结果显示,该蛋白序列总平均亲水性为 0.144,序列中位于35位的色氨酸(Ser)亲水性最强,为-1.414,位于89位的丙氨酸(ALa)疏水性最强,为1.67,预测结果与TMPred基本一致,预测该蛋白为疏水性蛋白(图1),提示该蛋白可能以包涵体形式存在于细菌裂解液中,后期可通过大肠埃希菌原核表达系统对该蛋白存在形式进行验证。
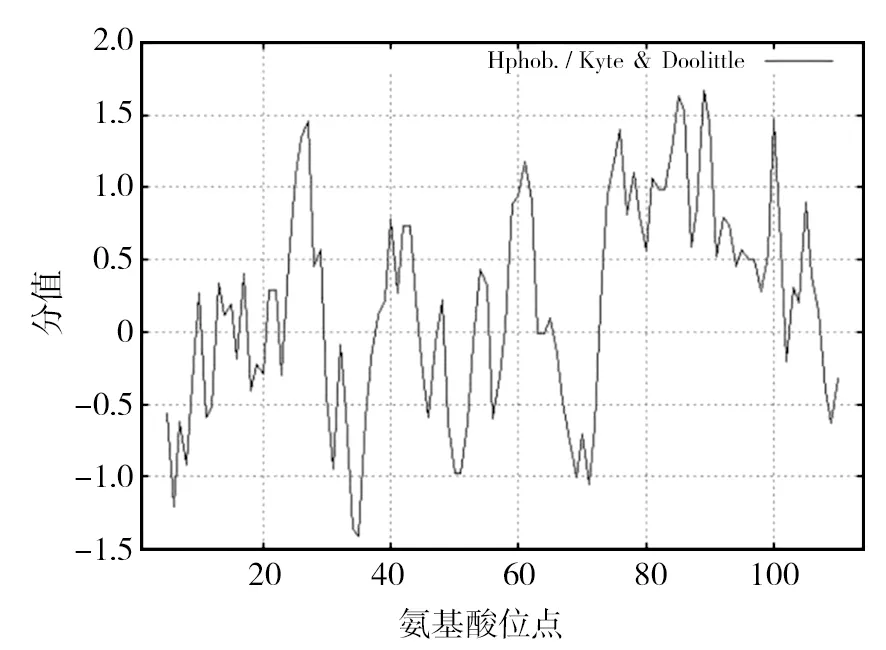
图1 Rv0081蛋白的亲疏水性分析Fig.1 Analysis of Hydrophilicity and hydrophobicity of Rv0081
2.2 Rv0081蛋白的跨膜区、信号肽及亚细胞定位
使用TMHMM及SignalP-5.0 Server在线软件分别对Rv0081蛋白的跨膜结构、信号肽进行预测。结果显示该蛋白具有胞内域及胞外域两个部分,无跨膜结构(图2A),无信号肽(图2B),提示该蛋白属于非分泌型蛋白,该蛋白进入宿主细胞发挥调控作用需借助非经典途径。综合分析softberry及WoLFPSORT亚细胞定位预测结果,预测该蛋白存在于细胞质中。
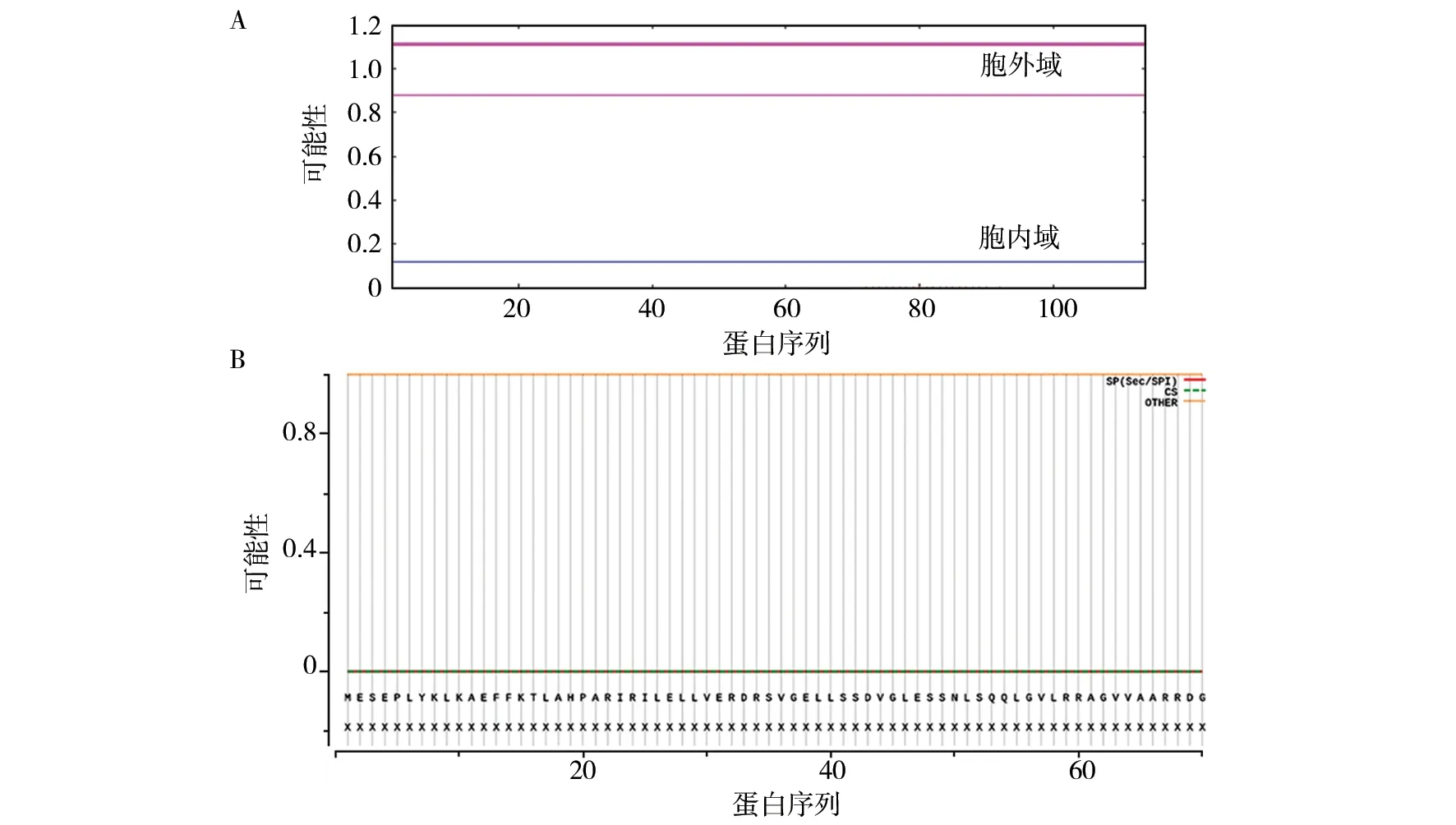
图2 Rv0081蛋白跨膜区及信号肽Fig.2 Prediction of Rv0081 transmembrane and signal peptideA:Rv0081蛋白跨膜区预测;B:Rv0081蛋白信号肽预测A:The prediction of the transmembrane region of the Rv0081 protein; B:The prediction of the signal peptide of the Rv0081 protein
2.3 Rv0081蛋白结构分析
运用SOPMA、DNAStar、SWISS-MODEL对Rv0081蛋白的二、三级结构进行预测,结果显示Rv0081蛋白的二级结构由74个α-螺旋(64.91%)、9个β-转角(7.89%)、21个无规则卷曲(18.42%)及10个延伸链(8.77%)构成(图3),与DNAStar预测结果基本一致;三级结构预测结果显示该蛋白含有大量的α-螺旋及无规则卷曲(图4),与二级结构预测结果一致。由于α-螺旋、β-转角及无规则卷曲易于扭曲、折叠,较易形成与B细胞表面受体(BCR)嵌合的结构,而该蛋白存在较多上述结构,提示该蛋白可能存在较多B细胞抗原表位。
2.4 Rv0081蛋白糖基化及磷酸化位点分析
蛋白的糖基化及磷酸化修饰是重要的蛋白质翻译后修饰,可通过影响蛋白质的电荷状态、疏水性、构象及稳定性而影响其功能。NetNGlyc-1.0分析结果显示,Rv0081蛋白在第50位有一个糖基化位点(图5A);NetPhos 3.1 Server分析结果显示,Rv0081蛋白共存在7个氨基酸磷酸化位点,其中含6个丝氨酸磷酸化位点及1个酪氨酸磷酸化位点(图5B),提示该蛋白可能参与细胞间的信号转导从而调控宿主细胞的功能。
2.5 与Rv0081相互作用蛋白的预测
运用STRING数据库预测能与Rv0081相互作用的蛋白,结果显示与Rv0081相互作用的10个蛋白评分从高到低为hycE、hycP、Rv0088、Rv0083、hycD、hycQ、Rv0082、devR、Rv0080、Rv0079(图6)。通过分析Rv0081的相互作用蛋白,预测Rv0081蛋白可通过与Toll样受体(Toll-like receptor, TLR)-2结合刺激巨噬细胞和外周血单核细胞分泌IFN-γ、TNF-α、IL-1β、IL-8等细胞因子,参与肉芽肿的形成及维持,减少Mtb的生长,从而控制Mtb在机体内的复制及传播;此外,该蛋白还可能与抑制蛋白质合成有关并参与氧化还原反应。提示该蛋白可能能增强巨噬细胞的抗菌效应,可作为研发新型多肽疫苗的候选抗原。
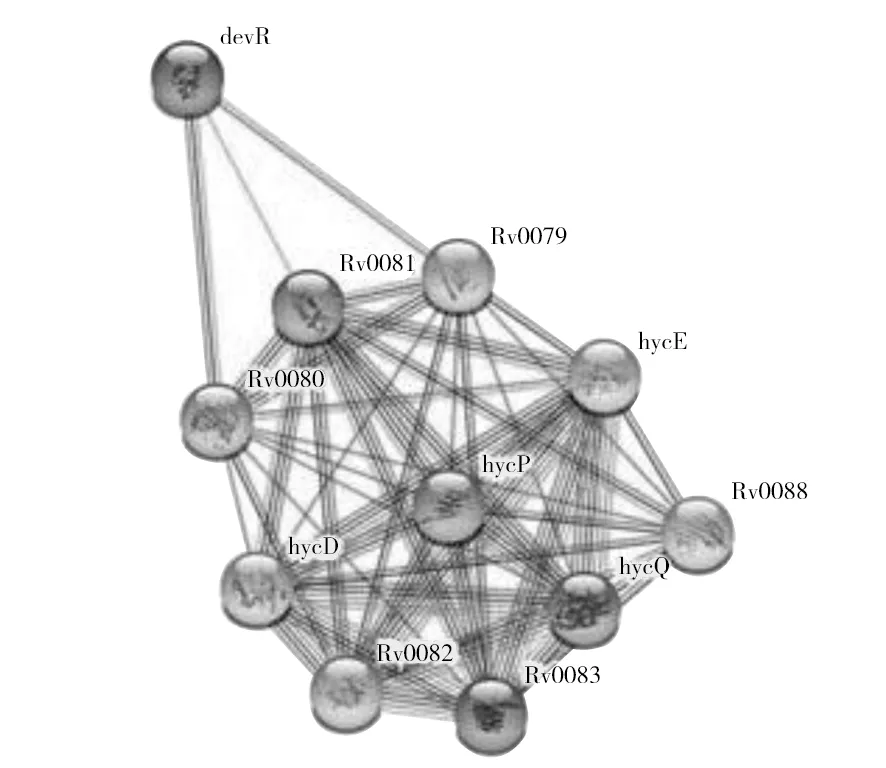
图6 Rv0081蛋白相互作用网络Fig.6 Rv0081 protein interaction networks
2.6 Rv0081蛋白抗原表位预测
抗原表位是抗原分子上能与T、B细胞特异性结合并刺激其产生能特异性识别该抗原的致敏淋巴细胞及抗体的免疫活性区,对蛋白抗原表位进行深入研究并筛选出优势抗原表位,对研发新型结核疫苗及开发高效诊断试剂具有重要意义。本研究运用DNAStar、SYFPEITHI、NetCTL 1.2 Server、NetMHC pan 4.1 Server、NetMHCⅡpan 4.0 Server等生物信息分析软件对RV0081蛋白T、B细胞抗原表位进行预测,综合分析后筛选出优势抗原表位。
2.6.1 B细胞抗原表位预测 DNAStar 分析结果显示,Rv0081蛋白氨基酸存在于表面可能性较大的区域为1~7、9~10、30~35、48~52、66~70位氨基酸残基,其余位置存在于蛋白表面可能性较小;蛋白柔韧性较大易与B细胞表面抗原受体结合,形成表位可能性较大的区域为5~10、32~54、67~70、105~106、107~111位氨基酸残基;DNAStar预测该蛋白共有11个B细胞抗原表位:1~7、9~13、19~25、29~37、40~53、57~61、65~71、79~83、89~93、96~103、105~113位氨基酸残基(图7)。综合分析Rv0081蛋白的二级结构(α-螺旋、β-转角及无规则卷曲)、亲水性、柔韧性、表面可及性及抗原指数筛选出6个优势B细胞抗原表位:1~7、28~37、39~53、57~62、65~71、105~113位氨基酸残基(表2),提示该蛋白可启动机体的体液免疫反应。
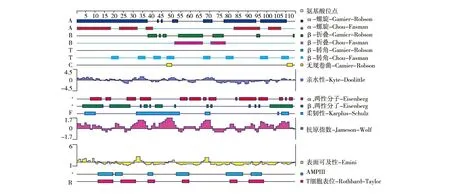
图7 Rv0081蛋白B细胞抗原表位预测Fig.7 Prediction ofB cell epitope of Rv0081
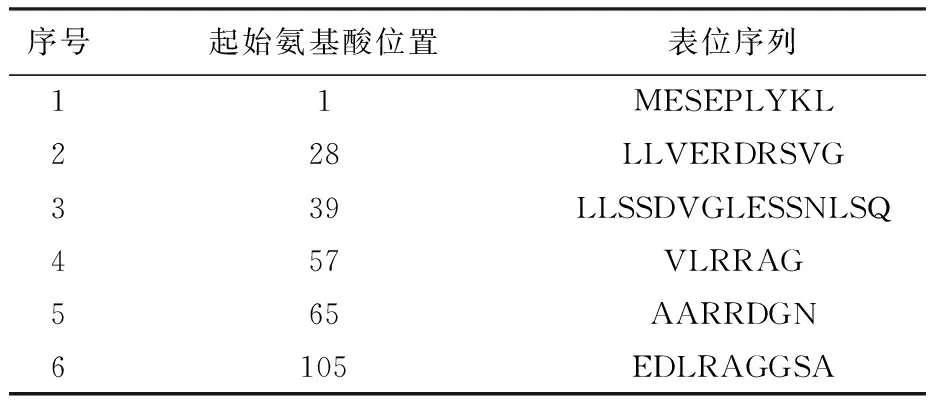
表2 Rv0081蛋白优势B细胞抗原表位信息Table 2 Information dominant B cell epitope of Rv0081 protein
2.6.2 CTL细胞抗原表位预测 综合分析多款软件预测结果可以弥补不同软件在预测过程中的缺陷,提高预测结果的准确性,因此本研究运用3种不同的CTL表位分析软件预测Rv0081蛋白HLA-A2*0201、HLA-A3*0301、HLA-B7*0702三种类型的CTL抗原表位(表3),综合分析三种预测结果后筛选出6个优势CTL细胞抗原表位(表4),提示该蛋白可启动由CD8+T介导的CTL型细胞免疫反应。
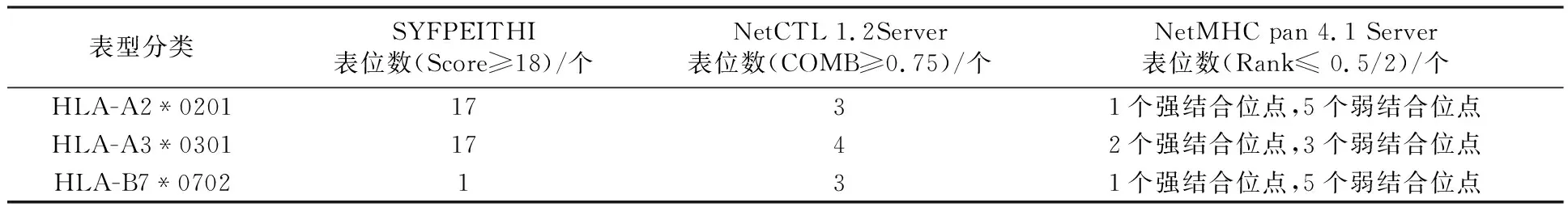
表3 Rv0081蛋白CTL细胞抗原表位预测Table 3 Prediction of CTL epitope of Rv0081
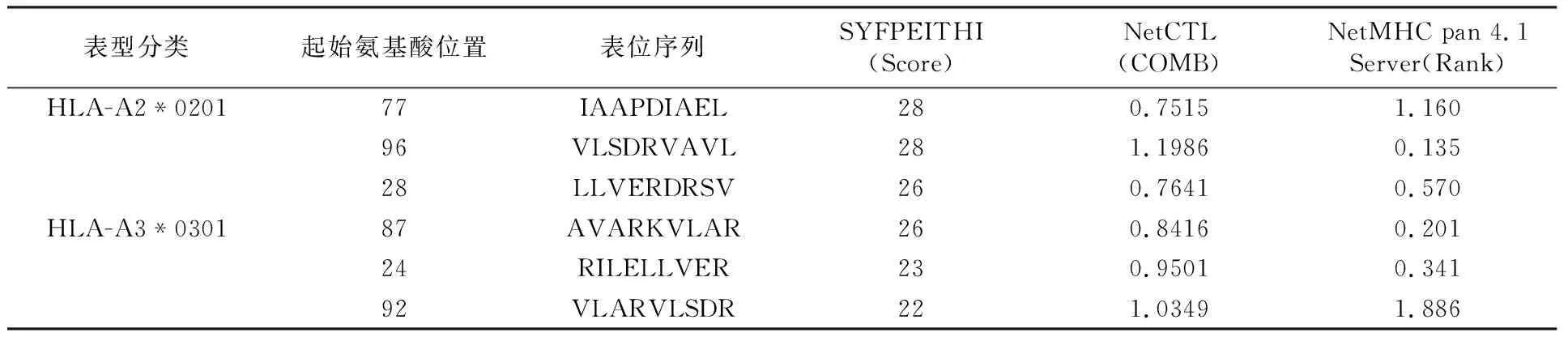
表4 Rv0081蛋白优势CTL细胞抗原表位信息Table 4 Information dominant CTL cell epitope of Rv0081 protein
2.6.3 Th细胞抗原表位预测 运用SYFPEITHI、NetMHC II pan 4.0 Server软件预测Rv0081蛋白HLA-DRB1*0101、HLA-DRB1*0401、HLA-DRB1*0701、HLA-DRB1*1101、HLA-DRB1*1501限制性Th细胞表位(表5),筛选出NetMHC II pan 4.0 Server预测的强结合表位且SYFPEITHI得分较高的序列作为Th细胞优势抗原表位(表6),提示该蛋白可启动由CD4+T介导的Th型细胞免疫反应。

表5 Rv0081蛋白Th细胞抗原表位预测Table 5 Prediction of Th epitope of Rv0081

表6 Rv0081蛋白优势Th细胞抗原表位信息Table 6 Information dominant Th cell epitope of Rv0081 protein
3 讨 论
由Mtb感染引起的结核病是严重危害人类健康的全球性公共卫生问题。目前全球约有1/4人口为Mtb潜伏感染者,其体内潜伏期Mtb的重新激活是结核病的重要来源[5]。因此,识别潜在的Mtb潜伏相关抗原,以产生抵御潜伏期Mtb的保护性免疫反应,对于设计有效的新型结核疫苗至关重要。
生物信息学是由生物学、计算机科学、应用数学等学科相互交叉融合而成的一门新兴学科,基于生物信息学分析工具从全基因水平筛选具有保护性免疫反应的候选抗原表位的反向疫苗学已被广泛运用于新型多肽疫苗的研发[16-19]。本研究运用生物信息学技术对Mtb潜伏期相关抗原Rv0081蛋白的生物学特征及表面抗原进行预测。分析结果显示,Rv0081蛋白为稳定的疏水性蛋白、无跨膜区及信号肽,含有1个糖基化位点及7个磷酸化位点,提示该蛋白属于非分泌型蛋白,可能参与细胞间的信号转导;该蛋白能与hycE、hycP、Rv0088、Rv0083、hycD、hycQ、Rv0082、devR、Rv0080及Rv0079等蛋白产生相互作用,可能与抑制蛋白质合成及氧化还原反应有关,还可通过与巨噬细胞和外周血单核细胞表面的TLR2结合刺激细胞产生IFN-γ、TNF-α、IL-1β和IL-8等细胞因子增强机体的抗Mtb感染作用;其二级结构主要由α-螺旋(64.91%)、β-转角(7.89%)和无规则卷曲(18.42%)构成,提示该蛋白可能含有较多能与B细胞表面受体相结合的抗原表位。表面可及性及柔韧性分析结果显示,Rv0081蛋白中可能存在于蛋白表面、易发生扭曲和折叠的氨基酸序列较少,形成B细胞抗原表位的可能性较小。为提高表位预测的特异性、准确性和适用性,本研究综合分析Rv0081蛋白的亲水性、表面可及性、柔韧性、抗原指数及二级结构并筛选出6个各软件评分均较高且存在于无规则卷曲及β-转角中的氨基酸序列作为B细胞优势抗原表位:1~7、28~37、39~53、57~62、65~71、105~113位氨基酸残基。
Mtb属于胞内寄生菌,感染早期主要由CD4+T细胞介导的1型辅助性T细胞(T helper type 1,Th1)型免疫反应发挥抗感染作用,感染晚期主要由CD8+T细胞和自然杀伤细胞发挥细胞毒作用杀灭吞噬Mtb的巨噬细胞,启动由T细胞介导的适应性免疫反应是防御Mtb感染的重要途径。研究表明,蛋白质抗原不能通过其完整的分子发挥功能,而是通过其表位分子反映抗原特异性,T细胞表位是触发表位特异性保护性T细胞免疫反应的基础,也是研发和设计新型结核疫苗、诊断试剂和治疗药物的关键[11,20-23]。联合应用多个MHC限制性表位可诱导针对不同HLA基因位点的T细胞免疫反应,拓宽免疫反应人群[24]。HLA-A2*0201、HLA-A3*0301、HLA-B7*0702是最常见的MHC-Ⅰ类分子[25-27],与蛋白表面抗原结合后启动机体细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL)型免疫反应。本研究运用3种不同的CTL表位预测软件对Rv0081蛋白的HLA-A2*0201、HLA-A3*0301、HLA-B7*0702表位进行预测,综合分析各软件预测结果后筛选出6个优势CTL细胞抗原表位:77~85、96~104、28~36、87~95、24~32、92~100位氨基酸残基。HLA-DRB1*0101、HLA-DRB1*0401、HLA-DRB1*0701、HLA-DRB1*1101及HLA-DRB1*1501是最常见且研究较为广泛的MHCⅡ类分子[28-30],与抗原表位结合后启动Th1型免疫反应。本研究运用SYFPEITHI、NetMHCⅡpan 4.0 预测Rv0081蛋白的Th细胞表位,综合分析两个软件预测结果后筛选出评分均较高的序列作为优势抗原表位,共筛选出7个优势Th细胞抗原表位:71~85、10~24、55~69、98~112、10~24、83~97、82~96位氨基酸残基。
本研究结果表明理论分子量为12 356.32的Rv0081蛋白为稳定蛋白质,可在体外诱导表达,且含有多个潜在的B、T细胞抗原表位,其中28~37位氨基酸残基为B细胞及CTL细胞共同优势抗原表位,55~69及98~112位氨基酸残基为B细胞及Th细胞共同优势抗原表位,71~85、82~96、83~97位氨基酸残基为Th细胞及CTL细胞共同优势抗原表位,以这些共同表位为基础合成的多肽疫苗可同时启动机体的体液免疫及细胞免疫,还可对不同感染阶段的Mtb进行杀伤[31],从而更好地控制Mtb在体内的存活。这些结果共同表明,Rv0081蛋白可作为研发预防潜伏期Mtb重新激活的新型结核疫苗的候选优势抗原。今后,将通过免疫实验(如ELISA)进一步验证所筛选出的优势抗原表位,为新型结核疫苗的研制提供参考。

